VRK1在弥漫大B细胞淋巴瘤中的表达及临床意义
2020-10-15仲小敏万一元
仲小敏,刘 华,蒋 超,仲 琴,万一元
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)是非霍奇金氏淋巴瘤中最常见的一个亚类,在免疫学、遗传表型、形态以及预后转移等方面具有高异质性,临床表现多样、复杂[1-2]。不断增加的全基因组、转录组等高通量测序数据对DLBCL遗传机制提供了研究基础。牛痘相关激酶1(vaccinia-related kinase 1, VRK1)是丝氨酸-苏氨酸激酶VRK家族中的一员,参与细胞分裂、转录激活、DNA修复和组蛋白修饰等[3-4]。诸多研究[5-9]报道VRK1在不同肿瘤中存在差异表达,对肿瘤的发生发展具有调控作用,如VRK1在胶质瘤、乳腺癌、肝细胞癌、食管鳞状细胞癌、肺癌中发生突变或差异表达,且调控肿瘤的发生发展过程。然而目前还未有VRK1在DLBCL中功能及其作用机制的深入报道。该研究旨在探讨VRK1在DLBCL中表达及其与临床病理、预后关系,对DLBCL细胞凋亡能力的影响。
1 材料与方法
1.1 组织样本及主要试剂
1.1.1病例资料及实验细胞 收集2010年6月~2016年6月就诊于南京医科大学附属淮安第一医院,经手术切取组织且病理确诊为DLBCL的患者98例。收集入组患者的临床病理资料和随访数据,随访时间从疾病确诊之日至2018年10月。选取62例淋巴结反应性增生组织(reactive hyperplasia lymphoid, RHL)作为对照。正常B细胞永生化细胞系HMy2.CIR和DLBCL细胞系SU-DHL-4、OCI-Lyl9、OCI-Ly3、VAL、SU-DHL-2、SU-DHL-6均购自中科院上海细胞库。
1.1.2主要试剂 VRK1、内参GAPDH一抗抗体购自英国abcam公司;高效RIPA细胞裂解液、Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自北京索莱宝生物公司;提取RNA TRIzol试剂、反转录试剂盒、real-time 反应试剂盒、转染试剂Lipo 2000购自美国Thermo Scientific公司。
1.2 方法
1.2.1Western blot检测细胞VRK1表达 收集细胞,提取总蛋白,BCA法进行蛋白定量。SDS-PAGE凝胶电泳,转膜,转移到5%脱脂奶粉封闭液于室温封闭1 h。PVDF膜分别加入VRK1(1 ∶1 000)和GADPH(1 ∶2 000)一抗,4 ℃轻摇过夜;随后加入相应的二抗(1 ∶2 000),37 ℃恒温摇床孵育l h。显影。
1.2.2RT PCR检测VRK1和XRCC3、CDC20 mRNA表达 TRIzol法提取组织总RNA,取10 μl RNA进行反转录,采用GAPDH作为内参进行相对定量分析,定量反应体系按照12.5 μl SYBR Premix Ex Taq、1 μl PCR Forward Primer、1 μl PCR Reverse Primer、2 μl cDNA模板、8.5 μl ddH2O,总体积为25 μl,每个样品设置3个平行孔。扩增程序为:预变性95 ℃、30 s;95 ℃、5 s,60 ℃、20 s,40个循环;采用2-ΔΔCt法计算VRK1和XRCC3、CDC20 mRNA的相对表达量。各基因特异性引物如下:VRK1(F:5′-GGTCTGCGGCTTAGGTGAAA-3′,R:5′-CCTTGGCCAATGGGTAATCCT-3′)、XRCC3(F:5′-GAAGAGGAGTGCGGAACCC-3′,R:5′-TCTGTCACTCTCTGGGGCTT-3′)、CDC20(F:5′-CCTCCTGAGCAAGGAGAACC-3′,R:5′-CTGATAACCCTCTGGCGCAT-3′)。
1.2.3沉默表达VRK1稳定细胞株构建
1.2.3.1慢病毒包装VRK1沉默表达质粒载体(pLKO.1-VRK1)及对照质粒载体(pLKO.1-NC) 培养293T细胞,待细胞密度生长到60%~70%,按照以下实验步骤来进行转染:① 配制A液(1.25 μg 构建好的pLKO.1-VRK1或者pLKO.1-NC质粒+0.75 μg psPAX2+0.5 μg pMD2.G+150 μl Opti-MEM培养基),吹打混匀。② 配制B液(15 μl Lipo 2000+150 μl Opti-MEM培养基),吹打混匀。A+B,吹打混匀,室温孵育20 min,逐滴加入6孔板细胞,轻轻摇动,培养6 h后,更换新鲜DMEM培养基。换液后24 h,收集上清液,以0.45 μm滤器过滤至离心管中。4 ℃,50 000 r/min高速离心2 h。siRNA序列为GCAGTTGGAGAGATAATAA。
1.2.3.2分组及稳定细胞株构建 培养OCI-Ly3细胞,待细胞长至80%~90%消化接种到6孔板中,感染病毒。其中感染pLKO.1-VRK1病毒的记为沉默表达组、感染pLKO.1-NC病毒的记为对照组、未进行任何处理细胞记为空白组。48 h后换带有浓度2 μg/ml的puromycin完全培养基加入筛选细胞,每2 d换液,培养2周,获得稳转细胞株。
1.2.4软琼脂克隆形成实验检测细胞增殖 取3组对数生长期细胞,消化成为单细胞。分别制备出1.2%和0.7% 2个浓度的低熔点琼脂糖液,高压灭菌后,按1 ∶1比例使1.2%的琼脂糖和2×1640培养基混合,取3 ml混合液注入直径6 cm平皿中,冷却凝固;按1 ∶1比例0.7%的琼脂糖和2×1640培养基相混,再向管中加入1 000个细胞悬液,充分混匀,注入铺有1.2%琼脂糖底层平皿中,逐形成双琼脂层。待上层琼脂凝固后,置入37 ℃、5% CO2温箱中培养14 d。观察细胞克隆数。
1.2.5细胞凋亡检测 3组细胞培养培养48 h后,消化细胞,转移到离心管内,1 000 r/min离心5 min,弃上清液,收集细胞,用PBS轻轻重悬细胞并计数。取5~10万重悬的细胞,1 000 r/min离心5 min,弃上清液,加入195 μl Annexin V-FITC结合液轻轻重悬细胞。加入5 μl Annexin V-FITC,轻轻混匀。加入10 μl碘化丙啶染色液,轻轻混匀。室温避光孵育10~20 min,随后置于冰浴中。立即上机检测。

2 结果
2.1 VRK1在DLBCL组织和细胞中高表达结果显示VRK1在DLBCL组织中基因相对表达值高于RHL组织中表达值(P<0.01),见图1A。进一步在细胞水平检测VRK1蛋白表达,结果表明除了SU-DHL-6外,其余DLBCL细胞系(SU-DHL-4、OCI-Lyl9、OCI-Ly3、VAL、SU-DHL-2)中VRK1蛋白表达均不同程度高于正常B细胞永生化细胞系HMy2.CIR,见图1B。同时,基于可视化软件GEPIA[10]分析TCGA数据库中DLBCL基因芯片表达数据,结果显示VRK1 mRNA表达在DLBCL组织(47例)中高于正常淋巴结组织(337例)(P<0.05),见图1C。

图1 VRK1在DLBCL组织和细胞中高表达A:VRK1在DLBCL组织中高表达;B:VRK1在DLBCL不同细胞蛋白表达,1~7:HMy2.CIR、SU-DHL-4、OCI-Lyl9、OCI-Ly3、VAL、SU-DHL-2、SU-DHL-6细胞;C:TCGA数据库中DLBCL基因表达分析;与RHL组织组比较:**P<0.01;与正常组比较:#P<0.05
2.2 VRK1高表达与DLBCL临床病理特征及预后的关系统计结果显示VRK1表达与DLBCL患者性别、年龄、血清乳酸脱氢酶含量、结外侵犯差异无统计学意义(P>0.05),与Ann Arbor分期、免疫分型差异有统计学意义(P<0.05),见表1。截止末次随访时间,VRK1高表达组患者5年总生存率低于VRK1低表达组,差异有统计学意义(P<0.05),见图2。

图2 2组VRK1患者5年生存曲线的比较
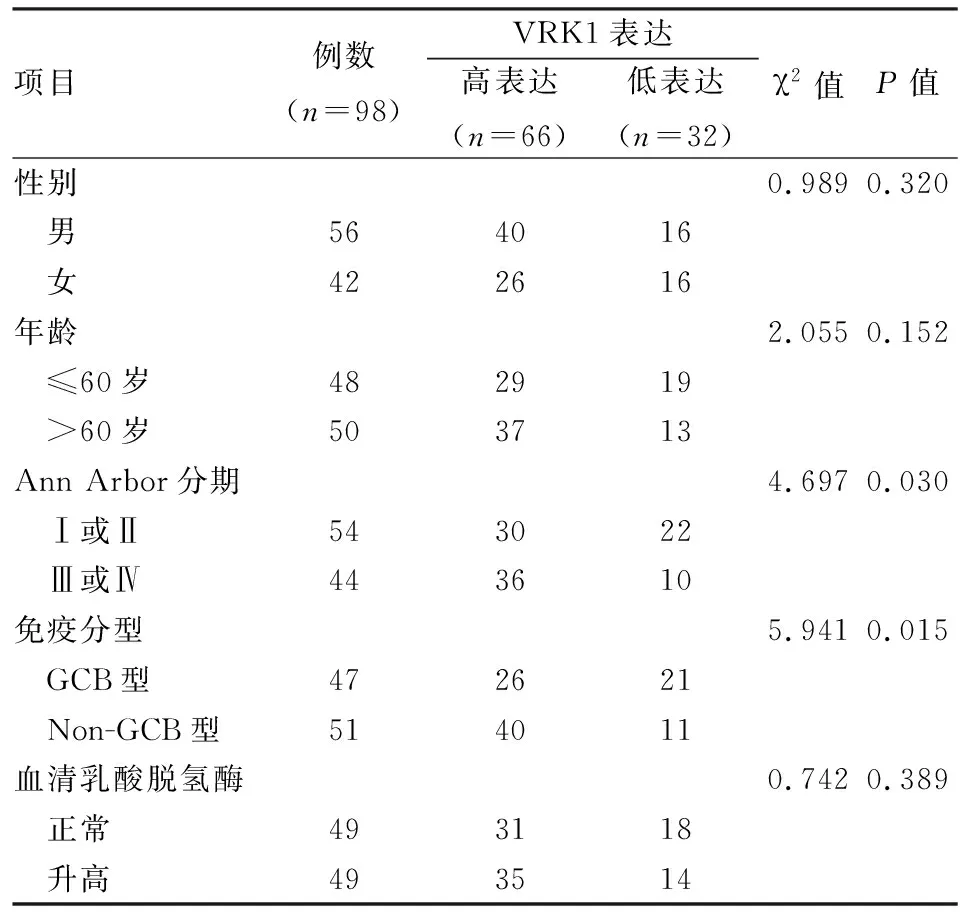
表1 VRK1表达与DLBCL临床病理特征的关系
2.3 VRK1与DNA修复通路相关蛋白共表达关系RT-PCR检测DLBCL组织中VRK1及DNA修复通路相关蛋白XRCC3、CDC20 mRNA表达,结果表明VRK1和XRCC3、CDC20之间均正向共表达(n=98,P<0.05),见图3。

图3 VRK1和XRCC3、CDC20共表达
2.4 沉默表达VRK1对DLBCL细胞增殖的影响软琼脂克隆形成实验结果显示空白组、对照组和沉默表达组细胞克隆数分别为(94.67±9.71)、(99.33±11.93)、(30.67±4.04)个,经单因素方差分析,组间差异有统计学意义(F=52.37,P<0.05),见图4。表明沉默表达VRK1可抑制OCI-Ly3细胞的增殖活性。

图4 沉默表达VRK1抑制DLBCL细胞增殖 结晶紫染色×1A:空白组;B:对照组;C:沉默表达组
2.5 沉默表达VRK1对DLBCL细胞凋亡的影响Annexin V-FITC/PI双标记法检测结果显示空白组、对照组和沉默表达组细胞总凋亡率分别为(8.97±0.62)%、(9.05±0.68)%、(14.23±0.84)%,经单因素方差分析,组间差异有统计学意义(F=52.67,P<0.05),见图5。表明沉默表达VRK1可促进OCI-Ly3细胞的凋亡能力。

图5 沉默表达VRK1促进DLBCL细胞凋亡A:空白组;B:对照组;C:沉默表达组
3 讨论
DLBCL的发生是一个多因素、多阶段的复杂发病过程,涉及了诸多相关基因的异常表达。发现DLBCL相关致病基因,并在研究其作用机制基础上寻找治疗新靶点是肿瘤生物学的重要内容。最近的转录组高通量测序研究[11]表明丝氨酸/苏氨酸蛋白激酶VRK1的失活突变与DLBCL发生有关。VRK1除了作为染色质和细胞水平DNA损伤反应信号的参与者,其作为肿瘤学中新的治疗靶标的潜力也越来越受到研究者的重视。如Ben et al[5]发现VRK1在神经胶质瘤组织和细胞系中高表达,VRK1的表达水平与神经胶质瘤的病理分级以及Ki-67的表达呈正相关,且VRK1表达高的患者预后较差。Mon et al[6]通过调节转录阻遏物snail、slug和twist1,发现VRK1过表达可以促进乳腺癌细胞培养中的间充质向上皮转化(mesenchymal to epithelial transition,MET),VRK1介导的MET可能促进转移性乳腺癌细胞在远端部位定植,从而为VRK1过表达与乳腺恶性肿瘤的频繁关联以及VRK1过表达与不良临床结果之间的相关性提供了理论基础。Li et al[8]研究表明食道癌组织中VRK1的mRNA和蛋白表达水平高于邻近正常组织,ROC曲线分析显示,VRK1产生0.790的曲线下面积(area under the curve, AUC),可用于检测食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)患者。以上诸多研究表明VRK1在多种肿瘤发生中发挥重要功能。
在DLBCL发生发展中,VRK1最近才被认为是一种促癌因子,目前很少有研究评价VRK1在DLBCL中的表达及作用机制。本研究中,首先检测VRK1在DLBCL中的表达:在组织水平上,免疫组化法检测DLBCL组织和反应性增生性淋巴结炎淋巴结组织中VRK1表达;在细胞水平上,Western blot检测正常B细胞永生化细胞系HMy2.CIR和DLBCL细胞系SU-DHL-4、OCI-Lyl9、OCI-Ly3、VAL、SU-DHL-2、SU-DHL-6中VRK1蛋白表达;同时,充分挖掘现存的肿瘤数据库中DLBCL基因表达数据;结果均表明VRK1在DLBCL中高表达。需要注意的是,在细胞水平检测中,DLBCL细胞系U-DHL-6的VRK1表达低于正常组织,推测原因在于DLBCL是一种在遗传变异、分子分类、临床特性、治疗反应和预后等多方面都存在高度异质性的淋巴瘤。DLBCL主要可以根据B细胞分化所处的阶段将其分为以下3个分子亚群:生发中心来源的弥漫性大B细胞淋巴瘤(germinal center B- cell-like DLBCL,GCB DLBCL),活化B细胞来源的弥漫性大B细胞淋巴瘤(activated B-cl-like DLBCL,ABC DLBCL)和原发于纵膈的大B细胞淋巴瘤(primary mediastinal large B-cell lymphoma, PMBCL)。SU-DHL-6属于GCB DLBCL,和ABC DLBCL相比,这2种亚型的DLBCL分别具有各自独特的生物学特征,具有截然不同的遗传变异背景[12-13],从而使它们分别通过不同的与肿瘤发生相关的信号通路来调节肿瘤细胞的存活。统计分析VRK1表达与DLBCL患者临床病理特征关系,结果表明VRK1表达与DLBCL患者Ann Arbor分期、免疫分型差异相关,且VRK1高表达组患者5年总生存率低于VRK1低表达组。暗示VRK1在DLBCL发生发展中具有重要作用。
VRK1作为丝氨酸-苏氨酸激酶,主要参与DNA修复、细胞分裂、转录激活、组蛋白修饰等。本研究通过RT PCR定量检测DLBCL组织中VRK1及DNA修复通路相关蛋白XRCC3、CDC20 mRNA表达,并比较VRK1和XRCC3、CDC20之间共表达关系。结果表明VRK1和XRCC3、CDC20之间均正向共表达。通过化学疗法或放射线诱导DNA损伤是癌症治疗的主要手段[14],因此,新的DLBCL治疗方法可以针对涉及VRK1调节的蛋白质,而不是直接引起DNA损伤。
已有研究[5-6]证明许多恶性肿瘤中都存在VRK1的异常上调,高水平的VRK1常与肿瘤细胞高增殖活性相关。本研究基于慢病毒包装构建沉默表达VRK1的稳定DLBCL细胞株,检测VRK1对OCI-Ly3增殖和凋亡的影响,结果显示沉默表达VRK1可抑制OCI-Ly3细胞的增殖活性,促进OCI-Ly3细胞的凋亡能力。细胞凋亡是细胞生长分化调节的重要手段,又是机体免受肿瘤危害的重要保护机制,癌变了的细胞发生凋亡的能力通常极低,而增殖能力则相应增强,这直接导致了瘤细胞快速而病态的分裂增殖[15],暗示VRK1可能通过抑制凋亡促进肿瘤生长。
综上,沉默VRK1表现出了较强的抗肿瘤潜能,具有一定的临床意义,为DLBCL的发病机制、预后评估提供了新的理论依据,也为DLBCL的分子靶向治疗提供了新的策略。
