紫云英添加对土壤团聚体组成及有机碳分布的影响①
2020-10-05周方亮黄雅楠耿明建
周方亮,李 峰,黄雅楠,耿明建,黄 丽
(华中农业大学农业部长江中下游耕地保育重点实验室,武汉 430070)
土壤团聚体广泛地影响着土壤的性能,包括增强土壤孔隙度、紧实性,影响植物根系的分布及提高土壤抵抗水土流失的能力[1]。研究显示,有机碳是土壤颗粒聚集效应的重要结合剂[2],它可以通过化学和物理过程结合土壤细颗粒[3];团聚体还为土壤中的有机碳提供结构保护,从而防止生物降解[4-5]。土壤团聚体作为土壤理化性质的中心调节器,在很大程度上影响着有机碳的化学和生物化学固定,团聚体各粒级中的有机质固存动态与团聚体自身的稳定性息息相关[6]。因此,研究土壤团聚体及有机碳的关系对提高土壤结构稳定性和土壤碳储量具有重要意义。
紫云英是我国稻田主要的冬季绿肥[7-8],紫云英种植还田是传统农业用地养地的重要措施[9]。近年来大量的化肥施用和较低的利用率正在造成严重的环境问题[10],紫云英等有机物料的添加,可直接增加土壤中有机碳含量,提高表层土壤有机碳的累积,对土壤质量改善和促进农业可持续发展具有经济和实际意义[11]。紫云英种植还田可提高土壤团聚体平均重量直径(MWD)和几何平均直径,增加0.25 ~ 0.053、0.5 ~ 0.25 mm 团聚体的有机碳含量[12]。紫云英还田可显著增加土壤总有机碳含量,并通过提高土壤微团聚体有机碳含量而增加土壤碳库[13]。也有研究指出,翻压紫云英虽未显著提高大团聚体的含量,却明显提高了团聚体稳定性,改善了土壤结构,且高紫云英用量的处理团聚体MWD 增幅较大[14]。由于土壤团聚体结构的差异,导致外源碳的可进入性不同,进而影响了有机碳组分在团聚体内的周转及稳定。外源新碳前期主要分配在 >2 mm 粒级团聚体中,并促进原土有机碳的分解,后期主要分配在微团聚体中[15]。有研究发现,来源于有机物料的碳首先被存储在大团聚体中,随着时间的增长,以矿物结合态有机碳和细颗粒有机碳形式存在的碳储存量逐渐增加,矿物结合态有机碳和细颗粒有机碳是微团聚体中有机碳稳定储存的主要机制,微团聚体可以为微生物活动提供合适的条件并促进细颗粒有机碳积累[16]。
紫云英种植还田可以增加土壤有机碳含量,提高团聚体的稳定性[17],但紫云英添加后团聚体组成及团聚体内有机碳分布的动态变化尚鲜有报道。因此,本文采用添加紫云英室内培养试验,通过对土壤团聚体组成、稳定性以及团聚体内有机碳分布特征的研究,了解紫云英腐解过程中土壤团聚体的变化和团聚体中有机碳的储存特征,以期为紫云英还田利用和培肥土壤提供理论依据。
1 材料与方法
1.1 供试材料
供试土壤为第四纪沉积物发育的水稻土,采自华中农业大学校内试验基地(30°28′10″ N,114°21′21″ E),该区属于亚热带季风气候,年平均气温16.9℃,年均日照时数为1 810 ~ 2 100 h,年均降雨量为1 269 mm,年均蒸发量为 1 494 mm。供试土壤为壤质黏土(27.70% 砂粒,43.99% 粉粒,28.31% 黏粒),土壤有机碳 5.99 g/kg,碱解氮 57.02 mg/kg,有效磷2.00 mg/kg,速效钾99.07 mg/kg,pH 7.00。
于2018 年4 月采集表层0 ~ 20 cm 土壤样品,5个样点混匀后四分法取样。将其带回实验室后,剔除其中石块、植物残体等杂质,置于阴凉通风处自然风干,将大土块沿土壤自然结构轻轻地掰碎,过2 mm筛备用。
1.2 试验设计
培养试验共设3 个处理,分别为不添加紫云英(CK),添加2% 土壤质量的紫云英(G1),添加4% 土壤质量的紫云英(G2)。每个处理设置3 个取样时期,每个时期各3 个重复,共36 盆。土样风干后过2 mm筛,每个塑料杯中装入 200 g 土样(容重为1.30 g/cm3),将新鲜的紫云英植株剪成1 ~ 2 cm 大小,按上述比例与风干土样充分混匀。在25℃下进行干湿交替培养,加蒸馏水调节土壤含量水量为田间持水量的60%,保持15 d(培养过程中用称重法补充水份),然后自然落干15 d 为一个周期。分别在培养60、120、180 d 采用破坏性取样,用于测定土壤团聚体稳定性和有机碳含量。
1.3 样品测定
将100 g 风干土样通过孔径依次为2、0.25、0.053 mm 的套筛,分别称重计算出各级干筛团聚体占土壤总量的百分率。然后按干筛法测定的各级团聚体比例配制60 g 风干土样,用Elliott[18]的土壤团聚体湿筛法获得不同粒径水稳性团聚体:将样品放置于孔径自上而下为2、0.25、0.053 mm 的套筛上,先用水浸润10 min,接着开启团聚体分析仪竖直上下振荡10 min,收集各级筛子上的团聚体并分别转移至铝盒,依次得到 >2、2 ~ 0.25、0.25 ~ 0.053、<0.053 mm水稳性团聚体,烘干称重。称重后样品磨细过0.15 mm 筛,采用重铬酸钾-浓硫酸外加热法测定其有机碳含量[19]。
另外,分别称取 5.00 g 烘干后的大团聚体(>0.25 mm)和微团聚体(0.25 ~ 0.053 mm)样品进行密度分组[20]:用密度为1.85 g/cm3NaI 溶液分离得到游离态轻组(fLF)和重组(HF)。向重组中加入0.5%(m/V)六偏磷酸钠(HMP)溶液,振荡18 h,依次通过0.25 mm和0.053 mm 筛,分别得到粗颗粒有机碳(cPOC,>0.25 mm)、细颗粒有机碳(fPOC,0.25 ~ 0.053 mm)、矿物结合态有机碳(mSOC;<0.053 mm),各组分在40℃下烘干、称重,计算各有机碳组分在土壤中的相对含量。
水稳性团聚体稳定性指标使用平均重量直径(MWD)表示:

式中:为某级团聚体的平均直径;Wi为该级团聚体的质量分数。
1.4 数据分析
试验数据采用SPSS 19.0 和Excel 2003 进行统计分析,使用Origin 8.0 软件进行绘图,数据差异显著性分析采用Duncan 法(P<0.05)。
2 结果与分析
2.1 土壤水稳性团聚体的分布
在添加紫云英培养期间,不同处理的团聚体分布相似(表1),水稳性团聚体含量(以质量分数表示)由高到低依次为,<0.053、2 ~ 0.25、0.25 ~ 0.053、>2 mm。<0.053 mm 粒级团聚体含量最高,为35.77% ~53.32%,>2 mm 团聚体含量仅有2.49% ~ 5.43%。在培养60 d 时,与CK 处理相比,G1 和G2 处理 >2、0.25 ~ 0.053 mm 团聚体的含量分别提高了53.77% ~78.08%、1.22% ~ 39.45%,其中G1 处理 >2 mm 团聚体含量显著增加,增幅为78.08%;<0.053 mm 团聚体含量降低了3.58% ~ 17.05%。在培养120 d 时,相比于CK 处理,G1 和G2 处理 >2、2 ~ 0.25 mm 团聚体的含量分别提高了51.15% ~ 77.31%、16.14% ~17.79%,其中G2 处理显著增加 >2 mm 团聚体含量;<0.053 mm团聚体含量相比于CK处理降低了12.80% ~31.70%。在培养180 d 时,G1 和G2 处理2 ~ 0.25 mm团聚体的含量分别提高了1.07% 和7.52%,但不同处理各粒级团聚体的含量均无显著变化。与培养60 d相比,培养180 d 时CK 处理 >2、2 ~ 0.25 mm 团聚体含量有所降低,分别降低了16.39%、21.98%,0.25 ~0.053 mm 团聚体含量增加了48.30%。添加紫云英后,在整个培养时期,>2 mm 团聚体在培养60 d 时含量最高,随着培养时间的增加而减少,<0.053 mm 团聚体随着培养时间的增加先减少后增加,在培养180 d时含量最高。
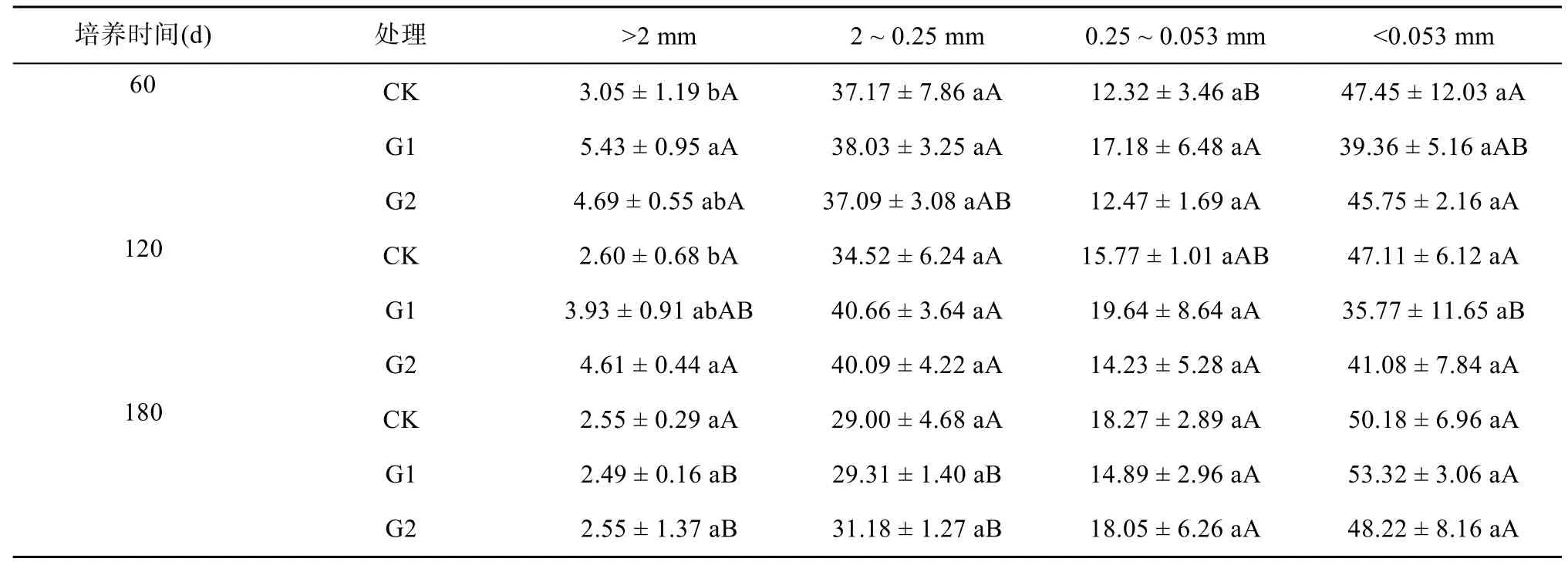
表1 不同培养时期土壤水稳性团聚体的分布(%)Table 1 Distribution of soil water stable aggregates in different culture periods
2.2 土壤团聚体稳定性的变化
由图1 可知,团聚体的MWD 为0.45 ~ 0.65 mm。在培养60 d 时,添加紫云英处理的MWD 有所增高,相比于CK 处理,G1 和G2 处理的MWD 分别增加了16.07% 和8.93%,其中G1 处理团聚体的MWD 最高,为0.65 mm。在培养120 d 时,相比于CK 处理,G1和G2 处理显著增加了团聚体的MWD,增幅分别为21.15% 和23.08%,G2 处理团聚体MWD 最高,为0.64 mm。在培养180 d 时,不同处理团聚体的MWD由大到小依次为G2>CK>G1,G2 处理相比于CK 增加了4.35%,但各处理间均无显著差异。在整个培养时期,CK 和G1 处理的MWD 随着培养时间的增加而降低,相比于培养60 d,培养180 d 时分别下降17.86% 和30.77%;G2 处理的MWD 随着培养时间的增加表现为先增加后降低,在培养120 d 时达到最大,与此相比,培养180 d 时显著下降25%。紫云英添加提高了前期土壤团聚体的稳定性,尤其是在培养120 d 时效果最为显著,但培养180 d 后不同处理无明显差异。
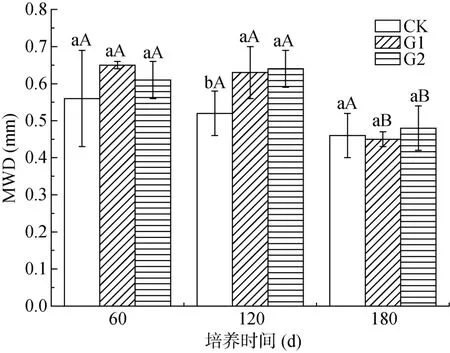
图1 不同培养时期土壤团聚体MWD 的变化Fig. 1 MWD of soil aggregates in different culture periods
2.3 土壤和团聚体中有机碳的分布
培养期间,土壤有机碳含量为6.97 ~ 8.39 g/kg(图2),添加紫云英后土壤有机碳含量有所提升,在不同培养时期均表现为G2>G1>CK,这与前人的研究结果相似[21]。在培养60 d 时,相比于CK 处理,G1 和G2 处理的土壤有机碳含量显著增加,增幅分别为6.27% 和10.72%。在培养120 d 时,G1 和G2处理的有机碳含量相比于CK 处理分别显著增加6.59% 和17.67%,且G2 处理相比于G1 处理土壤有机碳含量显著增加7.98%。在培养180 d 时,与CK处理相比,G2 处理的有机碳含量增加6.17%。在整个培养过程中,CK 处理有机碳含量随着培养时间的增加而降低,添加紫云英各处理随着培养时间的增加有机碳含量先增加后降低,在120 d 时达到最大值,这可能是由于新鲜紫云英含氮量较高,还田后易引起“激发效应”,促进土壤有机碳矿化分解,使土壤有机碳含量有所降低[22-23]。

图2 不同培养时期土壤有机碳的含量Fig. 2 Soil organic carbon contents in different culture periods
不同处理土壤团聚体中有机碳含量均随着粒级的减小而降低,由高到低依次为 >2、2 ~ 0.25、0.25 ~0.053、<0.053 mm。>2、2 ~ 0.25 mm 团聚体的有机碳含量高于原土,0.25 ~ 0.053、<0.053 mm 团聚体的有机碳含量则低于原土。大团聚体的稳定性在很大程度上取决于植物根系和菌丝,紫云英的添加首先作用在大团聚体上,而小粒径团聚体中的有机碳则维持在较稳定的水平[24]。培养60 d 时,不同处理各粒级团聚体的有机碳含量无显著差异。培养120 d 时,除G2 处理0.25 ~ 0.053 mm 团聚体外,添加紫云英后土壤各粒级团聚体的有机碳含量均有所提升,相比CK 处理,G2处理显著增加了 >2 mm 团聚体的有机碳含量,增幅为48.82%。培养180 d 时,G1 和G2 处理均提高了各粒级团聚体的有机碳含量,显著增加了>2 mm 团聚体的有机碳含量,增幅分别为17.17% 和43.67%,G1处理0.25 ~ 0.053 mm 团聚体的有机碳含量显著增加了6.93%。在整个培养过程中,G1 和G2 处理 >2、2 ~0.25 mm 团聚体的有机碳含量随着培养时间的增加而增加,<0.053 mm 团聚体的有机碳含量则与原土有相似的变化规律,随着培养时间的增加先增加后降低。

表2 不同培养时期土壤团聚体中有机碳的含量(g/kg)Table 2 Organic carbon contents in soil aggregates in different culture periods
2.4 团聚体内有机碳组分的分布
在团聚体内,各有机碳组分的相对含量以矿物结合态有机碳为主,粗颗粒有机碳次之,细颗粒有机碳和轻组有机碳含量最低(表3)。在培养的120 d 内,与CK 处理相比,G1 和G2 处理均增加了大团聚体(>0.25 mm)内各有机碳组分的相对含量。培养180 d时,G2 处理增加了微团聚体(0.25 ~ 0.053 mm)内细颗粒有机碳和矿物结合态有机碳的相对含量。与培养60 d 时相比,在培养180 d 时CK 处理大团聚体内粗颗粒和细颗粒有机碳的相对含量有所下降,矿物结合态有机碳和微团聚体内细颗粒有机碳的相对含量有所上升;G1 和G2 处理则除轻组有机碳含量外,大团聚体内各有机碳组分的相对含量均有降低,微团聚体内各有机碳组分的相对含量有不同程度的增加。

表3 不同培养时期土壤团聚体中有机碳组分的相对含量(%)Table 3 Relative contents of organic carbon fractions in soil aggregates in different culture periods
不同培养时期,团聚体内各组分有机碳含量有着相似的分布规律(图3)。在大团聚体中,轻组和细颗粒有机碳的含量较高,粗颗粒有机碳和矿物结合态有机碳的含量较低;在微团聚体中,除CK 处理培养180 d 时的样品外,其余样品的各组分有机碳含量由高到低依次为轻组>细颗粒有机碳>矿物结合态有机碳。培养60 d 时,相比于CK 处理,G2 处理显著提升了大团聚体内矿物结合态有机碳的含量,增幅为10.70%,微团聚体内细颗粒有机碳、矿物结合态有机碳含量均有下降,降幅分别为 7.37%、60.51%。在培养120 d 时,与CK 处理相比,G1 和G2 处理显著降低了大团聚体内细颗粒有机碳的含量,分别降低了4.12% 和41.01%。培养180 d 时,添加紫云英降低了大团聚体内粗颗粒有机碳、细颗粒有机碳的含量以及微团聚体内矿物结合态有机碳的含量;与CK 处理相比,G1 和G2 处理大团聚体内矿物结合态有机碳和微团聚体内细颗粒有机碳分别增加37.31% ~ 49.75%、5.85% ~ 8.88%。这与前人的研究结果一致[25-26],来源于有机物料的碳首先以颗粒有机碳形式储存在大团聚体中,随着培养时间的增加外源新碳逐步趋向储存于粒径较小的微团聚体,导致培养180 d 时微团聚体内细颗粒有机碳含量的增加。
3 讨论
研究结果显示,在培养120 d 内,添加紫云英处理 >2 mm 团聚体的含量相比CK 均有所增加,且培养120 d 时团聚体的稳定性显著提升。培养180 d 时,不同处理各粒级团聚体含量无显著变化。Oades 和Waters[27]试验研究表明,不同粒级团聚体的稳定性受各个粒级团聚体中有机质含量的影响,有机胶结物质在水稳性团聚体形成过程中起着重要的作用。紫云英添加后直接增加了土壤有机碳的含量,提高土壤中微生物的活性[28],而干湿交替的过程会导致土壤中氧化还原电位以及不同类型微生物群落的交替,为有机物质的腐殖化提供条件[29-30],促进有机胶结物质的形成。随着培养时间的增加,土壤颗粒在有机胶结物质的作用下不断粘结形成大团聚体,并在120 d 时团聚体稳定性达到最大。研究指出,紫云英还田在前20 d腐解最快,100 d 时紫云英累积腐解率达74.5%,有机碳累积腐解率为70.1%[31]。本试验培养120 d 后紫云英基本腐解完全,受激发效应的影响土壤有机碳的含量不断降低,这可能引起180 d 时团聚体稳定性下降。

图3 不同培养时期土壤团聚体中各组分有机碳含量Fig. 3 Contents of organic carbon fractions in soil aggregates in different culture periods
相比于CK 处理,紫云英添加180 d 后显著增加了微团聚体内细颗粒有机碳的含量,这与前人的研究结果相似[32]。Li 等[16]通过两年的原位培养发现,植物残体的碳主要贮存在细颗粒有机碳中,轻组和粗颗粒有机碳则会随着培养时间的增加而减少。研究显示,植物残体中含有较大比例的粗颗粒有机质,这些会作为团聚体的“核”在微生物分泌物等胶结物的作用下与土壤颗粒粘结形成大团聚体,随着时间的增加粗颗粒有机碳不断地破碎分解形成细颗粒有机碳[33]。因此,添加紫云英各处理培养后团聚体内粗颗粒有机碳含量有所增加,但随着紫云英腐解速度变缓,培养180 d 时粗颗粒有机碳不断破碎分解,使微团聚体内细颗粒有机碳含量不断增加。相比培养120 d 时,培养180 d 时G1 和G2 处理土壤的大团聚体含量分别下降了28.68% 和24.54%,大团聚体的破碎也导致了大团聚体内细颗粒有机碳分离进入微团聚体,导致微团聚体内细颗粒有机碳含量的增加。
4 结论
培养120 d 内,添加紫云英处理均提高了 >2 mm团聚体的含量与团聚体的MWD。在整个培养时期,>2 mm 团聚体在60 d 时含量最高,随着培养时间的增加而减少,<0.053 mm 团聚体随着培养时间的增加先减少后增加,在180 d 时含量最高。紫云英的添加提高了土壤有机碳的含量,4% 土壤质量的紫云英添加量效果更好,团聚体中有机碳主要储存在 >2、2 ~0.25 mm 团聚体中。紫云英添加180 d 时,显著降低大团聚体内粗颗粒有机碳和细颗粒有机碳的含量,显著增加微团聚体内细颗粒有机碳的含量,促进微团聚体内有机碳的累积,添加4% 土壤质量的紫云英处理变化幅度最大。
