血管内皮祖细胞外泌体调控骨髓间充质干细胞基因表达谱芯片
2020-09-30魏韩笑张爱君金培生
魏韩笑,张爱君,李 强,金培生
(徐州医科大学附属医院整形外科,江苏徐州 221000)
糖尿病创面(简称糖创)迁延不愈是糖尿病最常见的慢性并发症之一,致死致残率高。糖创治疗困难且极易复发,是临床上治疗的重点、难点。传统治疗方法是皮片或皮瓣移植,但存在局部血液供应不良引起皮片或皮瓣坏死。密集的血管网不仅可以将有害代谢产物导出微环境、排出机体,更重要的是把细胞因子及基础营养物质携带到组织缺损区域[1]。血管内皮祖细胞(endothelial progenitor cells,EPCs)是内皮细胞的前体,是成体干细胞中的一种。EPCs 常与MSCs 联合用于微血管网络的构建。EPCs 不仅有促进组织快速血管化的能力,并且对与其共培养的其他种子细胞也具一定的有营养支持作用[2],这为临床上治疗组织器官缺血性疾病带来希望。
研究表明,EPCs 和其他类型干细胞性质类似,存在进入机体后无法充分定向分化的技术瓶颈[3]。因此,EPCs 来源的外泌体为组织修复和再生开辟了崭新道路。外泌体是细胞分泌的直径在40~150 nm 的微囊泡,常以胞吞的形式进入受体细胞,通过“重编程”相关基因来发挥作用[4]。因此本研究拟通过基因芯片方法筛选可能在EPC-exos 调控MSCs 生物学功能中发挥重要作用的相关基因,探索EPC-exos 调控MSCs 发挥干细胞优越性的具体机制,为后续外泌体靶向修复糖尿病创面打下理论依据。
1 材料与方法
1.1 芯片样本(细胞来源)
骨髓间充质干细胞(bone marrow stromal cells,MSCs)和血管内皮祖细胞(endothelial progenitor cells derived from peripheral blood,EPCs)均取自同新西兰大耳白兔,10 周龄,体重约(1 000±50)g,实验动物均由徐州医科大学实验动物中心提供,质量合格。
1.2 主要试剂和耗材
TRIzol Reagent P/N 15596-018 Invitrogen Life Technologies,Poly-A RNA Control Kit P/N 900433 Affymetrix。
Hybridization Control Kit P/N 900454 Affymetrix。
1.3 细胞复苏
细胞复苏应用文献报道方法进行分离鉴定MSCs 和EPCs[5-6],复苏细胞后更换干细胞培养液,调整细胞数量约为为105/mL,于37℃、5%CO2饱和湿度培养箱内培养。
1.4 EPC-Exos 的获取和鉴定
EPCs 在无血清的培养液中培养48 h,用超速离心法提取培养液中的外泌体,BCA 法检测其蛋白浓度。Western Blotting 检测表达内皮祖细胞外泌体表达CD9、CD63 和Alix 情况[7]。
1.5 构建联合培养装置
弃培养瓶中培养液,收集细胞。用血球计数板计数细胞,取104MSCs 和EPC-Exos 悬液,建立共培养体系,同时设立单独MSCs 培养组,以此方法制备送检样本。每孔分别滴入2 mL 含有10%的胎牛血清的DMEM培养液,次日换液,连续培养14 d 后送检。
1.6 总RNA 质检和杂交芯片
Trizol 提取total RNA,使用分光光度计和电泳技术定量检测。取芯片,滴入对应杂交液,45℃,60 r/min 旋转杂交约16 h。
1.7 数据提取及分析
通 过AGCC 软 件(Affymetrix GeneChip,Command Console Software)记下探针(Probe)的荧光信号大小。校正背景,将探针信号综合整理成探针组(Probeset),遗传物质片段利用归一化将非生物学因素清除掉。删去数据集中没有注释的探针及同时对应多个基因的探针,关键基因表达分析采用软件SPSS 23.0 对最终筛选出的关键基因进行两独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 细胞培养
倒置相差显微镜下见与外泌体共培养的MSCs于72 h 后贴壁状态(图1A),相比较MSCs 单独培养组,细胞大量增殖(图1B),出现较多突触连接,多数细胞巢式生长,镜下可见大量复层细胞。
2.2 EPC-exos 鉴定
从EPCs 中分离出外泌体,并进行透射电镜、Western Blot 外泌体标记蛋白检测。外泌体呈典型圆形和椭圆形,WB 检测Alix、CD9、CD63 呈高表达(图2)。
2.3 待测样本的Scatter Plot
样品经质量检测后显示参数符合质控标准。为研究EPC-exos 对MSCs 增殖、分化等功能的影响,本研究对与EPCs-exos 联合培养的MSCs 和单独培养的MSCs 间基因表达有差异者进行检测。结果显示EPC-exos 对MSCs 的基因表达影响较大(图3)。

图1 显微镜下观察两组细胞生长情况Fig.1 The cell growth status under microscope
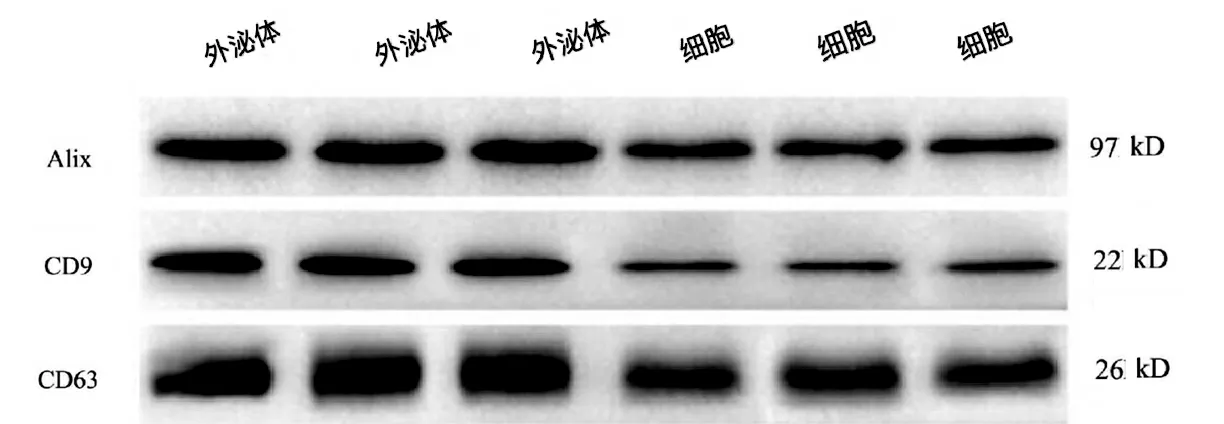
图2 EPC-exos 经WB 检测Alix、CD9、CD63 呈高表达Fig.2 High expression of Alix、CD9 and CD63 of EPC-exos by Westernblot
图3 EPC-exos 影响MSCs 基因差异表达情况Fig.3 The differentially expressedgenes of MSCsinfluenced by EPC-exos
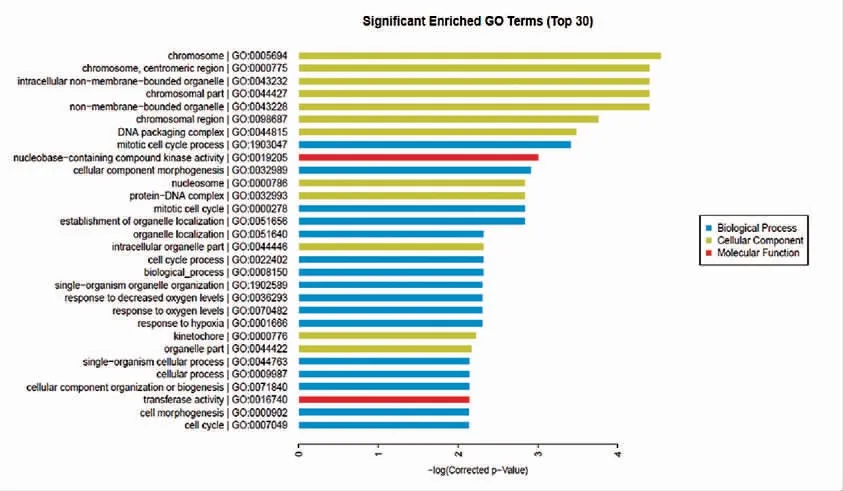
图4 EPC-exos 影响MSCs 差异表达基因GO 分析Fig.4 GO analysis of differentially expressed genes of MSCs cultured with EPC-exos
2.4 差异表达基因
进行GO 功能富集和KEGG 通路富集,分析使用DAVID,筛查差异基因表达,总数据显示差异共1 772 个基因,上调者664 个,下调者1 108个,有统计学意义(P<0.05)。
2.5 MSCs 基因差异表达的Gene ontology(GO)分析
GO 富集分析分为三个方面,分别是:分子功能、生物学过程、细胞组分。利用对基因芯片结论中差异表达基因的Ontology 研究,笔者发现染色体、着丝粒等结构差异基因表达活跃,细胞器定位发生影响。这些都与MSCs 增殖、细胞周期等密切相关;通过观察EPC-exos 调控MSCs 显著富集的通路,笔者发现细胞周期、P53 通路及酮体合成和降解影响最大(图4~图5)。

图5 EPC-exos 调控MSCs 显著富集通路的影响Fig.5 Significant Enriched pathway of MSCs cultured with EPC-exos
2.6 EPC-exos 调控MSCs 差异表达基因的Pathway 分析
为了进一步明确EPC-exos 调控MSCs 增殖和分化的机制,通过KOBAS 数据库对基因芯片的结果进行分析。通过分析认为EPC-exos 调控MSCs增殖分化主要通过细胞周期和MARK 通路进而激活MSCs 增殖分化相关信号传导的过程。图6 分别展示的是EPC-exos 对MSCs 影响的信号通路中的一些关键基因(红色背景)。

图6 EPC-exos 调控MSCs 差异表达基因CELL CYCLE 分析Fig.6 EPC-exos regulates CELL CYCLE analysis of MSCs differentially expressed genes
3 讨论
近年来,基因测序技术和基因芯片等高通量检测技术的迅速更新迭代使生物学功能进入更加微观和精准的研究中。从这些数据中可以挖掘出数以万计甚至百万的与生物体生理、病理过程相关的基因集。大数据时代中科技融合产生科技创新,在医学领域中健康和疾病的表征变得简单和准确,技术的进步和诊断仪器的精准化使当代医学得到迅猛发展[8]。
再生医学是当代生命医学、材料学、计算机学、工程学等有机结合形成的新兴学科。各个学科相互引证结合以解决人类重大疾病问题。组织器官再造是再生医学的重要范畴之一。近年来再生医学的研究逐渐深入,包括细胞治疗、微环境治疗、基因靶向治疗和组织工程等,学科和范畴间交叉并且互相渗透。
细胞是再生医学中真正的工程师。随着再生医学中精准医疗时代的开启,生物样本采集和测序逐渐受到国内外学者的重视。生物样本库为基因、细胞靶向治疗或药物开发提供了丰富的生物样本和数据,推动着肿瘤、心血管疾病、免疫系统疾病等重大疾病的研究和治疗进展[9]。在机体众多细胞中,干细胞是最具潜力的细胞之一。胚胎干细胞或成体干细胞均可自我更新和多项分化,机体在正常生理状态通过干细胞增殖分化来代谢更新衰老和死亡细胞,在病理状态下可通过干细胞归巢招募来实现机体修复[10]。除此之外,各类干细胞可分泌不同细胞因子、生长因子等参与生物体的生理病理过程。
目前对血管内皮祖细胞(endothelial progenitor cells,EPCs)特点和机制有了越来越详尽的认识,但是在应用方面,因为生物体内环境的复杂性和多样性,EPCs 进入活体后的应用面临各种瓶颈。比如因子及信号传导通路的网络性、细胞策略如何迅速建立组织血管化、进入机体后无法充分定向分化等[11]。
外泌体的靶向治疗作用可避免细胞治疗时移植异体活细胞而带的免疫排斥反应,降低干细胞注入后对全身造成的影响,加快实现临床无细胞修复,对进一步临床研究和应用推广有重要的转化医学意义。外泌体携带的内含物(LncRNA、miRNA,mRNA,DNA 和蛋白质等)能够影响受体细胞的生理状态[12]。EPC-exos 是来源于EPCs 的外泌体,研究报道EPC-exos 在促进创面愈合方面可能作用机制如下:(1)在创面的局部微环境下,外泌体参与诱导分化为创面修复所必需的成纤维细胞、角质形成细胞和血管内皮细胞等;(2)外泌体可能具有抗炎、免疫调节和免疫抑制作用,可通过调控创伤后成纤维细胞向肌纤维细胞分化的调控作用;(3)外泌体促进创伤局部或循环中的细胞迁移、増殖和新血管形成[13]。
大量临床前研究证实骨髓间充质干细胞(bone marrow stromal cells,MSCs)在治疗糖尿病创面上具备良好的前景。部分研究已经进入临床观察。Kyung 等[14]将糖尿病创面患者分为治疗组和对照组,证实异体脂肪来源的MSCs 应用于糖尿病创面,12 周后实验组创面闭合率远高于对照组。现阶段干细胞的主要移植方式有血管内注射和局部注射,但存在剂量层次不好控制且细胞存活时间段等问题,因此如何能加速创面组织血管化进程是目前干细胞应用于临床的关键问题。
本研究通过构建EPC-exos 与MSCs 共培养获取EPC-exos 与MSCs 共培养后的MSCs 差异表达显著的基因,通过生物信息分析数据,寻找这些基因所影响细胞代谢特点和信号通路以及这些基因可能涉及的疾病,在分子水平阐述EPC-exos 对MSCs增殖、分化和趋化运动等作用机制。从基因芯片的分析结果来看,MSCs 与EPC-exos 共培养后,MSCs 产生大量表达差异基因共1 772 个,上调者664 个,下调者1 108 个。差异基因集中于细胞周期相关构如染色体、着丝粒等。从KOBAS 数据Pathway 分析结果中可以看到,众多的差异基因在细胞周期和MARK 等通路中起着作用,我们猜测EPC-exos 调控MSCs 增殖分化是一个主要通过调控细胞周期和MARK 通路进而激活MSCs 增殖分化相关信号传导的过程。
体外细胞和组织模型是病理生理学研究、疾病建模、药物开发和个性化治疗策略开发工作流程中的重要一步。出于这些目的,科学和制药研究都采用了体外干细胞模型,因其可以很好反映待测数据,并且相对于动物实验,实验人员可以更精准的实施变量调控。目前干细胞在体外培养方式,如支架细胞模型、类器官或芯片器官,可以克服二维培养系统的局限性,并更好地模拟组织结构和功能。目前基因组编辑和基因治疗技术的出现对干细胞疾病模型的有效建立产生显著推动作用。本研究讨论EPC-exos 调控MSCs 基因表达的差异影响,并在基因芯片的高通量背景下挖掘检测结果并对产生的差异基因进行相关预测。
细胞、基因产业已成为当下全球生物医药行业、生命科技前沿探索最重要的领域之一[15]。但是目前的研究还存在许多瓶颈,例如如何安全合理地将实验室成果应用于临床,如何建立行之有效的评价体系;如何最大可能减少干细胞对机体致瘤性等等,这些问题的解决都还有很长的路要走。
