褐藻糖胶对小鼠颈动脉粥样硬化易损斑块作用及机制
2020-09-29程雨菲朱晓岩马爱军潘旭东
程雨菲 朱晓岩 马爱军 潘旭东

[摘要] 目的 探讨褐藻糖胶对高脂喂养的ApoE-/-小鼠颈动脉粥样硬化易损斑块模型的作用及Nod样受体蛋白3(NLRP3)炎症通路蛋白表达的影响。方法 雄性ApoE-/-小鼠36只,随机分为对照组(普通饮食)、模型组(颈动脉套管+高脂饮食+生理盐水)和褐藻糖胶组(颈动脉套管+高脂饮食+褐藻糖胶),每组12只。8周后检测各组小鼠血脂水平,采用苏木精-伊红(HE)染色方法观察小鼠右侧颈总动脉病理改变,ELISA法测定炎性因子白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子α(TNF-α)表达水平,Western Blot方法检测颈动脉粥样硬化斑块中NLRP3、半胱氨酸天冬氨酸酶-1(Caspase-1)、IL-1β蛋白表达水平。结果 与模型组比较,褐藻糖胶组小鼠血脂水平明显降低,颈动脉粥样硬化易损斑块明显减少,IL-1β、IL-6、TNF-α表达降低,差异均有显著性(F=8.31~190.73,P<0.05)。模型组颈动脉粥样硬化斑块中NLRP3、Caspase-1、IL-1β蛋白表达较对照组显著升高,而褐藻糖胶组各蛋白表达较模型组下降(F=50.22~120.59,P<0.05)。结论 褐藻糖胶能够通过下调NLRP3炎性小体通路抑制炎症而发挥抗颈动脉粥样硬化作用。
[关键词] 褐藻糖胶;斑块,动脉粥样硬化;NLR家族,热蛋白结构域包含蛋白3
[中图分类号] R543.5 [文献标志码] A [文章编号] 2096-5532(2020)05-0536-04
doi:10.11712/jms.2096-5532.2020.56.131 [开放科学(资源服务)标识码(OSID)]
[ABSTRACT] Objective To investigate the effect of fucoidan on carotid atherosclerotic vulnerable plaques and expression of Nod-like receptor family, pyrin domain-containing protein 3 (NLRP3)-related inflammatory pathway proteins in ApoE-/- mice fed with high-fat diet. Methods A total of 36 male ApoE-/- mice were randomly divided into control group (normal diet), model group (carotid collar+high-fat diet+normal saline), and fucoidan group (carotid collar+high-fat diet+fucoidan), with 12 mice in each group. After 8 weeks, blood lipid levels were measured; hematoxylin-eosin staining was used to observe the pathological changes of the right common carotid artery; ELISA was used to measure the levels of the inflammatory factors interleukin-1β (IL-1β), interleukin-6 (IL-6), and tumor necrosis factor-α (TNF-α); Western Blot was used to measure the protein expression of NLRP3, Caspase-1, and IL-1β in atherosclerotic plaques. Results Compared with the model group, the fucoidan group had significant reductions in blood lipid levels, carotid atherosclerotic vulnerable plaques, and expression of IL-1β, IL-6, and TNF-α (F=8.31-190.73,P<0.05). Compared with the control group, the model group had significant increases in the protein expression of NLRP3, Caspase-1, and IL-1β in carotid atherosclerotic plaques, and compared with the model group, the fucoidan group had significant reductions in the expression of these proteins (F=50.22-120.59,P<0.05). Conclusion Fucoidan can effectively atte-nuate carotid atherosclerosis by downregulating the NLRP3 inflammasome pathway.
[KEY WORDS] fucoidan; plaque, atherosclerotic; NLR family, pyrin domain-containing 3 protein
缺血性腦卒中是威胁人类生命的主要疾病之一[1],其主要危险因素是颈动脉粥样硬化[2]。有研究表明,颈动脉粥样硬化是一种缓慢发展的免疫炎症反应过程[3],从粥样硬化斑块形成、发展至斑块破裂,多种炎症细胞和炎症因子参与其中[4]。因此,探讨抑制炎症反应的干预措施以控制动脉粥样硬化发生发展,对治疗缺血性脑卒中具有重要意义。褐藻糖胶是海洋类褐藻植物中一种特有的多糖,有研究表明褐藻糖胶能够调节脂多糖(LPS)诱导的巨噬细胞炎症因子释放,抑制核转录因子κB(NF-κB)活化而反应性抑制促炎基因表达[5],但其对颈动脉易损斑块的作用及具体机制尚未有研究。Nod样受体蛋白3(NLRP3)在动脉粥样硬化发生发展过程中具有重要作用[6-8],NLRP3基因敲除小鼠动脉粥样硬化斑块及炎症因子白细胞介素-1β(IL-1β)分泌明显降低[9]。本实验通过构建高脂喂养的ApoE-/-小鼠颈动脉粥样硬化易损斑块模型,观察褐藻糖胶对颈动脉斑块NLRP3炎性小体相关蛋白表达影响,探讨褐藻糖胶对颈动脉粥样硬化的作用及其机制。
1 材料和方法
1.1 实验材料
褐藻糖胶(Sigma-Aldrich公司),用0.22 mm孔径过滤器进行过滤,并在-20 ℃条件下保存为褐藻糖胶提取物(10 g/L),直至使用。6周龄大小C57BL/6背景ApoE-/-基因敲除雄性小鼠(北京Vital River公司)36只,体质量为18~22 g,标准条件下饲养于青岛大学医学部实验动物中心,自由进食、饮水,每笼3只,适应性喂养2周后用于实验。NLRP3、半胱氨酸天冬氨酸酶-1(Caspase-1)、IL-1β(CST公司),ELISA检测试剂盒(eBioscience公司),ECL显影液(Millipore公司)。
1.2 动物分组及处理
将36只小鼠随机分成对照组、模型组、褐藻糖胶组(实验组),每组12只。模型组、褐藻糖胶组小鼠于右侧颈总动脉插入颈动脉套管,并给予高脂饲料(每100.00 g饲料含胆固醇0.25 g、脂肪15.00 g)喂养制备小鼠颈动脉粥样硬化斑块模型[10]。对照组不手术,给予普通饲料喂养。模型制备后第4周褐藻糖胶组小鼠给予褐藻糖胶30 mg/(kg·d)腹腔注射,对照组及模型组腹腔注射等量生理盐水,共注射4周。所有动物研究经青岛大学附属医院实验动物管理委员会批准,并遵循美国国立卫生研究院修订的《实验动物管理和使用指南》[11]。
1.3 检测指标及方法
1.3.1 标本采集 小鼠禁食12 h(正常饮水),腹腔注射100 g/L水合氯醛(3 mL/kg)麻醉,内眦动脉取血;处死小鼠后固定于鼠板,沿颈部正中线剪开皮肤,暴露右侧颈总动脉,然后剪下套管两端长度约0.5 cm血管。
1.3.2 血脂测定 取小鼠内眦动脉血约3 mL,3 000 r/min离心取上清,测定总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL)水平。
1.3.3 病理观察 将离体的右侧颈总动脉用40 g/L多聚甲醛固定,乙醇脱水、浸蜡包埋、切片,苏木精-伊红(HE)染色,光镜下观察血管动脉粥样硬化形成情况。1.3.4 血清IL-1β、白细胞介素-6(IL-6)、肿瘤坏死因子α(TNF-α)水平检测 采用ELISA方法分别检测血清中IL-1β、IL-6、TNF-α水平,按试剂盒说明书操作。
1.3.5 頸动脉粥样硬化斑块组织NLRP3、Caspase-1、IL-1β水平测定 应用Western Blot方法。用RIPA裂解液裂解颈动脉组织,BCA法测定蛋白质含量,SDS-PAGE电泳分离蛋白,然后转到PVDF膜上。室温封闭后2 h后与一抗(1∶1 000)4 ℃孵育过夜。用TBST洗涤后,加二抗在室温下孵育1 h,ECL显影。应用图像分析软件对图像进行分析,以目的条带与GAPDH的灰度值比值表示蛋白相对表达量。
1.4 统计学处理
采用SPSS 19.0软件进行统计学分析,计量资料结果以±s表示,多组间比较采用单因素方差分析(one-way ANOVA),组内两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠血清脂质水平比较
模型组血清TC、TG、LDL水平与对照组比较明显升高,而褐藻糖胶组血清TC、TG、LDL水平较模型组明显降低,差异有统计学意义(F=8.31~126.25,P<0.05)。见表1。
2.2 各组小鼠颈动脉粥样硬化易损斑块形成比较
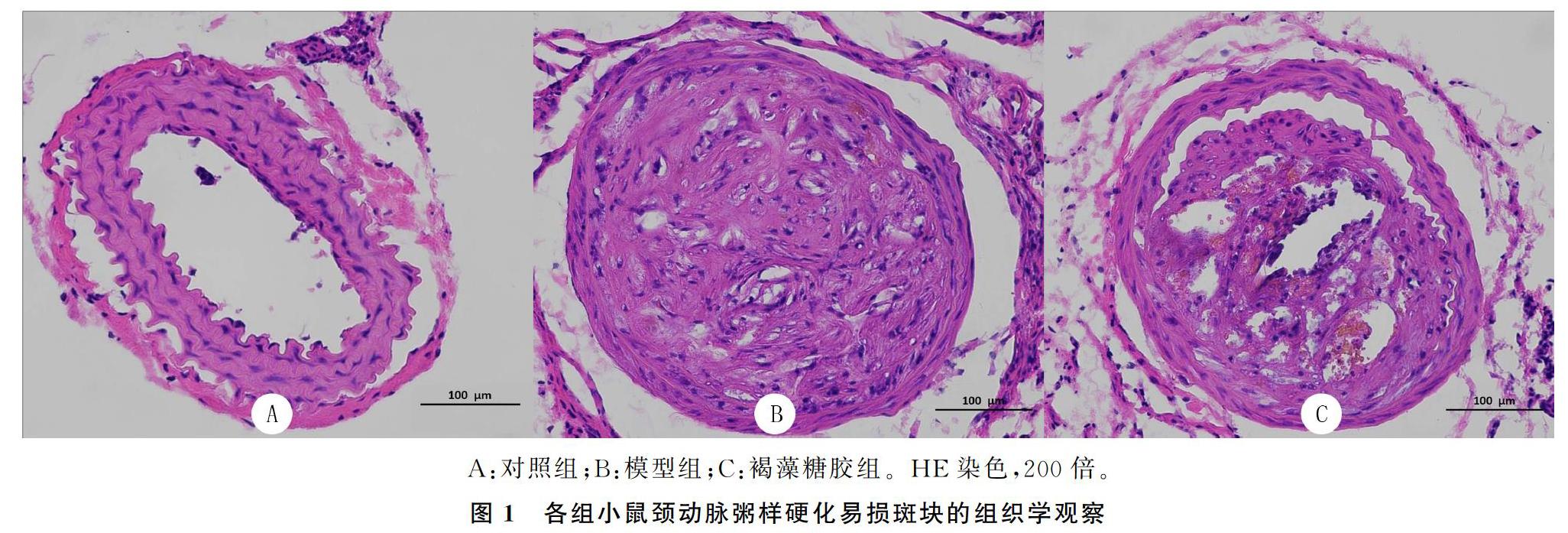
光镜下可见,对照组小鼠血管未见明显粥样斑块,管壁3层结构明显,内膜完整;模型组小鼠颈动脉内见明显粥样硬化斑块形成,斑块内见泡沫细胞浸润,部分破裂,血栓形成;而褐藻糖胶组小鼠颈动脉内粥样斑块明显减轻,泡沫细胞减少。见图1。
2.3 各组小鼠血清炎症因子水平比较
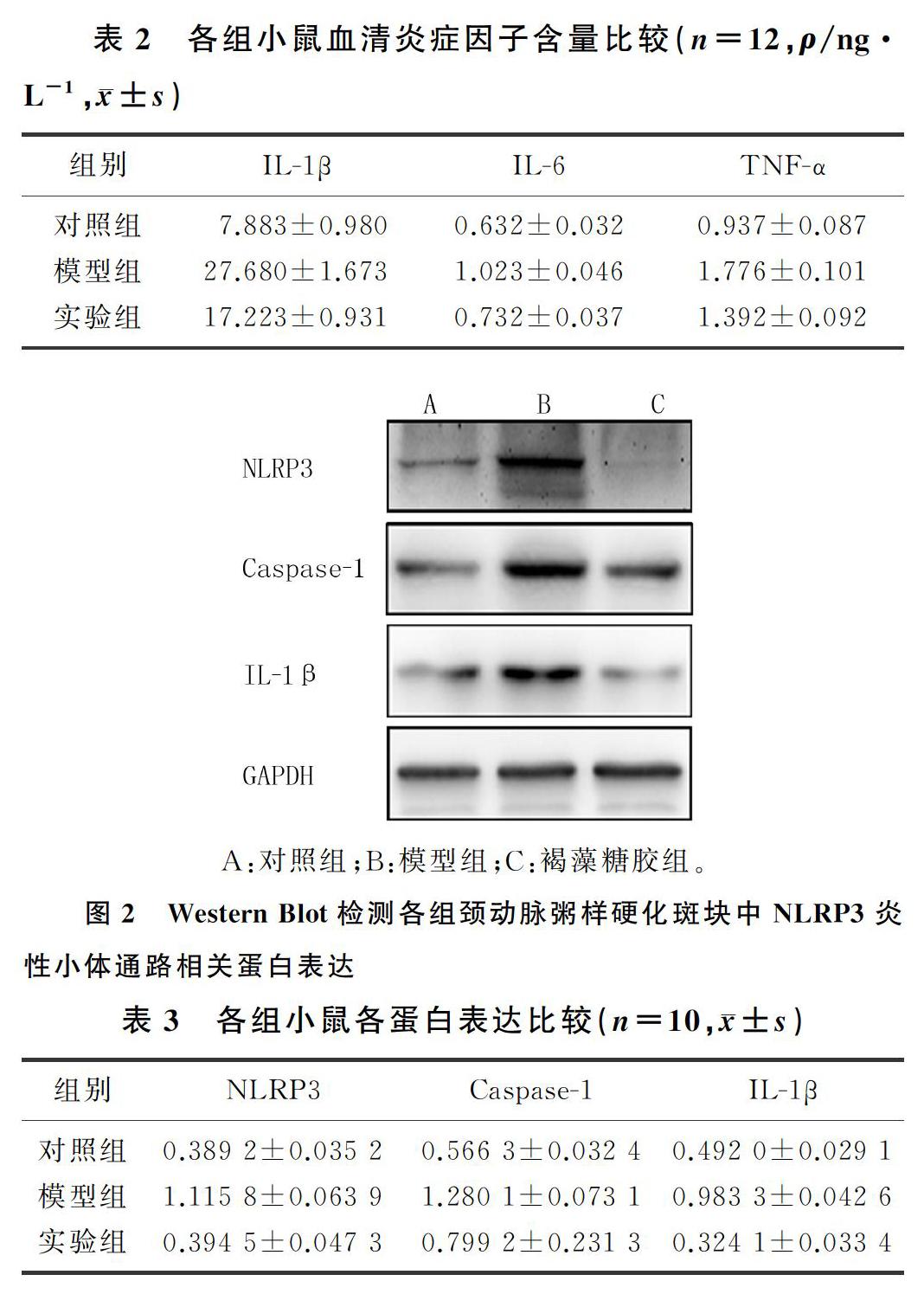
模型组小鼠血清炎症因子IL-1β、IL-6、TNF-α表达较对照组升高,褐藻糖胶组各血清炎症因子水平较模型组下降,差异有统计学意义(F=60.21~190.73,P<0.05)。见表2。
2.4 各组NLRP3炎性小体通路相关蛋白表达比较
与对照组比较,模型组小鼠颈动脉粥样硬化易损斑块中NLRP3、Caspase-1、IL-1β的表达明显增高;与模型组比较,褐藻糖胶组NLRP3、Caspase-1、IL-1β表达降低,差异有显著性(F=50.22~120.59,P<0.05)。见图2、表3。
3 讨 论
炎症在动脉粥样硬化发生和发展以及血栓形成中起着重要的作用[3]。褐藻糖胶是以L-褐藻糖为基础的多糖,具有多种生物学功能,包括抗炎、抗血管生成、抗凝血、抗肿瘤等,是天然海洋药物研究的热点[12-14]。然而,褐藻糖胶在动脉粥样硬化中的作用及其机制尚不清楚。本文利用颈动脉套管合并高脂饲料饲养构建ApoE-/-小鼠颈动脉粥样硬化易损斑块模型,探讨褐藻糖胶对ApoE-/-小鼠颈动脉粥样硬化的作用及其机制。
有研究结果显示,褐藻糖胶可以调节高脂喂养ApoEshl小鼠血脂水平及动脉粥样硬化进展[15]。本文结果与其一致。本文结果显示,褐藻糖胶干预后小鼠血清TC、TG和LDL水平较模型组明显降低;病理观察显示,与对照组相比,模型组颈动脉血管内壁有大量脂质及泡沫细胞堆积,血管腔严重堵塞,而褐藻糖胶组颈动脉血管内壁斑块面积及脂滴明显减少,提示褐藻糖胶能够缓解小鼠颈动脉粥样硬化易损斑块的发生和进展。TNF-α介导全身炎症和免疫反应,在慢性炎症性疾病的发生发展过程中均发挥作用[16-17]。IL-6及IL-1β都是促炎性细胞因子,可刺激炎症的产生,促进免疫性疾病的发生,在动脉粥样硬化过程中起到重要作用[18-20]。有研究显示,褐藻糖胶能够调节LPS诱导的巨噬细胞释放TNF-α、IL-1β、IL-6等炎症因子[21]。本文ELISA检测显示,褐藻糖胶能够明显降低ApoE-/-小鼠炎症因子IL-1β、IL-6、TNF-α分泌。表明褐藻糖胶能够通过抑制炎症反应而发挥抗动脉粥样硬化作用。
研究表明,褐藻糖膠能够影响炎症因子IL-1β表达,而在众多调节炎性因子IL-1β成熟和分泌的通路中,NLRP3炎性小体依赖性的经典通路尤为重要[7,20]。NLRP3炎症小体是NLRs家族中的一员,是由感受蛋白NLRP3、衔接蛋白凋亡相关斑点样蛋白ASC和效应蛋白激酶Caspase-1等组成的复合物[22-23]。已有研究显示,胆固醇结晶、氧化低密度脂蛋白、血流动力异常都会激活单核巨噬细胞NLRP3炎症小体,进而诱导Caspase-1介导的炎性细胞因子IL-1β的成熟分泌,导致心脑血管疾病和事件的发生[24]。因此,抑制NLRP3炎性小体能够控制动脉粥样硬化的发展,稳定动脉粥样硬化斑块,降低因不稳定斑块造成的缺血性脑卒中的风险。本文采用Western Blot方法检测小鼠颈动脉粥样硬化斑块组织NLRP3炎性小体及IL-1β水平,结果显示,与模型组相比较,褐藻糖胶组NLRP3蛋白的表达降低,Caspase-1蛋白及下游炎性细胞因子IL-1β表达减少,一定程度上表明褐藻糖胶能够通过下调NLRP3炎性小体相关蛋白表达而发挥抗炎作用。
综上所述,褐藻糖胶能够通过下调NLRP3炎性小体通路抑制炎症而发挥抗颈动脉粥样硬化作用。本文结果可为抗动脉粥样硬化辅助治疗提供候选药物。
[参考文献]
[1] LOPEZ A. Measuring the global burden of disease[J]. The New England Journal of Medicine, 2013,369(5):448-457.
[2] GBD 2016 Stroke Collaborators. Global, regional, and national burden of neurological disorders,1990—2016: a systematic ana-lysis for the Global Burden of Disease Study 2016[J]. The Lancet Neurology, 2019,18(5):459-480.
[3] HANSSON G K, HERMANSSON A. The immune system in atherosclerosis[J]. Nat Immunol, 2011,12(3):204-212.
[4] TOUSOULIS D, OIKONOMOU E, ECONOMOU E K, et al. Inflammatory cytokines in atherosclerosis:current therapeutic approaches[J]. Eur Heart J, 2016,37(22):1723-1732.
[5] ASANKA SANJEEWA K K, JAYAWARDENA T U, KIM H S, et al. Fucoidan isolated from Padina commersonii inhibit LPS-induced inflammation in macrophages blocking TLR/NF-κB signal pathway[J]. Carbohydr Polym, 2019,224:115195.
[6] DUEWELL P, KONO H, RAYNER K J, et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J]. Nature, 2010,464(7293):1357-1361.
[7] HOSEINI Z, SEPAHVAND F, RASHIDI B, et al. NLRP3 inflammasome: Its regulation and involvement in atherosclerosis[J]. J Cell Physiol, 2018,233(3):2116-2132.
[8] MANGAN M S J, OLHAVA E J, ROUSH W R, et al. Targeting the NLRP3 inflammasome in inflammatory diseases[J]. Nat Rev Drug Discov, 2018,17(9):688-695.
[9] ZHENG F, XING S S, GONG Z S, et al. Silence of NLRP3 suppresses atherosclerosis and stabilizes plaques in apolipoprotein E-deficient mice[J]. Mediat Inflamm, 2014(4):507-518.
[10] SUDIRMAN S, ONG A D, CHANG H W, et al. Effect of fucoidan on anterior cruciate ligament transection and medial meniscectomy induced osteoarthritis in high-fat diet-induced obese rats[J]. Nutrients, 2018,10(6):686.
[11] LIBBY P, LICHTMAN A H, HANSSON G K. Immune effector mechanisms implicated in atherosclerosis:from mice to humans[J]. Immunity, 2013,38(6):1092-1104.
[12] YANG X, WANG S, TRANGLE S S, et al. Investigation of different molecular weight fucoidan fractions derived from new zealand Undaria pinnatifida in combination with GroA therapy in prostate cancer cell lines[J]. Marine Drugs, 2018,16(11):454.
[13] LI X J, YE Q F. Fucoidan reduces inflammatory response in a rat model of hepatic ischemia-reperfusion injury[J]. Can J Physiol Pharmacol, 2015,93(11):999-1005.
[14] PARK J, CHA J D, CHOI K M, et al. Fucoidan inhibits LPS-induced inflammation in vitro and during the acute response in vivo[J]. International Immunopharmacology, 2017,43:91-98.
[15] YOKOTA T, NOMURA K, NAGASHIMA M, et al. Fucoidan alleviates high-fat diet-induced dyslipidemia and atherosclerosis in ApoE(shl) mice deficient in apolipoprotein E expression[J]. J Nutr Biochem, 2016,32(3):46-54.
[16] TAY C, LIU Y H, HOSSEINI H, et al. B-cell-specific depletion of tumour necrosis factor alpha inhibits atherosclerosis development and plaque vulnerability to rupture by reducing cell death and inflammation[J]. Cardiovascular Research, 2016,111(4):385-397.
[17] OBEROI R, VLACIL A K, SCHUETT J, et al. Anti-tumor necrosis factor-α therapy increases plaque burden in a mouse model of experimental atherosclerosis[J]. Atherosclerosis, 2018,27(7):80-89.
[18] LARSSON P T, HALLERSTAM S, ROSFORS S, et al. Circulating markers of inflammation are related to carotid artery atherosclerosis[J]. Int Angiol: a J Int Union Angiol, 2005,24(1):43-51.
[19] SONG L, SCHINDLER C. IL-6 and the acute phase response in murine atherosclerosis[J]. Atherosclerosis, 2004,177(1):43-51.
[20] GREBE A, HOSS F, LATZ E. NLRP3 inflammasome and the IL-1 pathway in atherosclerosis[J]. Circ Res, 2018,122(12):1722-1740.
[21] YU H H, CHENGCHUAN KO E, CHANG C L, et al. Fucoidan inhibits radiation-induced pneumonitis and lung fibrosis by reducing inflammatory cytokine expression in lung tissues[J]. Marine Drugs, 2018,16(10):392.
[22] DAVIS B K, WEN H T, TING J P Y. The inflammasome NLRS in immunity, inflammation, and associated diseases[J]. Annu Rev Immunol, 2011,29:707-735.
[23] SWANSON K V, DENG M, TING J P Y. The NLRP3 inflammasome: molecular activation and regulation to therapeutics[J]. Nat Rev Immunol, 2019,19(8):477-489.
[24] ABDERRAZAK A, COUCHIE D, MAHMOOD D F, et al. Anti-inflammatory and antiatherogenic effects of the NLRP3 inflammasome inhibitor arglabin in ApoE2.Ki mice fed a high-fat diet [J]. Circulation, 2015,131(12):1061-1070.
(本文編辑 黄建乡)
