放疗联合高强度聚焦超声治疗胰腺癌的研究
2020-09-27施琦马士杰周传文谢睿李苗苗沈鹏
施琦,马士杰,周传文,谢睿,李苗苗,沈鹏
(南京医科大学附属淮安第一医院 消化内科,江苏 淮安 223300)
对中晚期胰腺癌的治疗常采用化疗联合方案进行干预,其疾病控制率可有效维持在40%以上[1]。高强度聚焦超声是近年来治疗恶性肿瘤的微创治疗新方法,其在肿瘤局部聚集高强度超声波并产生高温,使靶组织出现凝固性坏死[2]。DJ-1基因(PARK7)在多种恶性肿瘤中均存在高表达现象,可使肿瘤产生耐药性而影响治疗效果,在肿瘤的发生、发展及转移过程中发挥关键作用[3]。microRNA-155(miR-155)在胰腺癌患者体内可见miR-155 高表达,且与患者预后密切相关[4]。因此,本研究选用血清DJ-1 及miR-155反映胰腺癌的治疗效果。目前,临床中螺旋断层调强放疗联合高强度聚焦超声治疗中晚期胰腺癌的应用仍鲜有报道,因而笔者对南京医科大学附属淮安第一医院收治的采用螺旋断层调强放疗联合高强度聚焦超声治疗的中晚期胰腺癌患者临床资料进行分析,探讨其临床疗效,以及对患者血清DJ-1 及miR-155 表达的影响。
1 资料与方法
1.1 一般资料
选取2015年1月—2017年12月本院收治的中晚期胰腺癌患者100例作为研究对象,依照随机信封法分为观察组和对照组,每组50例。观察组:男性33例,女性17例;年龄(54.54±8.36)岁;胰头癌33例,胰体或胰尾癌17例;TNM 分期,Ⅰ期12例、Ⅱ期20例、Ⅲ期9例、Ⅳ期9例。对照组:男性32例,女性18例;年龄(53.96±9.04)岁;胰头癌31例,胰体或胰尾癌19例;TNM 分期,Ⅰ期12例、Ⅱ期21例、Ⅲ期8例、Ⅳ期9例。两组患者一般资料比较,差异无统计学意义(P>0.05)。研究经本院医学伦理委员会批准。
1.2 纳入和排除标准
纳入标准:①临床诊断及检测结果符合胰腺癌诊断表标准[5];②患者不宜手术治疗;③患者对本研究知情并签署知情同意书。排除标准:①合并严重血液系统、自身免疫系统或内分泌系统疾病;②近期接受化疗或放疗;③近期行生物治疗;④主动申请退出本研究。
1.3 方法
对照组使用螺旋断层调强放射治疗。患者在治疗时取仰卧位,双手上举,采用热塑体模固定,抱肘于额头。之后螺旋CT 模拟定位,范围为第4 腰椎椎体下缘至膈顶,层厚5mm,勾画临床靶区、肿瘤区、计划靶区。依照勾画的肿瘤区接受处方剂量50 ~65Gy/25F 照射。观察组在对照组基础上采用高强度聚焦超声治疗。应用FEP-BY01 型肿瘤治疗机,输入功率0.8 ~1.8kW,有效治疗深度1 ~15cm。使用外置超声探头定位,之后采用激光定位引导内置超声探头治疗,单点发射次数8 ~16 次,脉冲时间0.15 ~0.20s,间隔0.3 ~0.4s,以3mm/层从边缘逐层移动。使用聚焦超声脉冲覆盖肿瘤病灶,效应焦点控制为6mm×6mm×10mm。高强度聚焦超声治疗选择在螺旋断层调强放疗次日进行,疗程为每周3 次,共4 周。采用点累积方式形成治疗阵,并通过分次治疗来控制大体积肿瘤的进展。
1.4 观察指标
1.4.1 血清学指标治疗4 周后采集两组患者空腹静脉血,离心收集血清后采用电化学发光法检测血清糖类抗原199(CA199)和糖类抗原242(CA242)水平,采用酶联免疫吸附法检测血清骨桥蛋白(OPN)、中性粒细胞明胶酶相关运载蛋白(NGAL)、视黄醇结合蛋白4(RBP4)水平。采用全自动生化分析仪检测血清谷丙转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、血尿素氮(BUN)及肌酐(Cr)水平。治疗前后采用酶联免疫吸附法检测血清DJ-1 水平,并采集外周静脉血提取外周血单核细胞总RNA,采用聚合酶链反应检测外周血miR-155 水平,试剂盒购自晶美生物科技有限公司,所用引物均由南京金斯瑞生物科技有限公司设计并合成,所有操作均严格按照试剂盒说明书步骤进行。
1.4.2 影像学指标①超声检查:观察两组患者治疗前后的肿瘤大小、回声强度。②CT:观察治疗前后肿瘤大小、CT 值的改变。
1.4.3 临床症状胰腺炎临床症状多样,绝大多数患者困扰于疼痛难忍,本次以疼痛标准化程度、饮食及体重的变化来衡量临床症状的改善程度。治疗完成后,要求两组患者用量化的方式描述自身疼痛的强度,分为轻度、中度、重度、极重度。有2 种具体操作方式可用:①划线法:划一条10cm 长的线,两端轻度和极重度,患者标出的区域代表自身疼痛程度;②数字法:无痛,0 分;轻度,1 ~3 分;中度,4 ~6 分;重度,7 ~9 分;极重度,10 分。
1.4.4 不良反应高强度聚焦超声治疗因高温效应,可导致靶区部分正常组织细胞凝固性坏死,充血、出血,产生炎症反应。此外还可能因代谢紊乱出现糖尿病、脂肪泻等。
1.5 统计学方法
数据分析采用SPSS 19.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以百分率表示,比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 治疗后两组患者血清学指标检测结果
2.1.1 观察组血清CA199、CA242、OPN、NGAL及RBP4 水平降低两组患者血清CA199、CA242、OPN、NGAL 及RBP4 水平比较,差异有统计学意义(P<0.05),观察组均低于对照组。见表1。
2.1.2 观察组ALT、AST、Cr 及BUN 水平降低两组患者血清ALT、AST、Cr 及BUN 水平比较,差异有统计学意义(P<0.05),观察组均低于对照组。见表2。
2.1.3 两组患者血清DJ-1 及miR-155 均降低两组治疗前后血清DJ-1 及miR-155 比较,差异有统计学意义(P<0.05);两组患者较治疗前均降低,且观察组均低于对照组。见表3。
2.2 治疗后两组患者肿瘤影像学指标检测结果
2.2.1 肿瘤大小无改变经超声、CT 测量肿瘤大小,结果显示两组差异均无统计学意义(P>0.05)。
2.2.2 观察组肿瘤组织回声增强肿瘤组织超声检查发现观察组肿瘤组织回声均有不同程度增强,其中 5例肿瘤组织内出现小的无回声区。对照组肿瘤组织回声未出现明显增强。观察组肿瘤组织的回声峰值强度高于对照组(P<0.05)(见表4)。
2.3 治疗后两组临床症状改变
2.3.1 观察组疼痛缓解明显两组患者均伴有不同程度的癌性疼痛,均为后背和/或上腹部疼痛,其中观察组中度21例,重度15例,极重度10例;高强度聚焦超声治疗前疼痛评分平均为7.5,治疗后为0.6,疼痛 完全缓解率为89%(41/46),高强度聚焦超声治疗的平均次数为3.5 次。对照组患者疼痛程度无明显缓解。
表1 两组患者治疗后血清肿瘤标志物检测结果 (n =50,±s)
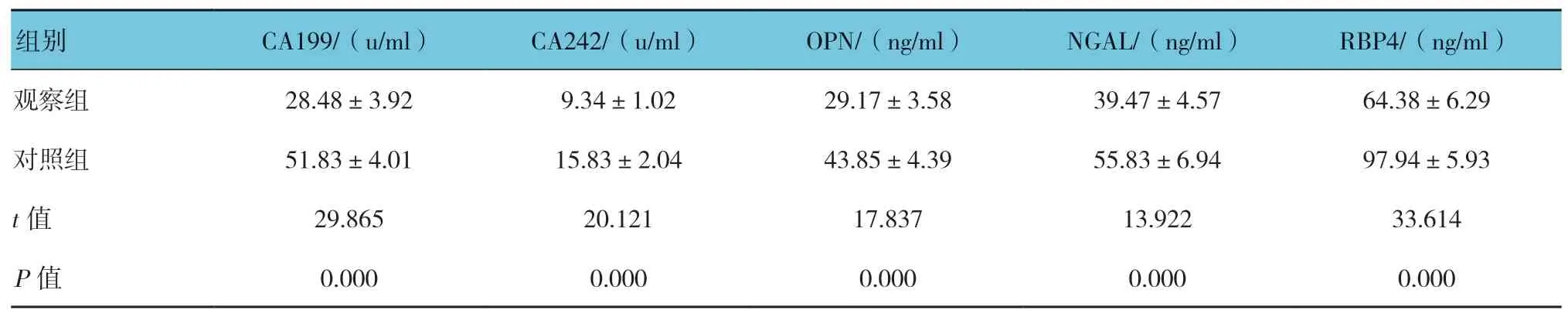
表1 两组患者治疗后血清肿瘤标志物检测结果 (n =50,±s)
组别 CA199/(u/ml) CA242/(u/ml) OPN/(ng/ml) NGAL/(ng/ml) RBP4/(ng/ml)观察组 28.48±3.92 9.34±1.02 29.17±3.58 39.47±4.57 64.38±6.29对照组 51.83±4.01 15.83±2.04 43.85±4.39 55.83±6.94 97.94±5.93 t 值 29.865 20.121 17.837 13.922 33.614 P 值 0.000 0.000 0.000 0.000 0.000
表2 两组患者治疗后肝肾功能检测结果 (n =50,±s)
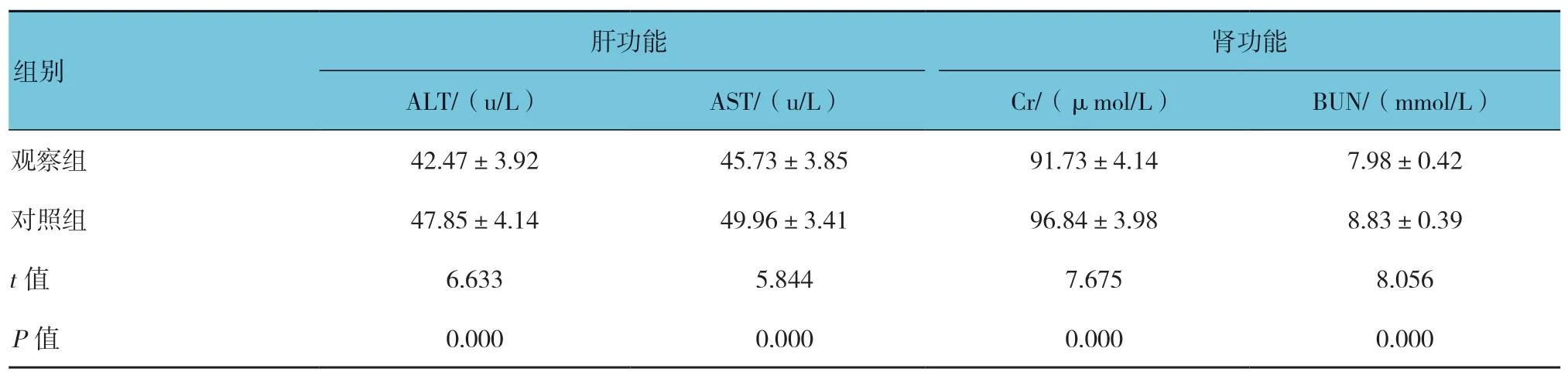
表2 两组患者治疗后肝肾功能检测结果 (n =50,±s)
组别肝功能 肾功能ALT/(u/L) AST/(u/L) Cr/(μmol/L) BUN/(mmol/L)观察组 42.47±3.92 45.73±3.85 91.73±4.14 7.98±0.42对照组 47.85±4.14 49.96±3.41 96.84±3.98 8.83±0.39 t 值 6.633 5.844 7.675 8.056 P 值 0.000 0.000 0.000 0.000
表3 两组患者血清DJ-1 及miR-155 检测结果 (n =50,±s)

表3 两组患者血清DJ-1 及miR-155 检测结果 (n =50,±s)
注:†与治疗前比较,P <0.05。
组别DJ-1(ng/ml) miR-155治疗前 治疗后 治疗前 治疗后观察组 35.83±5.39 15.84±3.84† 0.76±0.12 0.15±0.04†对照组 35.91±5.42 24.19±4.11† 0.78±0.14 0.38±0.07†t 值 0.862 9.072 0.930 20.174 P 值 0.126 0.000 0.102 0.000
表4 两组患者肿瘤大小及肿瘤回声的改变 (n =50,±s)

表4 两组患者肿瘤大小及肿瘤回声的改变 (n =50,±s)
组别肿瘤大小/cm CT 值 回声峰值强度/dB治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 8.53±3.26 6.02±2.18 28.36±9.25 31.13±11.25 22.91±7.15 28.35±5.93对照组 8.62±3.32 6.13±2.36 29.25±9.86 31.65±11.46 23.06±6.27 24.36±6.17 t 值 0.137 0.242 0.465 0.229 0.076 3.297 P 值 0.446 0.405 0.321 0.410 0.470 0.001
2.3.2 观察组患者体重增加明显观察组患者体重均出现不同程度的增加,其中5例患者6 个月复查时体重增加10kg 以上;对照组患者体重无明显改变。观察组平均体重为(68.32±10.26)kg,对照组平均体重 为(61.17±9.35)kg,观察组平均体重重于对照组(t= 3.642,P=0.000)。
2.4 治疗后两组的不良反应
观察组患者出现其他并发症:①胰腺炎、腹膜炎等炎症反应,发生率16%(8/50),多发生于高强度聚焦超声治疗开始连续2 次后,出现上腹痛,伴低热,血淀粉酶轻度升高,经抗炎治疗后均痊愈;②糖尿病发生率10%(5/50),随机血糖值最高为20.1u/L, 采用降糖药治疗后,血糖控制在7 ~8u/L;③脂肪泻,4%(2/50)。
3 讨论
胰腺癌的体征及临床症状均不明显,有研究指出约20%患者在诊断时为早期,而40%患者疾病已进展至局部晚期,其余患者则已出现远处转移[6]。胰腺癌的治疗多采用放疗联合化疗方案[7]。而采用放疗时,常因为胰腺周围存在诸多其他重要器官而限制其应用,常需要采用适形性较好且可降低正常组织受量的方式进行化疗[8]。
螺旋断层调强放疗是螺旋CT 与直线加速器结合应用的产物,利用特殊的多叶准直器对患者纵轴进行扇形束旋转照射,完成1 个层面调强放疗后利用治疗床前进对下一个层面进行放疗。该过程中包括调强放射治疗、三维立体适形放射治疗以及图像引导放射治疗等多种技术[9]。通过三维立体适形技术将靶区与照射区进一步拟合,减少周围组织受累并提高肿瘤靶区放射剂量。图像引导放疗设备是目前较为常见且前沿的电子直线加速器放疗医疗设备,以螺旋断层强调放射治疗为主[10]。采用图像引导技术则可有效减少患者接受放射治疗前的摆位误差,并可检测治疗时患者肿瘤位置及靶区形状变化[11]。此外,采用螺旋断层调强放疗治疗时可通过剂量引导放疗,通过剂量重建计算累计剂量分布,便于医生分析放射治疗效果。
高强度聚焦超声是近年来临床逐渐应用的恶性肿瘤微创治疗方法,该方法可使高强度超声波聚焦病灶组织并使病灶出现瞬时高温,通过机械效应、热效应、免疫效应杀伤肿瘤细胞[12]。此外,高强度聚焦超声治疗时产生的热效应可增强放疗杀伤癌细胞的作用,减轻放射治疗所引起的周围组织损伤[13]。晚期恶性肿瘤患者经高强度聚焦超声治疗后疼痛得到有效缓解,生存时间延长[14]。本研究结果显示,螺旋断层调强放疗联合高强度聚焦超声治疗降低患者血清肿瘤标志物水平,相较于单独应用螺旋断层调强治疗,联合方案治疗后可改善肝肾功能损伤情况。采用螺旋断层调强放疗联合高强度聚焦超声治疗在杀伤胰腺癌细胞的同时,有效地降低血清肿瘤标志物水平,其具有较高的靶向性可实现精准治疗,并减少对周围组织的损伤,提高临床疗效。
DJ-1是体内经典的丝裂原依赖性癌基因,具有高度的保守性,其在多种恶性肿瘤中存在过表达现象,与食管癌、卵巢癌、胰腺癌等恶性肿瘤的转移、侵袭、病程进展及不良预后密切相关。此外,DJ-1 蛋白的调节功能及其他功能尚未完全揭示,人体内DJ-1 常以二聚体形式存在,并参与多种生理病理调控过程,及肿瘤细胞凋亡和转化。DJ-1 高表达与患者疾病复发和预后密切相关[5]。有学者指出,在诸多恶性肿瘤中均存在特定miRNA 表达谱[6]。有学者研究结果显示,在恶性胰腺癌患者体内可见miR-155 高表达,且与患者预后密切相关[15]。本组研究结果显示,治疗后两组患者血清DJ-1 及miR-155 水平较治疗前降低,观察组低于对照组。分析认为,调强放疗联合高强度聚焦超声可有效杀伤肿瘤细胞,提高临床疗效,改善患者预后质量,进而降低患者体内DJ-1 及miR-155 水平。
综上所述,采用调强放疗联合高强度聚焦超声治疗中晚期胰腺癌可有效提高临床疗效,并可降低患者血清DJ-1 及miR-155 水平,联合方案优于单独放疗。但本组研究临床样本数较少,有待后续扩大临床样本进行更深入研究。
