甲状旁腺癌22例临床病理分析
2020-09-27刘琳洁李道明
刘琳洁 李道明
郑州大学第一附属医院 郑州 450000
甲状旁腺癌(parathyroid carcinoma,PC)是一种罕见的恶性内分泌肿瘤。自Amstrong在1938年首次报道以来,至今国外文献报道不足2 000例[1-2]。由于发病率不高,很多临床病理医师对其缺乏认识。本研究分析22例PC患者的临床资料、组织形态及免疫表型,旨在提高对该疾病的认识,减少误诊。
1 材料与方法
1.1材料收集郑州大学第一附属医院 2013-2019 年间确诊的22例PC,并整理其临床资料。
1.2免疫组化所有标本经10%中性福尔马林溶液固定,常规石蜡包埋,切片厚4μm,经HE染色、光镜观察。采用Envision二步法对标本的石蜡切片进行免疫组织化学染色。所用一抗CK、PTH、CD56、Syn、TG、TTF-1及Ki67等抗体均购自福州迈新生物技术开发公司,经DAB染色。
2 结果
2.1临床资料男13例,女9例;年龄17~72岁,平均46.2岁。10例(45.5%)PC位于左下甲状旁腺,2例(9.1%)位于左上甲状旁腺,6例(27.3%)位于右侧甲状旁腺,1例(4.5%)位于甲状腺;并伴发甲状腺乳头状癌。剩余3例因肿瘤粘连严重,未明确部位。本研究中高钙血症患者20例,血钙水平2.8~4.2 mmol/L(正常值范围2.0~2.6 mmol/L),平均3.3 mmol/L。20例患者PTH水平明显升高,为177.2~2 689.0 pg/mL(正常值16.0~65.0pg/mL),平均为1 070.3 pg/mL。其中8例(36.4%)出现甲状旁腺危象。部分PC 患者伴有器官或系统的异常:54.6%患者伴发骨骼及肾脏损害,表现为膝关节炎症、病理性骨折、骨质疏松、肾结石、肾功能不全等。13.6%患者伴有消化系统症状,如胰腺炎、消化不良、腹胀等。6例(27.3%)可见颈部包块,其中2例无临床症状且实验室指标正常。所有患者均接受手术治疗,完整切除肿瘤及周围粘连组织。
2.2病理特点
2.2.1 大体 肿物直径为1.1~6.5 cm,平均3.1 cm,均为单发。21例PC表面被覆包膜,11例与周围组织粘连、分界不清。肿瘤切面呈灰黄或灰白色,质地软硬不等,实性为主,局部见出血、囊性变。
2.2.2 镜下 20例PC内部可见宽大的胶原纤维,肿瘤组织被分隔成不规则的巢状、岛状、梁状(图1、2、5);21例PC可观察到包膜侵犯(图2),肿瘤包膜明显增厚,并与纤维带移行、连续。7例侵犯周围组织(图3、4);所有PC的肿瘤细胞均可见不同程度的异型性,主要表现为细胞体积增大且排列紊乱,呈圆形或多角形,胞浆透明或嗜酸。细胞核增大且大小不一,核膜不规则,核染色质稍粗,核分裂象增多(>1~3个/10HPF)。7例PC可见病理性核分裂象,核仁明显(图6、7)。本研究中11例可见脉管癌栓,3例可见神经侵犯,1例肺转移,1例胸腺转移,1例颈部淋巴结转移。
2.3免疫表型本研究中,16例PC行免疫组化检测,PTH均呈弥漫阳性。CD56、SYN及CgA仅少数表达,2例局灶阳性,1例弥漫阳性。Galection-3表达率为83.0%。TTF-1、TG、降钙素均为阴性。Ki-67增殖指数为1%~50%,其中>10%者占43.8%,而>5%者占81.3%(图8)。
2.4随访结果18例获得随访,1例5 a后肺转移,1例3 a后胸腺转移,1例6 a后颈部淋巴结转移,剩余15例均无复发或转移。

图1:PC肿瘤组织内粗大的纤维组织分隔(HE;20x)

图2:PC肿瘤包膜增厚,并可见包膜侵犯(HE;4x)

图3、4:PC肿瘤组织侵犯周围脂肪组织及甲状腺组织(HE;10x)

图5:PC肿瘤组织呈小梁状排列(HE:10x)
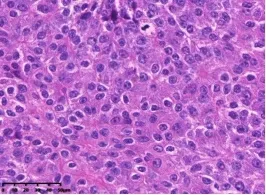
图6、图7:肿瘤细胞核仁明显,可见病理性核分裂象(HE;40x)

图8:Ki-67阳性指数>10%(HE;20x)
3 讨论
甲状旁腺肿瘤发病率较低,而PC更为罕见,是原发性甲状旁腺功能亢进症(primary hyperparathyroidism,PHPT)的少见原因[2-3]。PC的确切病因尚不清楚,多为散发。近年研究发现,颈部放疗史、增生性甲状旁腺以及长期继发性甲状旁腺功能亢进可能会增加PC的患病风险[3]。此外,它还可能作为遗传综合征,如甲状旁腺功能亢进颌骨肿瘤综合征[4]的一部分。本研究未发现相关家族史及颈部放疗史,有待继续扩增病例进行相关研究。
PC患者平均发病年龄45~55岁,男女性别无差异[3]。本研究中,患者年龄(46.2±13.6)岁,男女比例13∶9,与相关报道基本一致。PC的临床表现特异性不高,多与良性的甲状旁腺肿瘤相重叠,最易与甲状旁腺腺瘤(PA)相混淆[3-4],但前者往往更为严重。本文大多数PC患者有原发性甲状旁腺功能亢进症状,半数以上的患者有骨和肾脏的继发性改变,其血钙水平多数>3 mmol/L,PTH水平显著增高,超过正常上限2~40倍,其中36.4%的患者出现甲状旁腺危象。相较于良性肿瘤,PC具有更高的血清钙及PTH水平,更易出现骨和肾的继发改变,且更易出现甲状旁腺危象[4-7]。因此,实验室检查在PC的诊断中具有重要意义。然而,少数PC可为无功能性,其实验室指标均正常[8]。本研究发现2例无功能PC,均因颈部包块入院,平均年龄51.5岁;1例胸腺转移;另1例侵犯周围肌肉组织,病理结果提示有神经侵犯。因此,无功能PC由于缺乏临床症状,往往更为隐秘,更加危险[8-9]。
本文中PC均为单发,体积相对较大,肿瘤平均直径多数>3 cm,且多位于左下甲状旁腺(45.5%),但此部位差异无统计学意义(P>0.05),与既往报道一致[3]。肿瘤切面灰色到白色不等,大多质中,可以附着或侵犯相邻的组织,部分可见出血及囊性变。相比之下,良性甲状旁腺肿瘤通常更小、更软,多呈黄褐色,且较少出现大的囊性变[4]。
镜下大多数PC具有增厚的纤维包膜,且包膜侵犯为PC最常见的侵犯方式,也是PC确诊的依据之一[4,7,10]。但是,肿瘤需穿透包膜才能满足PC的诊断标准[4,6]。本研究中,21例肿瘤可见包膜侵犯,均为穿透性;7例侵犯周围甲状腺、脂肪组织等;仅有1例未见明确的包膜结构,但侵犯周围组织。因此,在诊断过程中,对于肿瘤包膜及周围组织的取材和观察尤为重要。此外,由于取材的局限性,术中冷冻和穿刺活检也并非甲状旁腺肿瘤确诊的依据。本研究中20例PC内可见粗大变性的胶原纤维,并可见小梁结构的形成,提示该疾病具有侵袭性,与多数文献报道一致[2]。虽然粗大的胶原纤维和小梁结构并非特异性表现,但是其发生率远高于良性甲状旁腺病变,仍具有提示意义[4]。脉管癌栓、神经侵犯为恶性肿瘤确诊的客观依据,但并非所有PC均可出现[2]。本研究中11例出现脉管内癌栓,仅3例可见明确神经侵犯,与报道相符。本文PC具有不同程度的细胞异型性,7例可见病理性核分裂象,部分区域>15个/10HPF,少数可见显著的核仁,这与相关文献研究中多数PC“大核仁突出”的发现不太相符[3-4]。远处转移为PC诊断的绝对指标,但发生率较低,肺转移最常见。其次为淋巴结等[3,6]。本文PC中仅3例远处转移,分别于术后3 a、5 a和6 a发现胸腺、肺部、淋巴结转移,目前均存活,与报道基本一致。
通过对免疫表型的分析,研究发现与PA的高表达相反[2-4],本文仅少数病例表达CD56、Syn和CgA,且多为灶性阳性,提示神经内分泌标记可能作为与PA相鉴别的阴性指标,但由于本研究病例较少,仍有待进一步研究。除此之外,相比良性病变中Ki-67指数多<5%[4],本研究中Ki-67多数高表达,>10%者占43.8%、>5%者占81.3%,其中2例发生转移的病例Ki-67均>10%。表明高增殖指数与预后不良有关,且具有鉴别意义。
依据发病部位及形态学特点,PC主要应该与以下肿瘤相鉴别:(1)不典型腺瘤:不典型腺瘤是PA的一种特殊类型,是指肿瘤具备甲状旁腺癌的一些特征,如与周围组织粘连、纤维化、核分裂活跃等,但无浸润生长的证据。与PC不同的是,该肿瘤无明确的包膜、脉管、神经侵犯[3-4]。(2)甲状腺乳头状癌(PTC):发生于甲状腺内的PC应与PTC相鉴别,大部分PTC具有乳头状结构及典型的细胞核形态特点(毛玻璃样核、核沟、核内假包涵体及砂砾体等),且表达TG和TTF-1,而PC则不表达。(3)甲状腺未分化癌:该肿瘤是甲状腺滤泡上皮来源的高度恶性肿瘤,组织形态多样,常常为多种细胞混合存在,部分病例可能与PC有重叠,但免疫表型有助于二者鉴别,甲状腺未分化癌常常表达CK,而TG及TTF-1少量表达,不表达PTH,而PC一般不表达TTF-1和 TG,但PTH为阳性[6]。
目前,完整切除肿瘤及受累组织为PC的首要治疗方法,术后放化疗的作用仍不清楚,效果有待进一步研究[10-11]。研究表明,PC的死亡主要由持续的高钙血症造成,因此,术后控制血清钙水平可提高患者的预后[10]。本研究中22例患者均行扩大的手术切除,随访1~7 a,术后均无复发。患者病程较长,复发率和转移率较低,提示PC 可能是一种惰性生长的恶性肿瘤,大多数预后较好,转移后仍可长期存活[10-11]。
