国内新发危险性橡胶树拟盘多毛孢叶斑病鉴定及其病原学研究
2020-09-26李博勋刘先宝时涛蔡吉苗郑肖兰冯艳丽徐春华黄贵修
李博勋 刘先宝 时涛 蔡吉苗 郑肖兰 冯艳丽 徐春华 黄贵修

摘 要:基于目前橡胶树拟盘多毛孢叶斑病在境外主要植胶国爆发流行的态势,以及对天然橡胶产业经济带来的巨大影响。笔者前期对我国海南、云南、广东等省橡胶主产区的13个农场和胶园进行了病害踏查,在我国海南省乐东县志仲镇乐东保显农场发现了疑似橡胶树拟盘多毛孢叶斑病病样。本研究将该疑似病样病原菌进行分离、纯化和致病力测定,并通过形态学和分子系统学分析,确定该病原菌为新拟盘多毛孢属(Neopestalotiopsis)的Neopestalotiopsis aotearoa Maharachch., K.D. Hyde & Crous;基础生物学特性分析表明,该病原菌菌丝生长和孢子萌发的适宜温度为28 ℃,孢子致死温度为50 ℃;适宜pH为6.5,最适碳源为蔗糖和D-葡萄糖,最适氮源为硝酸钾和大豆蛋白胨;最适培养基为PDA,培养8 d后产孢。初步明确了该病的病原及其基础生物学特性,为提前储备防治该病的相关技术措施提供理论依据。
关键词:橡胶树;拟盘多毛孢叶斑病;病原鉴定;生物学特性
中图分类号:S794.1;S763.7 文献标识码:A
Abstract: Based on the current outbreak and epidemic situation of a novel Neopestalotiopsis leaf fall disease of rubber trees (Hevea brasiliensis) in major rubber planting countries abroad and its great impact on natural rubber industry economy, the authors conducted a preliminary inspection on 13 farms and rubber plantations in main rubber producing areas in Hainan, Yunnan and Guangdong provinces, and found suspected disease samples in Baoxian Farm, Zhizhong Town, Ledong County, Hainan. In this study, the pathogens of the suspected disease samples were isolated, purified and the pathogenicity was determined. Through morphological and molecular phylogenetic analysis, the pathogen was identified as Neopestalotiopsis aotearoa Maharachch., K.D. Hyde & Crous. The basic biological characteristics showed that the suitable temperature for the mycelial growth and spore germination was 28 ℃, the lethal temperature of spores was 50 ℃. The optimum pH value was 6.5, the optimum carbon sources were sucrose and D-glucose, the optimum nitrogen sources were potassium nitrate and soybean peptone, and the optimum medium was PDA, which could produce spores after eight days. The pathogen and its basic biological characteristics were preliminarily identified, which would provide theoretical basis for the reserve of related technical measures for the prevention and control of the disease in advance.
Keywords: Hevea brasiliensis; Neopestalotiopsis leaf fall disease; pathogen identification; biological characteristics
DOI: 10.3969/j.issn.1000-2561.2020.08.016
橡膠树(Hevea brasiliensis)原产于南美洲的亚马逊河流域,主要分布在巴西、秘鲁和哥伦比亚,其中,巴西是南美洲最主要的产胶国。由于受到橡胶树南美叶疫病(South American Leaf Blight,SALB)的严重影响,导致全球天然橡胶产业格局发生了重大的、历史性的转变,由原产地南美洲向亚洲、非洲等地迁移。目前,全球的天然橡胶主要分布在东南亚、南亚和非洲地区,其中亚洲的产胶量占全球的90.8%。天然橡胶是我国重要的战略性物质资源,也是关系到国计民生和国家安全建设的可再生绿色资源。自2011年后,随着全球天然橡胶贸易价格的不断下滑,引发了橡胶产业经济下滑、胶林减毁、胶农贫困等一系列问题[1]。胶园的长期失管,使得许多新病害在一些植胶国频繁爆发流行。2014年在我国海南主要农场的中小龄胶树和开割树上普遍爆发流行的由Fusarium solani引起的茎杆溃疡病,引起胶树爆皮流胶,中小龄苗枝条回枯[2];同年在云南西双版纳发现的由F. oxysporum引起的茎基腐病,导致胶树茎杆基部腐烂流胶[3];2015年在云南西双版纳发现了由Alternaria alternata引起的黑斑病[4];2016年在马来西亚、印度尼西亚、越南爆发流行的由Neofusicoccum ribis引起的橡胶树壳梭孢叶斑病,也引起很大的关注[5]。2019年9月,国际橡胶研究与发展委员会(IRRDB)年会的橡胶生产国联合发布,由拟盘多毛孢属(Neopestalotiopsis sp.)真菌引起的橡胶树拟盘多毛孢叶斑病已在马来西亚、印度尼西亚、斯里兰卡等多个植胶国家爆发流行,导致橡胶树大量落叶,疫情扩散蔓延迅速,短时间内难以得到有效防控,造成了巨大的经济损失,引起各植胶国的高度重视[6]。2019年,该病已在印度尼西亚的北苏门答腊(North Sumatra)、南苏门答腊(South Sumatra)、邦加(Bangka)等8个省、17个橡胶农场爆发流行,发病面积达103 254 hm2,落叶率达75%~90%,且田间无抗性品种[7]。2019年1月,在泰国南部的那拉提瓦省(Narathiwas)首次发现该病,之后迅速蔓延至邦纳(Pangna)、苏拉塔尼(SuratThani)、宋克拉(Songkhla)等8个省,截止2020年1月泰国累计发病面积达112 530 hm2,并且受西南季风影响,该病害可能会进一步蔓延至泰国东部地区以及柬埔寨[8]。短短几年时间该病在亚洲的主要植胶国爆发流行,潜在威胁巨大。
基于目前该病害在主要植胶国爆发流行的态势,以及对天然橡胶产业经济带来的严重影响。2020年5—7月,笔者先后对海南乐东保显农场、白沙大岭农场、琼中阳江农场、儋州西联农场、国家橡胶树种质资源圃;广东农垦总局下设的五一农场、南华农场、建设农场、红峰农场、广东农垦热带作物研究所、中国热带农业科学院南亚热带作物研究所;云南省热带作物科学研究所、河口蚂蝗堡农场等13个农场和橡胶园进行橡胶树拟盘多毛孢叶斑病的踏查,结果发现,在海南省乐东县志仲镇乐东保显农场(18°37′30.27″N,109°19′58.47″E)2年生的橡胶实生苗上发现了疑似橡胶树拟盘多毛孢叶斑病病样。此外,笔者在白沙大岭农场的老胶园里也发现了疑似病样,其他农场以及中小龄和成龄胶树上尚未发现该病的疑似病样。鉴于该病在全球属于新发病害,在我国也是首次发现,目前也只是在橡胶实生苗上零星发生,尚未造成大面积危害。为此,为了更好地应对、预防和监测该病在国内的发生和危害,本研究将前期发现的疑似病样进行分离、纯化、鉴定、病原学以及多基因序列分析,对病原菌进行鉴定,并研究其基础生物学特性,更好地了解病害的基本情况,为提前储备防治该病的相关技术措施提供理论依据。
1 材料与方法
1.1 材料
1.1.1 病样 病样于2020年5月采自我国海南省乐东县志仲镇乐东保显农场(18°37′30.27″N,109°19′58.47″E)。
1.1.2 供试菌株和材料 2株拟盘多毛孢菌株(表1)均由中国热带农业科学院环境与植物保护研究所分离、鉴定与保存;从NCBI数据库中下载了19个拟盘多毛孢模式种的基因信息(表1)与国内的菌株共建系统发育树;致病力测定选用的橡胶树品种为PR107,由中国热带农业科学院环境与植物保护研究所演丰基地保存。
1.1.3 培养基和试剂 用于分析病原菌生长特性所用的PDA培养基、Richards培养基、玉米培养基、胡萝卜培养基、V8培养基、燕麦培养基等均参照《植病研究方法》配制[9]。引物(表2)均由深圳华大基因科技有限公司合成;PCR扩增反应所需的Buffer、Taq DNA聚合酶、dNTP、DNA Marker等购自天根生化科技(北京)有限公司。DH5α大肠杆菌Escherichia coli感受态细胞购自宝生物工程(大连)有限公司。其他化学试剂、药品等均为国产分析纯。
1.1.4 仪器与设备 Bio-Rad T100型梯度PCR仪,美国伯乐公司;UVI FireReader凝胶成像系统,英国UVItec公司;Nikon NI/E型生物智能荧光显微镜,日本Nikon公司。
1.2 方法
1.2.1 病菌分离、纯化及其致病性测定 采用常规病原菌分离方法[9]对橡胶树拟盘多毛孢疑似病样叶片进行病原菌的分离及纯化。依照柯赫氏法则[11],选取田间健康橡胶树叶片(品种为PR107)置于带有吸水纸的托盘内,采用菌饼穿刺接种法[12]将分离物接种到淡绿色期的橡胶叶片上,以不含病原菌的PDA培养基作为空白对照,每个处理3个重复,然后将接种后的样品置于28 ℃培养箱中保湿培养,每天观察叶片的发病情况,5 d后从病、健交界处重新分离、纯化病原菌,从菌落形态、培养性状以及孢子形态特征上与最初分离得到的菌株进行对比,确认病原菌的致病性。
1.2.2 病原鉴定 形态学鉴定:观察并记录病原菌在PDA培养基上的菌落形态、菌丝颜色、产孢情况等特征。用显微镜观察分生孢子的形态特征、颜色、大小、附属丝长度等。
分子生物学鉴定:采用CTAB方法[10]提取病原菌基因组DNA,用ITS、TEF、TUB等多基因的引物序列(表2)对病原菌目的基因進行PCR扩增,扩增程序和条件参照Pornsuriya等[10]的方法,扩增产物用1%的琼脂糖凝胶电泳进行检测,并对目的条带切胶回收,然后将目的基因连接到pMD18-T载体上,转化DH5α感受态细胞,37 ℃培养过夜,挑选阳性克隆转化子,其中的3个克隆送至深圳华大基因科技有限公司进行序列测定。
1.2.3 多基因序列分析、遗传距离计算和系统发育树构建 将ITS、TEF、TUB等基因序列在NCBI中进行单基因序列的BLAST比对,利用CodonCode Aligner V7.0.1去除测序峰图的低质量区域,完成峰图校对拼接和引物序列切除,然后将ITS、TEF、TUB的部分序列进行拼接,应用PAUP 4.0软件计算种内遗传距离;利用MEGA 10软件最大似然法中的Tamura-Nei model构建系统发育树。
1.2.4 病原菌基础生物学特性测定 在PDA培养基上培养8 d的菌落中,加入5 mL灭菌水洗下孢子,制成浓度为1.0106个/mL的孢子悬浮液,再滴到干净的载玻片上,同时用无菌打孔器在菌落边缘打取直径为4.5 mm菌龄相同的菌饼接种到PDA培养基平板上,然后分别将载玻片和接菌的PDA平板置于10、15、20、25、28、30、35、40 ℃的恒温培养箱中培养,8 h后统计孢子的萌发率,7 d后观察不同温度下菌丝的生长情况。用1 mol/L NaOH和1 mol/L HCl调节PDA培养基的pH为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5,高温高压灭菌后制成平板备用,每个pH 3个重复;用等当量的C源:蔗糖、葡萄糖、D-木糖、D-山梨醇、D-乳糖、D-果糖、D-麦芽糖,氮源:KNO3、NH4NO3、(NH4)2SO4、NH4Cl、(NH4)2C2O4、牛肉浸膏、大豆蛋白胨依次替换Richards培养基中的蔗糖和KNO3,以不加任何C源(蔗糖)和N源(NaNO3)的Richards培养基作为对照,高温高压灭菌灭菌后,制成平板备用,每个碳、氮源3个重复;分别配制燕麦、玉米、胡萝卜、麦芽、PDA、PSA、LB、V8、Richards培养基,每种培养基重复3次。然后将病原菌依次接种到不同pH,不同碳、氮源的培养基平板中央并置于28 ℃恒温箱培养。7 d后观察不同条件下病原菌的生长情况。
1.3 数据处理
采用十字交叉法测量病原菌的菌落直径,计算菌丝的生长速率,采用SAS 9.0软件对数据进行统计分析。
2 结果与分析
2.1 田间症状及病原菌的分离
2020年5月,笔者在海南省乐东县保显农场的2年生橡胶实生苗的老叶上发现了疑似橡胶树拟盘多毛孢叶斑病的症状,叶片受害部位最初褪绿呈黄色水渍状,随后形成黑褐色、近圆形的病斑(图1A),病斑进一步扩大形成中央灰白色,外围有黑褐色坏死线和黄色晕圈的病斑,受害叶片从叶柄处脱落,仅剩下叶柄挂在树上(图1B、图1C);湿度大时,在病斑中央散生许多小黑点。另外,时涛等[13]在泰国甲米府调查过程中发现,该病除叶片外还能为害嫩梢、嫩枝、绿色胶果、种子等。但在国内尚未发现该病为害嫩枝和胶果。将病样采回实验室,从病健交界处分离病原菌,将病原菌进行单孢纯化后保存,菌株编号为HNPeHNLD2001和HNPeHNLD2002。
按照柯赫氏法则[11]将分离获得的HNPeHNLD2001和HNPeHNLD2002菌株进行致病性测定,结果表明:分离得到的2株病原菌,经致病力测定后的发病症状与田间自然发病的症状相同,然后在发病部位将病原菌进行分离,所得病原菌从菌落形态、培养性状以及孢子的形态特征都与在田间自然发病分离得到的病原菌的形态特征相同,说明分离得到的2株病原菌为疑似病样的致病菌(图2)。
2.2 病原鉴定
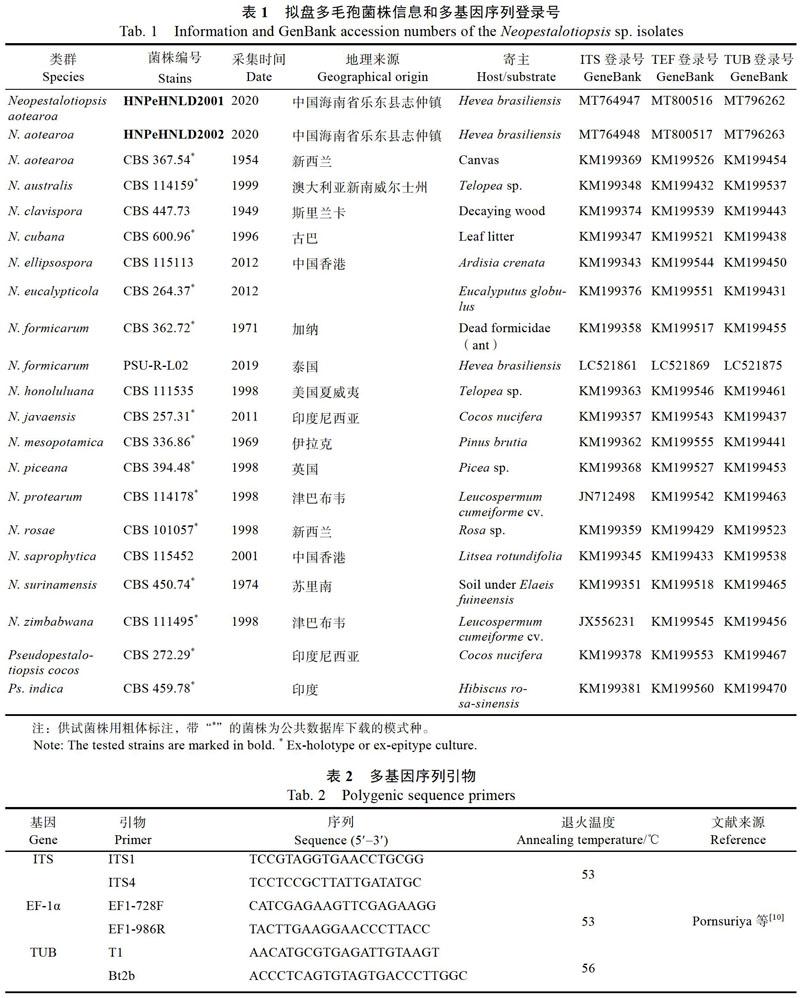
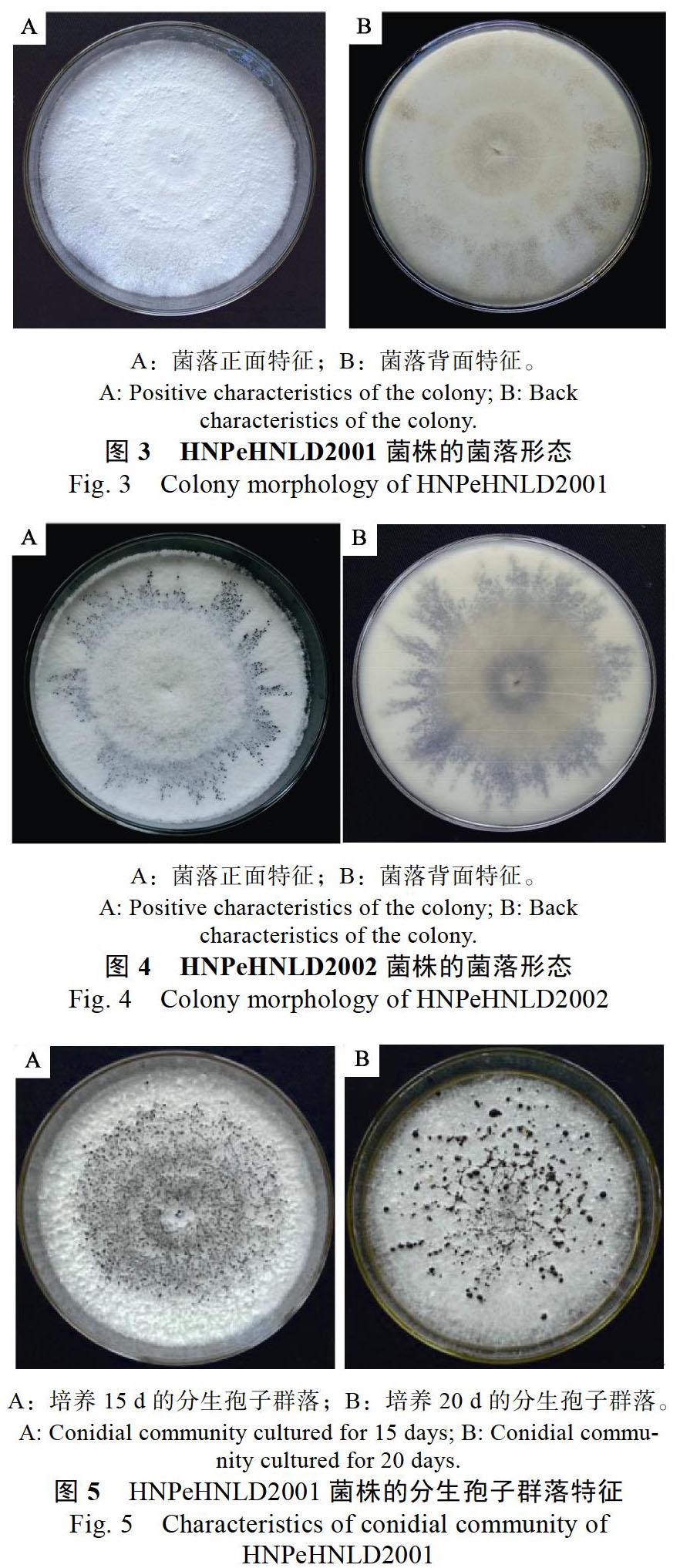
2.2.1 形态学鉴定 HNPeHNLD2001和HNPeHNLD2002菌株在培养性状上略有差异,但孢子形态特征相同。HNPeHNLD2001菌株在PDA培养基上的菌落边缘成波浪状,一层一层向外生长;菌丝白色浓密,菌落背面略微黄色(图3)。HNPeHNLD2002菌株在PDA培养基上的菌落圆形、边缘整齐无波浪状;菌丝白色浓密,菌落背面略微黄色(图4)。2个菌株在PDA上培养8 d后开始产孢,15~20 d后在菌丝上散生着许多黑色的分生孢子群落(图5)。显微镜观察发现:病原菌的分生孢子长梭形,有的稍微弯曲,每个分生孢子是4隔5细胞;分生孢子大小为18.35~ 27.12 ?m×(4.11~7.03)?m(随机测量100个以上的分生孢子),中间3个细胞均为褐色,成熟的有色胞第三色胞颜色略浅,浅褐色,第二色胞颜色最深,深褐色,第三色胞次之;有色胞长12.53~18.97(15.26)?m。顶胞和尾胞均为三角形,无色透明;顶胞上着生无色附属丝,2~3根,长14.7~25.3(19.94)?m;尾胞上着生一根基部附属丝,中生,长3.13~7.13(5.48)?m(图6);芽管是从第三个有色胞侧面萌发。参照Maharach-chikumbura等[14]的研究结果,从培养性状和孢子形态特征上与Neopestalotiopsis aotearoa的描述最为接近(表3)。
2.2.2 多基因序列分析及病原菌种群鉴定 用ITS1/ITS4、EF1-728F/EF1-986R和T1/Bt2b 3种引物对HNPeHNLD2001和HNPeHNLD2002菌株进行ITS区、EF-1α和TUB序列扩增,分别得到大小约为513、264、808 bp的条带。菌株序列在NCBI经BLAST比对分析,均为新拟盘多毛孢属真菌(Neopestalotiopsis sp.),并将各单基因的序列提交至GeneBank(表1)。通过序列间的比对发现,在ITS1区的第35位点存在单核苷酸多态性(A/G),在466位点处有一个T的缺失;在TUB序列的第137位點存在单核苷酸多态性(T/C),其他序列完全一致。
采用3种多基因的部分序列进行拼接,将HNPeHNLD2001和HNPeHNLD2002菌株与NCBI下载的拟盘多毛孢模式种共同构建系统发育树(图7),发现3个基因的加和序列能较好地反映新拟盘多毛孢(Neopestalotiopsis sp.)种间和种内的遗传关系,有较高的种间、种内的区分度和分辨率,多数的进化分枝都有较高自举支持率,不同模式种的菌株间也存在丰富的遗传多样性。根据多基因序列聚类分析,利用最大似然法,在相似系数为0.97时可将国内的HNPeHNLD2001和HNPeHNLD2002两个菌株与N. aotearoa(CBS 367.54)划分在同一分支上,遗传距离最近,支持率为70%。这与泰国Pornsuriya等[10]报道的2种橡胶树拟盘多毛孢叶斑病菌N. formicarum和N. cubana存在一定差异,亲缘关系较远。为此,结合形态学鉴定和多基因序列分析结果,将国内为害橡胶树的拟盘多毛孢叶斑病病原鉴定为半知菌类、腔孢纲、黑盘孢目、新拟盘多毛孢属(Neope-stalotiopsis)的N. aotearoa Maharachch., K.D. Hyde & Crous。
2.3 病原菌生物学特性分析
生物学特性测定结果发现,HNPeHNLD2001和HNPeHNLD2002菌株菌丝生长的最适温度为28 ℃,低于15 ℃和高于35 ℃将会抑制病原菌的生长(图8A);分生孢子适宜温度范围在28~30 ℃之间,最适温度是28 ℃,低于10 ℃或高于40 ℃都会影响孢子的萌发(图8B);50 ℃为孢子的致死温度。菌丝生长适宜的pH为6.5(图8C)。2个菌株在含D-乳糖培养基中的菌丝生长最快,但菌丝十分稀薄,长势不好;在含有蔗糖和D-葡萄糖的培养基中菌丝浓密、生长旺盛,说明蔗糖和D-葡萄糖是该菌生长的最适C源(图8D)。另外,2个菌株以硝酸盐为N源的利用率明显优于铵盐,在含KNO3和大豆蛋白胨的培养基上生长速度最快,菌丝最浓密,是该菌生长的最适N源(图8E)。在供试的9种培养基中,2个菌株在PDA和PSA上的生长最好,在PSA上的产孢量最多(表4)。
3 讨论
2017年11月在马来西亚和印度尼西亚首次发现橡胶树拟盘多毛孢叶斑病,之后迅速蔓延。该病导致成熟叶片大量脱落,严重影响橡胶树的光合作用,中小龄胶树叶片脱落,枝条回枯,成龄胶树减产50%以上[7]。据报道,在马来西亚很多无性系种质如:RRIM2001、RRIM2025、RRIM2023、PB260和PB350均受害,且目前尚无田间抗性种质,截止2019年12月,该病已在马来西亚的9个州发生为害[15],并且在印度尼西亚、泰国、斯里兰卡等主要植胶国爆发流行,潜在巨大威胁。2020年5—7月,笔者通过调查,在海南省乐东县保显农场发现了疑似橡胶树拟盘多毛孢叶斑病的症状,通过形态学和分子系统学的鉴定最终确定采集的疑似病样为Neopestalotiopsis aotearoa引起的橡胶树拟盘多毛孢叶斑病。该病目前在我国胶园尚未造成大面积为害,但也不能忽视其潜在的危害性。
新拟盘多毛孢属(Neopestalotiopsis)真菌是热带和亚热带地区广泛存在的一类真菌。这类真菌的植物来源广泛,寄主专一性不高,属兼性寄生菌,以多种营养方式生存,且各种营养方式之间可以相互转变,适应能力强,能够引起多种植物的病害,是一种重要的植物病原菌[16]。据国内报道,该菌能侵染为害50多科植物,特别是茶等经济作物和园林观赏植物受害严重,能形成叶斑、叶枯、枝枯、根腐及果实溃疡等症状,严重影响作物的产量、品质和观赏性[17]。拟盘多毛孢属(Pestalotiopsis)是Steyeaer于1949年建立命名的,从盘多毛孢属(Pestalotia)分离出来的分生孢子具5细胞的一个属,按照新的分类系统,Pestalotiopsis属于无性态真菌(Anamophic fungi),其有性态(Pestalosphaeria Margret﹠Barr)很难发现[18]。长期以来,拟盘多毛孢属的分类及种的鉴定主要依据分生孢子形态特征来区分,但是培养基和培养条件会对分生孢子的形态特征产生一定影响,使得每个菌株的培养性状存在一定的变化,主要表现在分生孢子的颜色、形态和附属丝的长度等。仅仅依据形态学特征来鉴定拟盘多毛孢属及其近缘属,会导致种间界限严重重叠,不能准确反映系统关系,因此,结合形态学与分子系统学的手段,从遗传进化上来分析拟盘多毛孢属的多样性,对其种和近缘种的鉴定更为准确[19]。
本研究基于国内新发拟盘多毛孢叶斑病菌的形态学,利用ITS、EF-1α和TUB 3个基因序列共同构建系统进化树,将其病原鉴定为新拟盘多毛孢属(Neopestalotiopsis)的N. aotearoa。该菌最早于1954年在新西兰Canvas发现的一种致病菌,它主要营兼性寄生生活,目前在其他作物上鮮有报道。从系统进化树来看N. aotearoa分属于N. piceana的一个分枝(图7),遗传距离较近,但在分生孢子的形态特征上存在明显差异[14]。Febbiyanti等[20]报道的马来西亚橡胶树拟盘多毛孢病原为Pestalotiopsis sp.,暂未鉴定到种;Pornsuriya等[10]研究发现引起泰国橡胶树拟盘多毛孢叶斑病的病原有N. cubana和N. formicarum。泰国和马来西亚报道的橡胶树拟盘多毛孢叶斑病病原与我国的不是同一个种,推测是国内本地种侵染上来的,极可能适应国内的气候环境,从病害的发病条件、爆发流行的环境因素、病原菌的适生性等方面都可能不同于泰国和马来西亚病原,为此,研究国内菌株病原学就尤为重要。从基础生物学特性分析结果来看,该菌喜酸性的环境条件,温度高于35 ℃,低于10 ℃均不利于该菌生长,且高温高湿有利于孢子的萌发。该病在田间的典型症状为病斑中央灰白色,边缘黑褐色坏死线,周围有明显的黄色晕圈,这与Pornsuriya等[10]报道的泰国的基本一致。人工接种的叶片至第5天后能出现与田间自然发病相同的症状,但形成的坏死线和黄晕没有田间自然发病条件下的明显,保湿培养下能在病斑中央看到黑色的分生孢子群落。
橡胶树拟盘多毛孢叶斑病在我国属于新发危险性病害,在亚洲主要植胶国已经造成了巨大的经济损失,在国际上也备受关注。由于该病在各国的为害程度不一样,管控措施也不相同,对该病的了解程度也不一样,目前尚未形成防治该病的完整的技术体系。近年来,由于受国际天然橡胶市场价格的影响,橡胶产业经济严重下滑,很多胶园都处于弃管状态,新病害频频发生,次要病害也上升为主要病害,长此以往,病害的防治难度也将越来越大。因此,为了更好地应对、预防和控制该病在国内进一步的发生和为害,应积极探索病害的发生规律及流行条件,为提前储备防治该病的相关技术措施提供理论依据。同时也呼吁广大的橡胶生产单位、农场及相关科研人员,密切关注该病的发生、发展动态,及时掌握病害疫情,储备相关防治技术措施,严防该病的进一步传播与蔓延。
参考文献
李 达, 张绍文. 天然橡胶产业发展政策分析: 红线与红利[J]. 林业经济问题, 2020, 40(2): 208-215.
周雪敏, 刘先宝, 李博勋, 等. 橡胶树新发茎杆溃疡病病原鉴定及其生物学特性测定[J]. 热带作物学报, 2016, 37(4): 758-765.
Li B X, Shi T, Liu X B, et al. First report of rubber tree stem rot caused by Fusarium oxysporum in China[J]. Plant Disease, 2014, 98(7): 1008-1008.
Cai Z Y, Liu Y X, Li G H, et al. First report of Alternaria alternata causing black spot of rubber tree in China[J]. Plant Disease, 2014, 98(7): 1011
Nyaka Ngobisa A I C, Zainal Abidin M A, Wong M Y, et al. Neofusicoccum ribis associated with leaf blight on rubber (Hevea brasiliensis) in Peninsular Malaysia[J]. Plant Pathology Journal, 2013, 29(1): 10-16.
Tajuddin Ismail. Pestalotiopsis outbreak in Bumi Rambang plantation in Palembang: Report of meeting on collaborative research on Pestalotiopsis[Z]. Indonesia and Malaysia, 2019.
International Rubber Research Institute(IRRI). Identification, bioecology and management to control Pestalotiopsis leaf fall diseases in rubber[Z]. Indonesia, 2019.
Tajuddin Ismail. Recent outbreak of Pestalotiopsis leaf diseases in South East Asia: Meeting of experts on Pestalotiopsis leaf disease[Z]. Surat Thani Province, Thailand, 2020.
方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 63.
Pornsuriya C, Chairin T, Thaochan N, et al. Identification and characterization of Neopestalotiopsis fungi associated with a novel leaf fall disease of rubber trees (Hevea brasi-
liensis) in Thailand[J/OL]. Journal of Phytopathology, 2020 [2020-07-25]. https://www.researchgate.net/publication/341512722_Identification_and_characterization_of_Neopestalotiopsis_fungi_associated_with_a_novel_leaf_fall_disease_of_rubber_trees_Hevea_brasiliensis_in_Thailand.
Georgen Agrios. 植物病理學[M]. 沈崇尧, 译. 北京: 中国农业大学出版社, 2009.
李博勋, 刘先宝, 林春花, 等. 国内橡胶树主要种质对棒孢霉落叶病的抗性评价[J]. 植物保护, 2014, 40(5): 86-92.
时 涛, 李博勋, 郑肖兰, 等. 橡胶树新发拟盘多毛孢叶斑病的危害与防控对策[J]. 热带农业科学, 2020, 40(1): 1-6.
Maharachchikumbura S S N, Hyde K D, Groenewald J Z, et al. Pestalotiopsis revisited[J]. Studies in Mycology, 2014, 79(11): 121-186.
Adam Malik Ahmad. Outbreak of Pestalotiopsis leaf fall in Malaysia: Meeting of experts on Pestalotiopsis leaf disease [Z]. Surat Thani Province, Thailand, 2020.
Maharachchikumbura S S N, Liang-Dong G, Ekachai C, et al. A destructive new disease of Syzygium samarangense in Thailand caused by the new species Pestalotiopsis samarangensis[J]. Tropical Plant Pathology, 2013, 38(3): 227-235.
宋 玉. 拟盘多毛孢属(Pestalotiopsis)真菌系统学研究及条形码基因的评价[D]. 贵阳; 贵州大学, 2015.
Steyaert R L. Contribution a l'etude monographique de Pestalotia de Not et Monochaetia Sacc. (Truncatella gen. nov. et Pestalotiopsis gen. nov.)[J]. Bulletin du Jardin Botanique de 16tat Bruxelles, 1949, 19: 285-358.
韦继光, 徐 同, 郭良栋, 等. 根据形态学和分子系统学特征界定拟盘多毛孢属的种[J]. 广西农业生物科学, 2005(4): 304-313.
Febbiyanti T R. Outbreak of Pestaloiopsis in Indonesia: IRRDB meeting of the experts on new leaf disease[Z]. Kuala Lumpur, 2019.
