佳乐麝香对斑马鱼胚胎甲状腺激素的影响
2020-09-21李明尹晓宇陈浩王欢宋磊董文静赵宝全于永利董武杨景峰
李明,尹晓宇,陈浩,王欢,宋磊,董文静,赵宝全,于永利,3,#,董武,#,杨景峰,*
1. 内蒙古民族大学动物科学技术学院,内蒙古自治区毒物监控及毒理学重点实验室,通辽 028000 2. 军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京100850 3. 内蒙古民族大学生命科学与食品学院,通辽 028000
天然麝香产量少,价格昂贵,目前市场上供应的麝香主要是合成麝香(synthetic musks)[1]。合成麝香不但广泛用于日化用品,且在烟草以及动物饲料中也有添加。近年来,由于多环麝香(polycyclic musks, PMs)生产成本低,逐渐替代了市场中占据主导地位的硝基麝香(nitro-musks, NMs)[2]。PMs中佳乐麝香(galaxolide, HHCB)是用量较大,使用范围较广的合成麝香,研究发现,HHCB在109种个人护理品中的平均浓度约为958.19 μg·g-1[3]。而Lu等[4]针对158种个人护理品中合成麝香情况进行检测,发现约82%的个人护理品中含有合成麝香,其中PMs中HHCB的检出率达到了78%。HHCB成为皮肤接触暴露最为严重的合成麝香,估算暴露量约为18~237 μg·d-1,更为严重的是,HHCB的使用残留会造成一定的生物蓄积[4]。Wong等[5]在对城市和周边环境中合成麝香进行检测时发现,HHCB是室内空气(0.30~18 ng·m-3)、室外空气(0.99 ng·m-3)、地表水(0.031 ng·m-3)和废水(1 000~1 800 ng·L-1)中含量最高的合成麝香。此外,Fromme等[6]在柏林地区检测到污水处理厂废水中HHCB的浓度甚至达到0.07~1.59 g·L-1。
随着麝香类化合物的大量和广泛使用,已经造成其在不同环境介质和生物体内大量蓄积,在河流、湖泊、淤泥、近海及人的脂肪和乳汁中都发现了合成麝香的残留[7-12],对水生生物和人类健康造成潜在威胁。PMs可导致斑马鱼胚胎发育迟缓、体轴弯曲、心率降低及血管通透性改变甚至消失等现象[13-14]。Pablos等[15]认为合成麝香可导致非洲爪蟾(Xenopuslaevis)甲状腺上皮细胞肥大以及甲状腺激素调节的紊乱,甲状腺素是甲状腺滤泡细胞分泌的一种重要的活性物质,可影响胚胎发育、孵化以及心脏机能的改变[16]。甲状腺机能亢进会造成动物全身血管阻力下降、心率上升、射血分数增加和心输出量增加,甲状腺机能减退表现出与之相反的症状,严重者甚至引发心包积液,造成心脏压塞[17-20]。
斑马鱼(Daniorerio)是一种小型热带淡水鱼,因其体型小便于繁育和操作、早期发育通体透明容易观察,同时对很多化学物质非常敏感等诸多优点,成为一种优良的模式动物[21-22]。在药物筛选、胚胎发育和疾病研究中被广泛使用[23-31]。已成为生命科学研究中重要的生物疾病模型。本研究以斑马鱼作为模式动物,探讨HHCB对斑马鱼胚胎发育的影响,特别是对甲状腺激素及关联基因的影响。
1 材料与方法(Materials and methods)
1.1 实验材料
试验动物:斑马鱼(Daniorerio),AB系,饲养于循环水养殖系统(北京爱生科技发展公司),雌雄鱼分开饲喂,光照周期为14 h∶10 h。养殖温度保持在(28.5±1) ℃,pH保持在7.0~7.6,电导率保持在440~640 μS。繁殖时选取健康的成年斑马鱼按照雌雄鱼1∶2的比例放入交配缸中,待第2天早上,斑马鱼见光产卵,30 min后即可获得受精卵。清洗受精卵后,在体式显微镜下挑出受精后2~4 h (hours post fertilization, hpf)健康的同期斑马鱼胚胎进行实验。
实验试剂:佳乐麝香,分子量258.40,纯度为50%,CAS号为1222-05-5,购自东京化成工业株式会社。总RNA提取试剂盒、反转录试剂盒和二甲基亚砜(DMSO)(分析纯)等均购自于美国Sigma公司。
1.2 佳乐麝香对斑马鱼胚胎的暴露
HHCB暴露实验分别设有对照组(体积分数为0.1%的DMSO)和HHCB实验组,参照HHCB环境浓度0.07~1.59 g·L-1(258.4 mg·L-1=1 mmol·L-1)[5]和预实验结果,HHCB实验组浓度设为:0.005、0.01、0.02、0.03、0.04、0.1和0.2 mmol·L-1(1.292、2.584、5.168、7.752、10.336、25.84和51.68 mg·L-1),HHCB用助溶剂DMSO稀释后制成HHCB实验液。选取2~4 hpf的斑马鱼胚胎随机分配到六孔板中,每孔10枚斑马鱼胚胎,每组设置5个平行,每孔加入5 mL斑马鱼胚胎培养液和5 μL HHCB实验液(对照组加入5 μL DMSO),将胚胎置于28 ℃恒温培养箱(型号51031566,美国Thermo Fisher Scientific公司)中培养。
1.3 斑马鱼胚胎发育毒性检测
HHCB暴露后,在体式显微镜(M205a,德国Leica)下观察并记录24、48、72、96和120 hpf时期斑马鱼胚胎的死亡、孵化和心脏发育状况。
1.4 斑马鱼胚胎心囊面积测定
根据斑马鱼胚胎死亡率结果,确定HHCB实验组浓度为:0.005、0.01、0.02、0.03和0.04 mmol·L-1(1.292、2.584、5.168、7.752和10.336 mg·L-1)。在体式显微镜下,观察和拍摄72 hpf和96 hpf各组斑马鱼胚胎的心脏发育形态,并使用Image J图像软件定量分析斑马鱼心囊面积,每个实验组测量6个样本,统计分析不同实验组斑马鱼胚胎心囊面积之间的差异。
1.5 总RNA的提取以及基因表达的相对定量(RT-qPCR)
结合前期实验结果,RT-qPCR实验中HHCB暴露浓度设为:0.005、0.01和0.02 mmol·L-1(1.292、2.584和5.168 mg·L-1),将斑马鱼胚胎分别培育到24、48和72 hpf,清洗掉培养液后收集到1.5 mL离心管中,进行总RNA提取,RNA反转录成cDNA后,以Gapdh为内参基因,进行RT-qPCR的定量分析,实验方法与步骤参照Dong等[32]的方法。引物序列见表1采用2-△△CT方法计算基因表达的相对变化。
1.6 佳乐麝香对斑马鱼甲状腺激素的影响
挑选2~4 hpf斑马鱼胚胎进行实验,设置成对照组与0.005、0.01和0.02 mmol·L-1(1.292、2.584和5.168 mg·L-1) HHCB共4个处理组,每个处理3个平行,每组100枚胚胎。在平皿中培养至72 hpf,用1×PBS进行冲洗3遍,将胚胎收集到1.5 mL的离心管中,添加400 μL的1×PBS,快速匀浆后在超高速冷冻离心机(5420R,德国Eppendorf)4 ℃和12 000 r·s-1的条件下,离心5 min,取3次100 μL上清液,分装在新的1.5 mL的离心管中,用ELISA试剂盒检测总四碘甲状腺原氨酸(TT4)和总三碘甲状腺原氨酸(TT3)的含量。
1.7 统计方法
实验数据统计使用Graphpad Prism 5和SPSS.20分析软件,进行单因素方差分析(One-Way ANOVA),P<0.05时表示差异具有统计学意义。
2 结果(Results)
2.1 佳乐麝香对斑马鱼死亡率的影响
在24、48、72、96和120 hpf时,统计HHCB对斑马鱼胚胎造成的死亡情况,表现为显著的浓度依存性和时间依存性。检测对照组的死亡率为0,而随着暴露时间和暴露浓度的增加,HHCB实验组的斑马鱼胚胎死亡率也逐渐升高。0.1 mmol·L-1和0.2 mmol·L-1(25.84 mg·L-1和51.68 mg·L-1)HHCB实验组在24 hpf出现死亡,培养到48 hpf引起100%的死亡(图1) (P<0.001)。在72 hpf时,0.04、0.1和0.2 mmol·L-1(10.336、25.84和51.68 mg·L-1)组的死亡率分别为70%、100%和100%,与对照组相比差异显著(P<0.001)。在96 hpf时,0.03 mmol·L-1组死亡率为18%(P<0.05),0.04、0.1和0.2 mmol·L-1(10.336、25.84和51.68 mg·L-1)组的死亡率与对照组相比差异显著(P<0.001)。在120 hpf时,与对照组相比,0.01、0.02、0.03、0.04、0.1和0.2 mmol·L-1(2.584、5.168、7.752、10.336、25.84和51.68 mg·L-1)组的死亡率差异显著(P<0.001)。使用SPSS.20计算出24、48、72、96和120 hpf HHCB的LC50分别为0.076、0.053、0.046、0.037和0.008 mmol·L-1(19.638、13.695、11.886、9.561和2.067 mg·L-1)。

表1 RT-qPCR的引物序列Table 1 Primer sequences for RT-qPCR
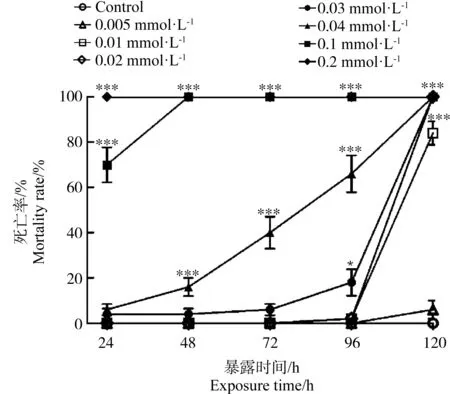
图1 不同浓度佳乐麝香(HHCB)暴露对斑马鱼胚胎(幼鱼)死亡率的影响注:星号(*)表示HHCB实验组与对照组之间的显著差异(*P<0.05,***P<0.001;n=10)。Fig. 1 Mortality rate of zebrafish embryos (larvae) in galaxolide (HHCB) treatments with different concentrationsNote: The asterisk (*) indicates significant difference between the HHCB experimental groups and the control group (* P<0.05, ***P<0.001; n=10).
2.2 佳乐麝香对斑马鱼孵化率的影响
在72 hpf时,统计对照组与0.005、0.01、0.02、0.03和0.04 mmol·L-1(1.292、2.584、5.168、7.752和10.336 mg·L-1)HHCB实验组斑马鱼胚胎的孵化率(图2)。结果显示,对照组、0.005 mmol·L-1和0.01 mmol·L-1(1.292 mg·L-1和2.584 mg·L-1)HHCB实验组的孵化率均为100%。而随着HHCB暴露浓度的增加,0.02、0.03和0.04 mmol·L-1(5.168、7.752和10.336 mg·L-1)HHCB实验组斑马鱼的孵化率分别为26.67%、3.33%和0%,均显著低于对照组的孵化率(P<0.001)。
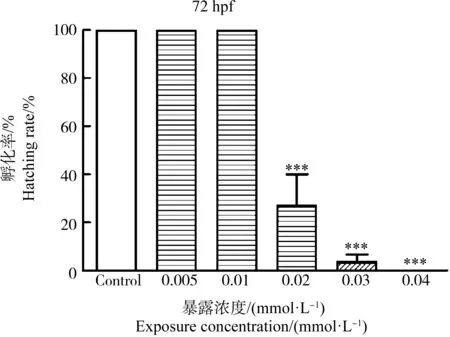
图2 不同浓度HHCB暴露对斑马鱼胚胎(幼鱼)孵化率的影响注:星号(*)表示HHCB实验组与对照组之间有显著差异(***P<0.001;n=10)。Fig. 2 Effect of HHCB treatment on hatching rate of zebrafish embryos (larvae)Note: The asterisk (*) indicates significant difference between the HHCB experimental groups and the control group (***P<0.001; n=10).
2.3 佳乐麝香对斑马鱼胚胎(或幼鱼)心率的影响
在48 hpf和72 hpf时,分别统计对照组与0.005、0.01、0.02、0.03和0.04 mmol·L-1(1.292、2.584、5.168、7.752和10.336 mg·L-1)HHCB实验组斑马鱼胚胎(或幼鱼)的心率(times·min-1)。结果显示,随着HHCB暴露浓度的增加,HHCB实验组的心率呈浓度依赖性降低(图3)。在48 hpf时,0.01~0.04 mmol·L-1HHCB实验组斑马鱼心率显著降低了33.14%~62.73% (P<0.001) (图3(a))。在72 hpf时,0.01 mmol·L-1(2.584 mg·L-1) HHCB实验组斑马鱼心率与对照组相比有显著差异(P<0.05),0.02、0.03和0.04 mmol·L-1(5.168、7.752和10.336 mg·L-1) HHCB实验组斑马鱼心率显著降低了44.28%、26.20%和16.87%(P<0.001) (图3(b))。
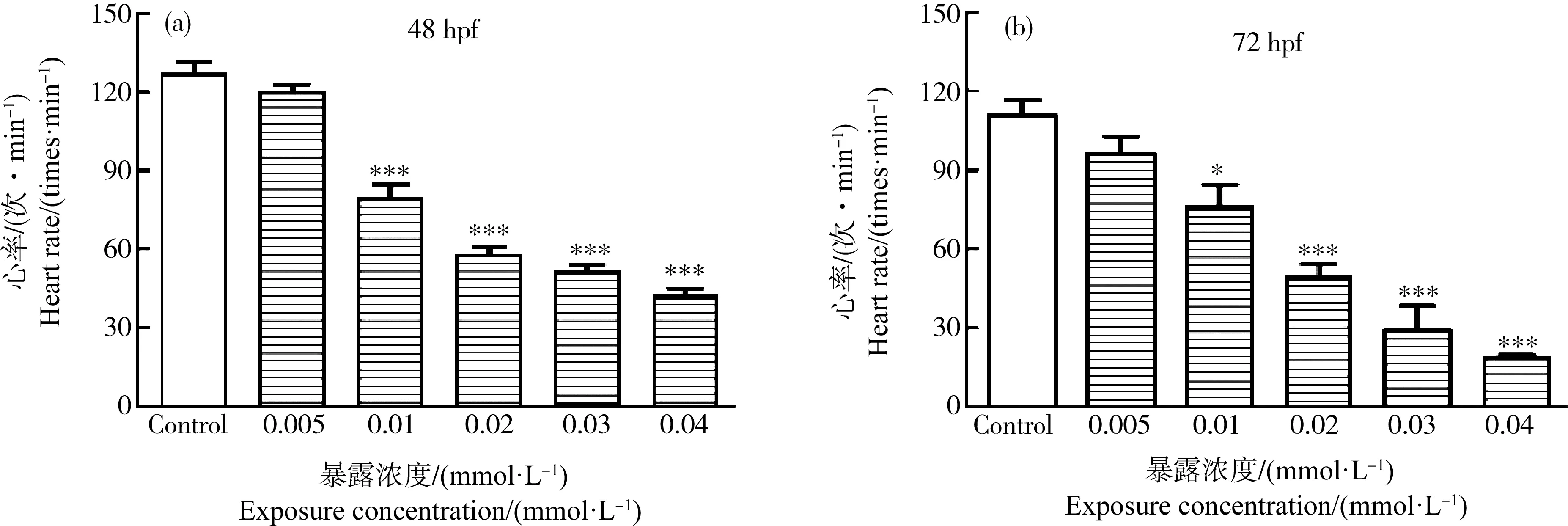
图3 不同浓度HHCB暴露对斑马鱼胚胎(幼鱼)心率的影响注:星号(*)表示HHCB实验组与对照组之间的显著差异(* P<0.05,***P<0.001;n=10)。Fig. 3 Effect of HHCB treatment on heart rate of zebrafish embryos (larvae)Note: The asterisk (*) indicates significant difference between the HHCB experimental groups and the control group (* P<0.05, ***P<0.001; n=10).
2.4 佳乐麝香对斑马鱼心囊面积的影响
在72 hpf和96 hpf时,对斑马鱼幼鱼心囊进行拍摄(图4(a)~(d)),定量分析每个处理组斑马鱼的心囊面积。在72 hpf时,与对照组相比,0.02、0.03和0.04 mmol·L-1(5.168、7.752和10.336 mg·L-1)HHCB实验组斑马鱼幼鱼的心囊面积显著增加了1.96倍、2.26倍和2.14倍(P<0.001) (图4(e))。在96 hpf时,0.02 mmol·L-1和0.03 mmol·L-1(5.168 mg·L-1和7.752 mg·L-1) HHCB实验组斑马鱼幼鱼的心囊面积显著增加了3.17倍和3.02倍(P<0.001),0.04 mmol·L-1(10.336 mg·L-1)HHCB实验组斑马鱼幼鱼的心囊面积是对照组的2.22倍(P<0.05) (图4(f))。
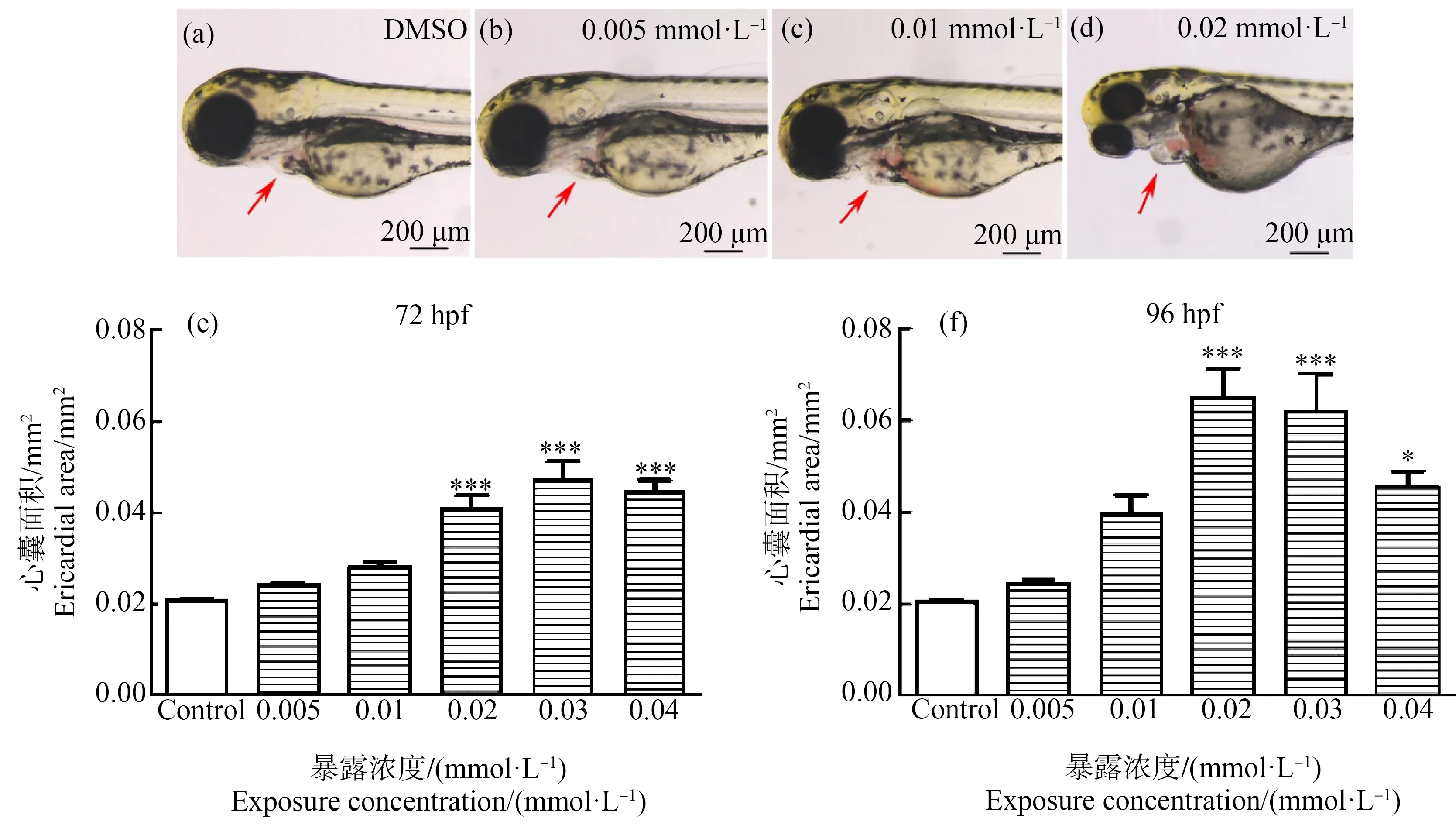
图4 不同浓度的HHCB暴露对斑马鱼胚胎(幼鱼)心囊的影响注:(a) 72 hpf二甲基亚砜(DMSO)溶剂对照组;(b) 72 hpf 0.005 mmol·L-1 HHCB组;(c) 72 hpf 0.01 mmol·L-1 HHCB组;(d) 72 hpf 0.02 mmol·L-1 HHCB组;(e) 72 hpf;(f) 96 hpf;星号(*)表示HHCB实验组与对照组之间的显著差异(* P<0.05,***P<0.001;n=10)。Fig. 4 Effects of HHCB treatment on the pericardial cavity in zebrafish embryos (larvae)Note: (a) 72 hpf dimethylsulfoxide (DMSO) solvent control; (b) 72 hpf 0.005 mmol·L-1 HHCB; (c) 72 hpf 0.01 mmol·L-1 HHCB; (d) 72 hpf 0.02 mmol·L-1 HHCB; (e) 72 hpf; (f) 96 hpf; the asterisk (*) indicates significant difference between the HHCB experimental groups and the control group (* P<0.05, ***P<0.001; n=10).
2.5 佳乐麝香对斑马鱼甲状腺激素关联基因的影响
甲状腺激素可影响鱼类的孵化及心脏的跳动。笔者定量分析了甲状腺激素相关基因的表达(图5),即甲状腺激素受体α(Thrα)、甲状腺激素受体β(Thrβ)、2型酪氨酸脱碘酶(Dio2)和3型酪氨酸脱碘酶(Dio3)。
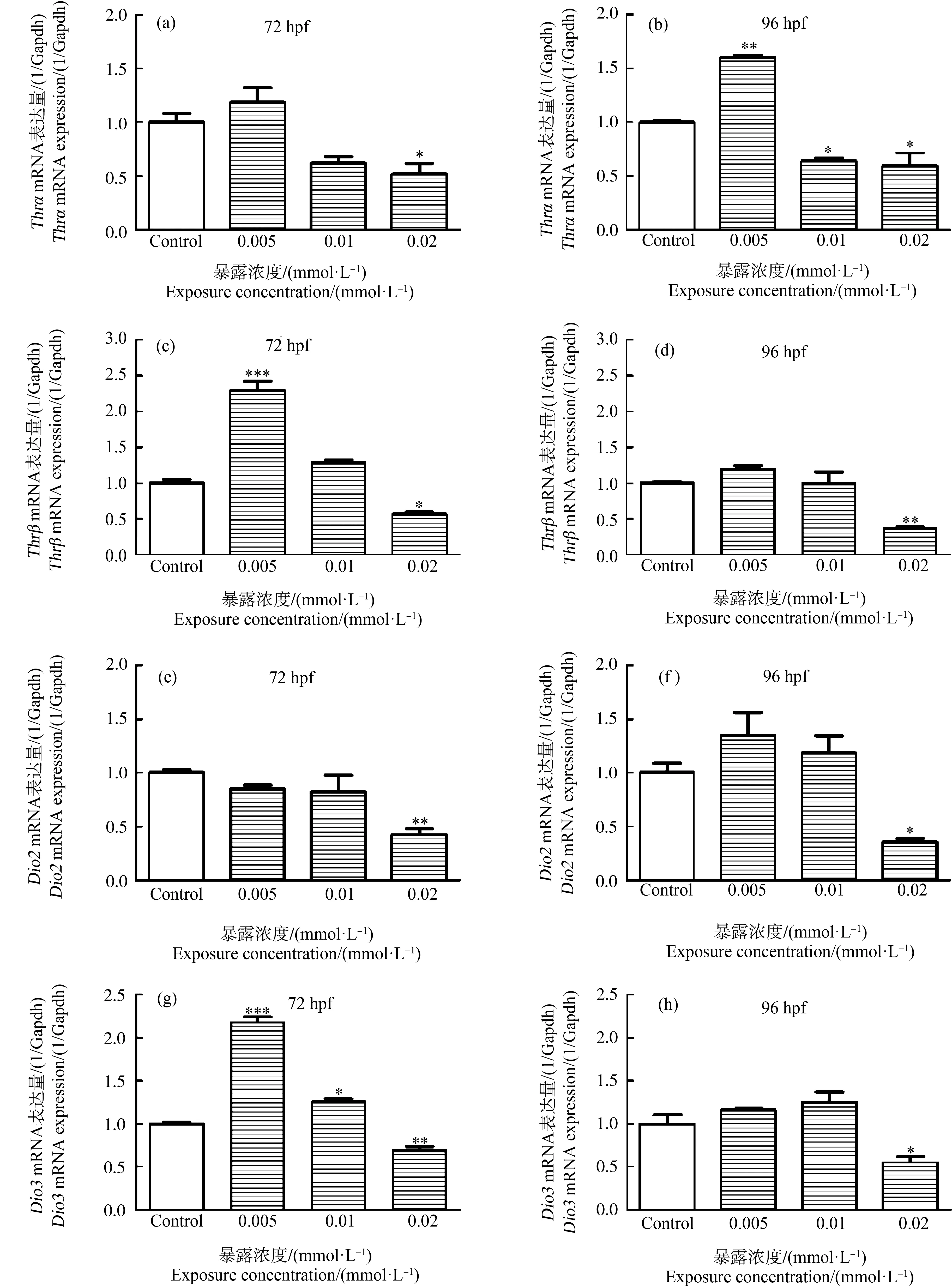
图5 不同浓度HHCB暴露对斑马鱼胚胎(幼鱼)甲状腺激素相关基因的影响注:星号(*)表示HHCB实验组与对照组之间的显著差异(* P<0.05,**P<0.01,***P<0.001;n=10)。Fig. 5 Effects of different HHCB treatment on the thyroid-related gene expressions of zebrafish embryos (larvae)Note: The asterisk (*) indicates significant difference between the HHCB experimental groups and the control group (* P<0.05,**P<0.01, ***P<0.001; n=10).
HHCB暴露显著影响斑马鱼胚胎Thrα和ThrβmRNA的表达量。在72 hpf时,0.005、0.01和0.02 mmol·L-1(1.292、2.584和5.168 mg·L-1) HHCB实验组ThrαmRNA表达量分别是对照组的118.43%、62.15%和52.31%,0.02 mmol·L-1(5.168 mg·L-1) HHCB实验组ThrαmRNA表达量显著低于对照组(P<0.05) (图5(a))。在96 hpf时,0.005、0.01和0.02 mmol·L-1(1.292、2.584和5.168 mg·L-1) HHCB实验组ThrαmRNA表达量分别是对照组的160.93%、63.94%和59.21%,0.005 mmol·L-1(1.292 mg·L-1) HHCB实验组显著高于对照组(P<0.01),0.01 mmol·L-1和0.02 mmol·L-1(2.584 mg·L-1和5.168 mg·L-1)HHCB实验组显著低于对照组(P<0.05) (图5(b))。与Thrα类似,在72 hpf时,0.005、0.01和0.02 mmol·L-1(1.292、2.584和5.168 mg·L-1)组ThrβmRNA表达量分别是对照组的229.99%、128.85%和56.69%,0.005 mmol·L-1HHCB实验组显著高于对照组(P<0.001),0.02 mmol·L-1(5.168 mg·L-1) HHCB实验组显著低于对照组(P<0.05) (图5(c))。在96 hpf时,0.005、0.01和0.02 mmol·L-1(1.292、2.584和5.168 mg·L-1)组ThrβmRNA表达量分别是对照组的119.34%、99.70%和37.28%,0.02 mmol·L-1(5.168 mg·L-1) HHCB实验组显著低于对照组(P<0.01) (图5(d))。
HHCB暴露对Dio2和Dio3 mRNA表达量的影响呈现下降趋势。在72 hpf和96 hpf时,0.02 mmol·L-1(5.168 mg·L-1)组Dio2 mRNA表达量分别是对照组的42.83%(P<0.01)和35.64%(P<0.05),显著低于对照组(图5(e)和图5(f))。Dio3 mRNA表达在72 hpf时,0.005、0.01和0.02 mmol·L-1(1.292、2.584和5.168 mg·L-1)组Dio3 mRNA表达量与对照组相比差异显著,Dio3 mRNA表达量分别是对照组的218.11%(P<0.001)、125.44%(P<0.05)和69.09%(P<0.01) (图5(g))。在96 hpf时,0.005 mmol·L-1和0.01 mmol·L-1(1.292 mg·L-1和2.584 mg·L-1)组ThrβmRNA表达量与对照组相比差异不显著(P>0.05),0.02 mmol·L-1(5.168 mg·L-1)组ThrβmRNA表达量是对照组的55.82%(P<0.05) (图5(h))。
2.6 佳乐麝香对斑马鱼三碘甲状腺原氨酸(T3)和四碘甲状腺原氨酸(T4)的影响
HHCB暴露影响72 hpf斑马鱼体内总T3(TT3)和总T4(TT4)的含量如图6所示。0.005 mmol·L-1(1.292 mg·L-1) HHCB处理组TT3含量与对照组比差异显著(P<0.001),0.01 mmol·L-1和0.02 mmol·L-1(2.584 mg·L-1和5.168 mg·L-1) HHCB实验组TT3含量与对照组无显著差异(P>0.05) (图6(a))。与TT3含量相比,HHCB实验组的TT4含量与对照组相比均显著降低(P<0.001),0.005、0.01和0.02 mmol·L-1(1.292、2.584和5.168 mg·L-1) HHCB实验组TT4含量分别是对照组的77.69%、93.00%和87.67%(P<0.001) (图6(b))。
3 讨论(Discussion)
护理品中含有大量的HHCB类物质,使用后通常会被排入到自然环境中,难以自然降解[33]。包括HHCB在内的PMs,对水生生物的早期发育均造成严重的毒性影响[34-36]。本研究发现,低于环境浓度的HHCB对斑马鱼胚胎早期生长发育产生了严重影响,并造成甲状腺激素关联基因Thrα、Thrβ、Dio2和Dio3表达的变化,导致甲状腺激素(TT3和TT4)含量变化,影响斑马鱼幼鱼心率和心囊浮肿。
低浓度HHCB暴露对斑马鱼幼鱼的生长发育具有显著的急性毒性效应,这与Yamauchi等[37]报道相似,HHCB对青鳉鱼早期生命阶段具有显著的急性毒性效应。随着HHCB浓度的增加,斑马鱼胚胎的死亡率逐渐升高,且72 hpf的孵化率由0.01 mmol·L-1(2.584 mg·L-1) HHCB实验组的100%降低到0.04 mmol·L-1(10.336 mg·L-1) HHCB实验组的0%,都表现出显著的浓度依存性。另外,HHCB对斑马鱼心脏的影响也非常突出,随着HHCB暴露浓度的增加,心率呈规律性降低。斑马鱼的胚胎孵化和心脏发育都受到甲状腺素的影响[38],通过甲状腺素的相关实验也发现了类似结果。
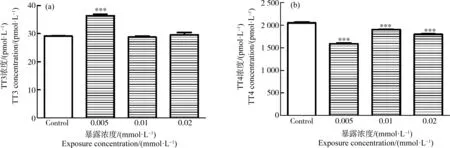
图6 不同浓度HHCB暴露对斑马鱼胚胎(幼鱼)总三碘甲状腺原氨酸(TT3)和总四碘甲状腺原氨酸(TT4)含量的影响注:星号(*)表示HHCB实验组与对照组之间的显著差异(***P<0.001;n=10)。Fig. 6 Effects of different concentrations of HHCB treatments on total triiodothyronine (TT3) and total thyroxine (TT4) content in zebrafish embryos (larvae)Note: The asterisk (*) indicates significant difference between the HHCB experimental groups and the control group (***P<0.001; n=10).
甲状腺的分泌调节会影响心脏的功能,甲状腺功能减退会导致左心室舒张期舒张速率降低、心率降低和心脏收缩受损[39-41],这与HHCB影响甲状腺激素关联基因表达量变化相关,也与导致心率下降的结果相吻合。为了进一步探究甲状腺激素关联基因与甲状腺素之间的关联,本文检测了72 hpf斑马鱼TT4和TT3的含量。低浓度的HHCB(0.005 mmol·L-1、1.292 mg·L-1)暴露致使TT3显著升高。但研究结果显示,Dio3 mRNA表达量也显著升高。这可能与机体的反馈调节有关。Dio3参与T3的转化灭活,让T3达到正常水平[16]。高浓度的HHCB(0.01 mmol·L-1(2.584 mg·L-1)以上)暴露没有引起T3的升高,与TT4含量的降低和Dio2表达的低下有直接关联。同时Thrα和Thrβ所有关联基因表达的降低,说明HHCB造成了甲状腺激素调节紊乱。在72 hpf,T4在斑马鱼体内开始产生,Dio2催化T4转换为极强生物活性的T3[16],而Dio2 mRNA表达量下降会造成斑马鱼孵化率的降低,发育迟缓,通过脱碘酶的基因敲低也证明了这一点[42]。
综上所述,环境浓度的HHCB可造成斑马鱼胚胎甲状腺激素分泌和调节紊乱。实验证实斑马鱼胚胎可用于环境污染物的高通量监测,为确定污染物环境质量标准提供数据。
