水稻抽穗期基因OsDof6 功能的初步研究
2020-09-17张立成李懿星王天抗邱牡丹宋书锋董皓李磊刘建丰李莉
张立成 李懿星 王天抗 邱牡丹 宋书锋 董皓, 李磊 刘建丰 李莉,
(1 湖南农业大学 农学院, 长沙 410128;2 杂交水稻国家重点实验室 湖南杂交水稻研究中心, 长沙 410125;3 湖南大学研究生院 隆平分院, 长沙410125;*通信联系人, E-mail: lili@hhrrc.ac.cn; liujf501@aliyun.com)
抽穗期是水稻最重要的农艺性状之一,与产量密切相关,由主效和微效QTL/基因共同控制。近年来国内外许多科学家对水稻抽穗开花机制进行了大量深入的研究。
Dof(DNA binding with one finger)是一类植物特有的转录因子,它属于锌指蛋白超家族(zinc finger super-family),一般由200~400 个氨基酸组成[1-2],其N 末端含有由4 个Cys 残基与Zn2+共价结合形成的单锌指保守DNA 结合域,其C 末端含转录调控结构域[3]。N 末端的Dof 结构域由52 个氨基酸组成且含有保守的C2-C2型单锌指结构域[4]。Zn2+和Cys 残基是维持Dof 蛋白功能所必需的,对二者的替换或破坏都会使Dof 蛋白的活性丧失[5]。Dof 结构域中的单锌指及锌指旁边C 侧链状结构中某些特定氨基酸均能与DNA 结合,这种DNA 与蛋白质双功能结合活性,使Dof 蛋白可以调控多种基因的表达[6]。Dof 蛋白在植物生长发育过程中参与了激素响应、贮藏蛋白表达和光周期响应等生物学过程。如烟草的Dof 蛋白NtBBF1 可调节受生长素诱导表达的植物癌基因rolB的表达[7];水稻中的Dof 蛋白RPBF 可与RISBZ1 相互作用调节胚乳特异性贮藏蛋白[8],OsDof12过量表达植株在长日条件下能够通过上调表达Hd3a和OsMADS14基因来缩短水稻抽穗时间[9]。拟南芥中的AtDof5.1可以调节叶片的轴向卷曲[10];OBP1在水杨酸和氧化胁迫下调控植物防御基因表达[11];OBP3通过调节光敏色素与隐花素来影响植物发育过程中的光形态[12]。
Yanagisawa 等[13]在玉米中鉴定了第一个Dof蛋白MNB1 后,Dof 家族进入研究者的视界,目前在拟南芥和水稻基因组中共预测存在36 个和30 个Dof基因[14],在小麦、大麦和大豆中分别预测存在31、26、28 个[15-17]。Dof 家族广泛存在于整个植物界[18],但其中大部分基因的功能尚未明晰。
我们前期通过穗发育芯片筛选到大量可能与穗发育相关的基因,本研究选取其中的OsDof6,采用反向遗传学的方法,利用CRISPR/Cas9 技术对该基因进行定点敲除,期望通过对突变体性状进行观察来获得该基因功能,并通过烟草瞬时表达与实时定量PCR 等方式获得该基因的表达模式,为深入了解该基因所参与的生命进程奠定基础。
1 材料与方法
1.1 实验材料
实验所用粳稻品种9522(武运粳7 号),所用大肠杆菌菌株DH5α、农杆菌菌株EHA105 均保存于杂交水稻国家重点实验室;CRISPR/Cas9 载体系统由华南农业大学刘耀光课题组提供。将T1突变体和9522 野生型种植于湖南省长沙市湖南杂交水稻研究中心试验基地,种植密度为16 cm×20 cm,每行8 株,每个群体种植3 行,2019 年6 月5 日播种,6 月25 日移秧,常规大田管理。
1.2 生物信息学分析及进化树构建
在TIGR(http://rice.plantbiology.msu.edu/)数据库中检索OsDof6,获得该基因的基因组、CDS、ATG 上游1500 bp 启动子序列及蛋白序列。将该基因蛋白序列输入 SMART ( http://smart.emblheidelberg.de/)获得该蛋白的预测结构,将启动子序列输入至PlantCARE ( http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),获得该启动子中可能的调控元件,在 PlantTFDB (Plant Transcription Factor Database, planttfdb.cbi.pku.edu.cn)数据库中检索Dof,并根据周淑芬[19]、纪剑辉等[20]的研究,确定了30 个Dof 家族成员的基因,利用ClustalX 软件对这30 个基因的序列进行多重序列比较,制作水稻Dof 家族进化树。
1.3 基因组织表达分析
利用TRIZOL,分别提取水稻根、茎、叶、穗(穗长1~2 mm、5~10 mm、15~50 mm、50~100 mm、穗变绿及即将抽穗等6 个时期)各个部位的总RNA,逆转录cDNA,利用在线工具(http://www.oligoarchitect.com/LoginServlet)设计OsDof6的qPCR 引物qPCR-Dof6-F 和qPCR-Dof6-R(表1),以各个部位cDNA 为模板,以Ubq(Os03g13170)为内参,对OsDof6各个时期的表达水平进行检测。
1.4 OsDof6 亚细胞定位载体构建及烟草瞬时表达
利用同源重组的方式,设计引物1300-Dof6-F和1305-Dof6-R(表1)扩增OsDof6去掉终止密码子的CDS 序列并连接到pCAMBIA1305 载体上,获得1305-Dof6-GFP 表达载体,将该表达载体转入大肠杆菌涂板,挑取单菌落进行PCR 并测序,选择测序结果正确的表达载体转化入农杆菌中,将含有1305-Dof6-GFP 载体、1305-GFP 载体和p19 载体的农杆菌单克隆摇菌过夜,次日取出,4 000 r/min 下离心10 min,调OD 值至0.6 左右,加入1/50 体积0.5 mol/L MES(pH=5.6)和1/500 体积的0.1 mol/L乙酰丁香酮,混匀后室温静置3 h。将含有表达载体的农杆菌菌液和p19 农杆菌菌液按照1∶1 体积比混合,从烟草叶片背轴面注射,避光培养36~48 h,取叶片在激光共聚焦显微镜下观察荧光信号。
1.5 CRISPR/Cas9 特异性靶点选择及载体构建
将OsDof6的基因序列输入E-CRISP (www.ecrisp.org)靶标位点设计网站中,对PAM 及5′端碱基要求选择medium 选项,选择靠近起始密码子或保守结构域处NGG 上游20 bp 序列,将所有结果通过NCBI 进行BLAST,选择特异性较强的一个,即CCGGTACAAGCAGGGCGCCGAGG,靶位点标记为T1,设计靶位点引物Dof6-U3-F 和Dof6-U3-R。载体构建、鉴定与农杆菌转化参考邓尧的方法[21]。

表1 引物序列Table 1.Primer sequence.
1.6 农杆菌介导水稻愈伤组织转化及转基因阳性植株基因型检测
将成熟的9522 种子置于诱导培养基上诱导形成愈伤组织,用上一步的农杆菌菌液侵染愈伤组织,置于共培培养基20℃下暗培养3 d,之后将共培养后的愈伤组织用无菌水冲洗3~5 次,置于含潮霉素、头孢噻肟钠和氨苄青霉素筛选培养基上暗培养2 周后更换新的筛选培养基暗培养2 周,再经过分化培养、生根培养后,得到幼苗植株。将植株移入大田种植,提取T0代转基因植株叶片基因组DNA。以该 DNA 为模板,用检测引物 JC-Dof6-F 和JC-Dof6-R(表1)进行PCR 扩增,产物大小为491 bp。将PCR 产物送测序公司测序,Chromas 读取测序峰图,利用NCBI 网站BLAST 工具对序列进行对比,分析T0转基因植株靶位点序列变化。
1.7 OsDof6突变体表型鉴定
参考赵金成[22]的方法,从见穗日起至齐穗为止,每天9:00-10:00 调查T1株系内所有植株的抽穗情况,主穗穗顶端伸出剑叶1 cm 记该单株抽穗,株系内50%单株抽穗为整个株系抽穗期,80%单株抽穗为齐穗期,同时统计株系内所有单株抽穗水平绘制抽穗动态图。此外,调查突变体与对照的株高、分蘖数、穗长、每穗粒数、结实率、千粒重等。用DPS 7.5 数据处理系统对产量性状等进行方差分析。
1.8 抽穗期相关基因差异表达分析
提取突变体与野生型穗发育初期叶片总RNA,利用实时荧光定量PCR 的方法,检测抽穗期相关基因的表达量(引物见表1),分析这些基因在突变体与野生型中的表达水平差异。
2 结果与分析
2.1 OsDof6生物信息学特征
OsDof6位于水稻第1 染色体上,该基因全长993 bp,CDS 总长963 bp,含有1 个外显子,编码一个含有320 个氨基酸的蛋白(图1-A)。利用PlantCARE 在线工具对该基因起始密码子上游1.5 kb 启动子序列进行预测分析,发现该基因的启动子中包含大量的光响应元件,茉莉酸甲酯、赤霉素等植物激素响应元件,植物组织表达相关元件及逆境响应元件(表2)。表明该基因可能参与了植物光周期、激素调节、组织发育等相关生物学过程。利用SMART 对该基因的功能结构域进行预测,发现在其22~80 aa 处存在一个zf-Dof 保守结构域(图1-B)。
高度保守的C2-C2 类型锌指结构是植物Dof 转录因子家族的核心结构域。此外,在不同Dof 亚家族中,除C2-C2 类型锌指结构域外,还存在一些相对保守的基序,然而序列的保守性在一定程度上能够反映其在功能上的相似性[23]。为了预测OsDof6的功能,从PlantTFDB 上检索了30 个水稻Dof 家族的候选基因,进一步对其氨基酸序列进行多重对比,构建出水稻Dof 家族的系统进化树,发现OsDof6与OsDof20处于同一分支(图1-C),对OsDof20的表达模式进行预测,发现该基因主要在花药及颖壳的发育过程中表达。OsDof20的具体功能及其与OsDof6的关系有待进一步研究。
2.2 OsDof6的表达模式及编码蛋白的亚细胞定位
利用RiceXpro 表达数据库对OsDof6的时空表达模式进行分析。结果显示,OsDof6在叶鞘、营养生长期的根部和生殖生长期的茎部表达量较高,在内外稃发育中后期表达量最高(图2-A)。进一步利用实时定量PCR 对OsDof6在水稻根、茎、叶、穗P3 期(穗长1~2 mm)、穗P4 期(穗长5~10 mm)、穗P5 期(穗长15~50 mm)、穗P6 期(穗长50~100 mm)、穗P7 期(穗变绿)、穗P8 期(即将抽穗)等组织器官中的相对表达量进行检测,发现OsDof6属于组成型表达,在根、茎、叶和穗中均检测到转录本,然而在穗发育的P7 期和P8 期表达水平明显高于其他部位(图2-B)。

图1 OsDof6基因核苷酸序列(A)、蛋白结构(B)与家族进化分析(C)Fig.1.OsDof6 nucleotide sequence(A) and its protein structure(B) and phylogenetic analysis of OsDof family(C).
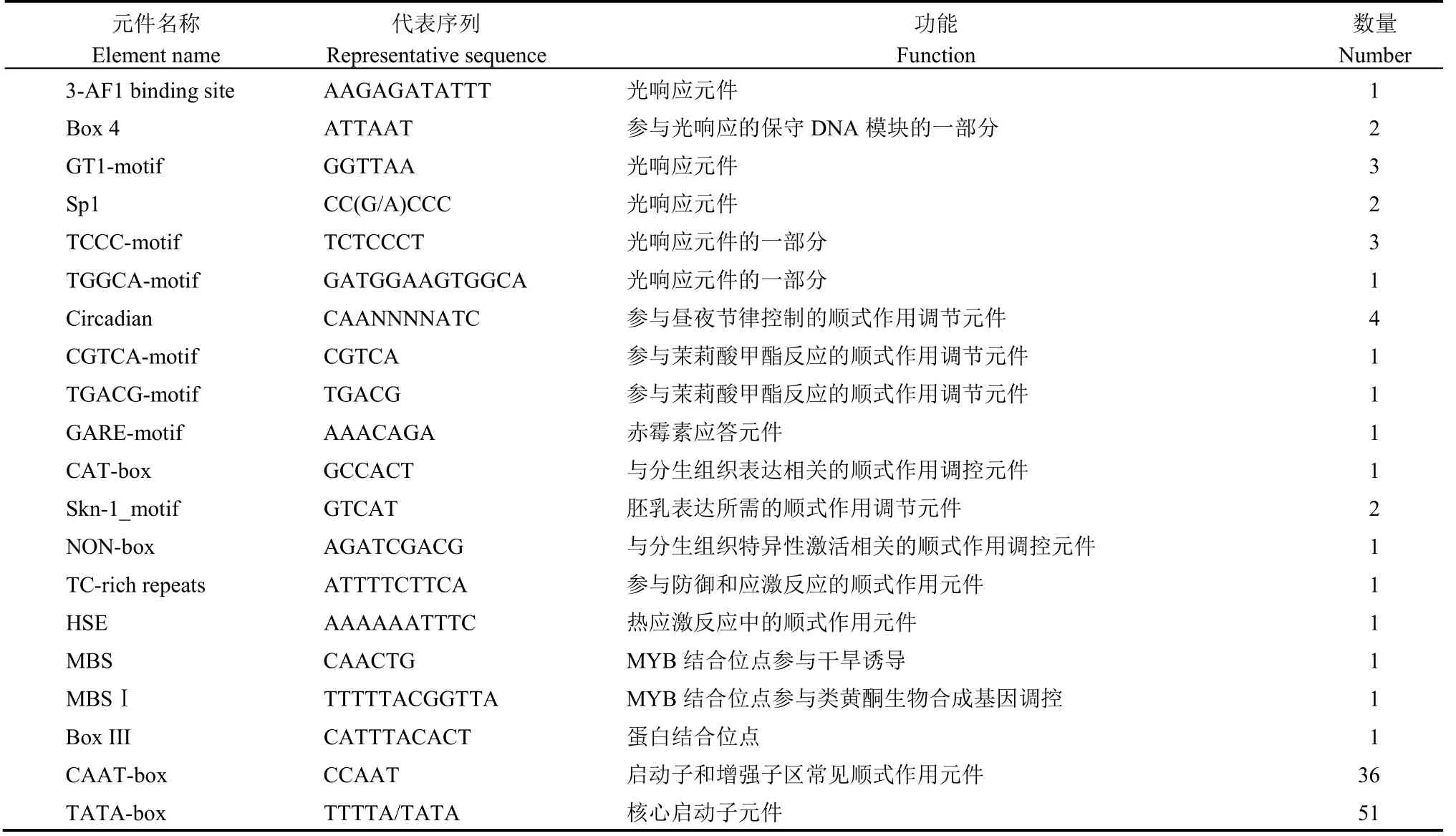
表2 OsDof6基因ATG 上游1.5 kb 启动子区域功能元件分析Table 2.Functional element analysis of the 1.5 kb promoter region upstream ofOsDof6 gene ATG.
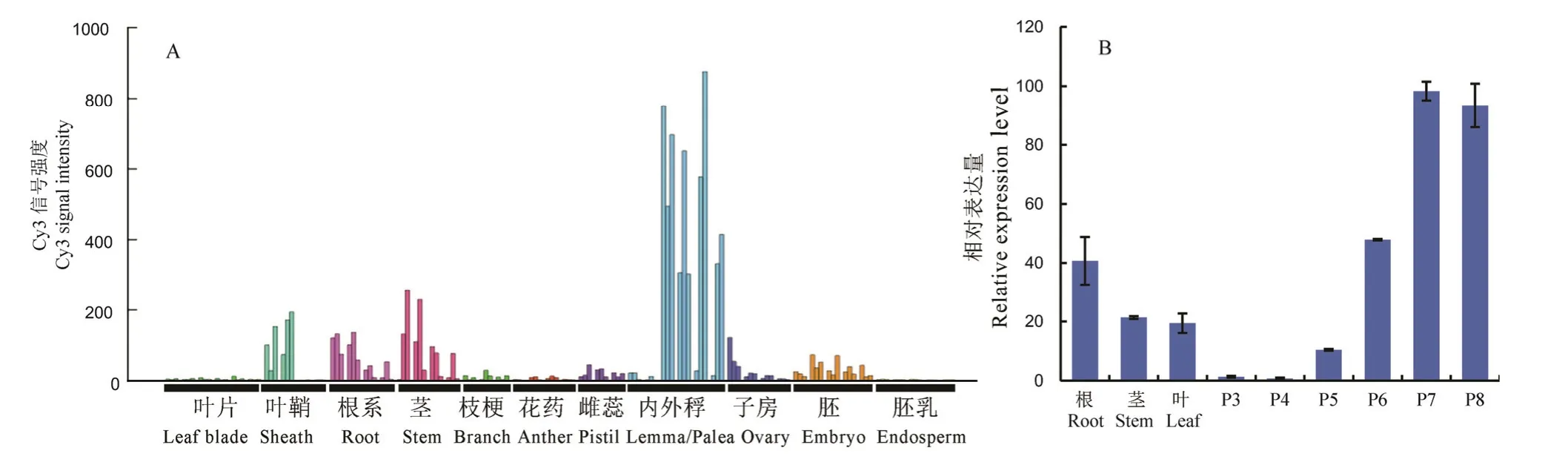
图2 OsDof6基因时空表达分析Fig.2.Temporal and spatial expression analysis ofOsDof6 gene.
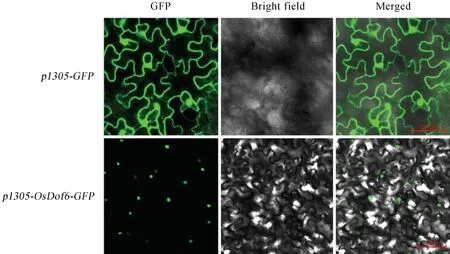
图3 OsDof6亚细胞定位结果Fig.3.Subcellular localization result ofOsDof6.
通过同源重组的方式,将OsDof6的cDNA 序列(不包含终止密码子TAA)整合到pCAMBIA1305-GFP载体上,获得pCAMBIA1305-Dof6-GFP植物融合表达载体,将植物表达载体转入农杆菌并侵染烟草叶片表皮细胞,通过激光共聚焦显微镜观察Dof6-GFP 融合蛋白的荧光信号(图3),Dof6-GFP融合蛋白主要定位在细胞核中,而在空载对照的细胞膜、细胞质和细胞核中均能检测到荧光信号。该实验结果表明,OsDof6 特异定位于细胞核中。
2.3 获得OsDof6基因突变体植株
为了进一步研究OsDof6在水稻生长发育中的功能,构建了OsDof6基因编辑载体。经过PCR 鉴定与序列比对,OsDof6的靶位点成功构建入pYLCRISPR/Cas9-MT载体中,获得了植物表达载体pYLCRISPR/Cas9-MT-Dof6(图4-A)。将该植物表达载体转入农杆菌菌株,通过农杆菌介导转化水稻9522 愈伤组织并鉴定,共获得4 株阳性转基因植株9522Dof6-1、9522Dof6-2、9522Dof6-3和9522Dof6-4,其中9522Dof6-2、9522Dof6-3和9522Dof6-4在靶位点处出现突变,9522Dof6-1未发生突变。9522Dof6-2和9522Dof6-3具有相同的突变类型,该突变使得原基因序列的第62~69 bp 共8 个碱基缺失,直接导致阅读框移码致使翻译提前终止,破坏了Dof 蛋白的结构,形成了一个与Dof蛋白完全不同的108 aa的蛋白(图4-D)。9522Dof6-4使得原基因序列第11~313 bp 共303 个碱基丢失,即氨基酸序列第4~104 aa 共100 个氨基酸缺失,该突变使Dof 保守结构域完全缺失。
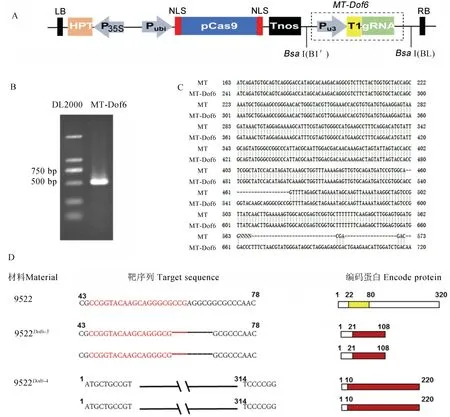
图4 OsDof6基因编辑载体构建与突变体突变类型分析Fig.4.Construction ofOsDof6 gene editing vector and analysis of mutation types of mutants.
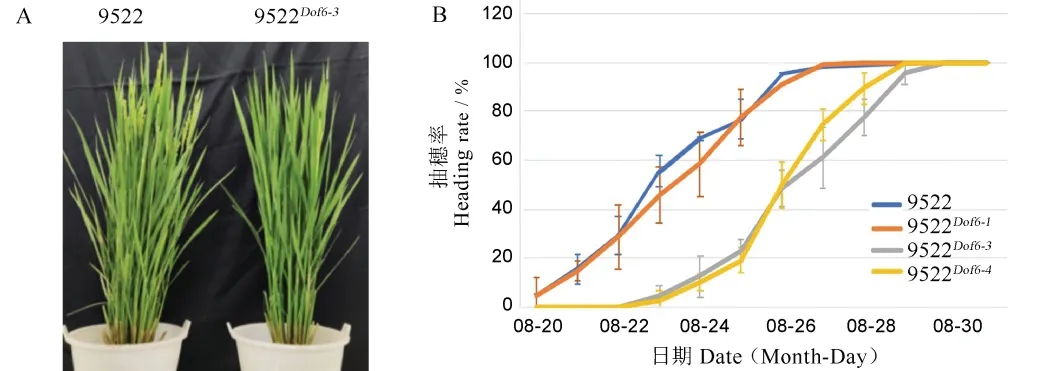
图5 野生型9522 与Dof6 突变体的表型比较Fig.5.Phenotypic comparison between the wild type 9522 and theDof6 gene-knock-out mutant.
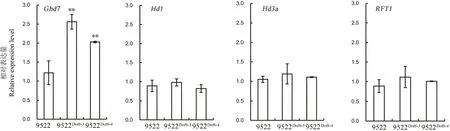
图6 抽穗期主要调控基因差异表达分析Fig.6.Analysis of expression levels of main genes for heading date.
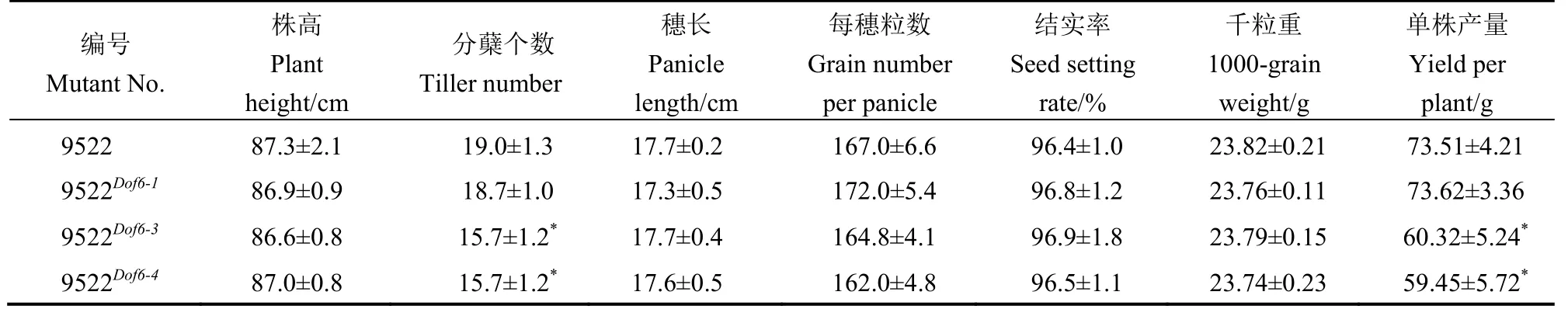
表3 突变体与对照的产量性状调查Table 3.Investigation of yield traits in mutants and controls.
2.4 OsDof6突变体延迟抽穗
对9522Dof6-1(阴性对照)、9522Dof6-3、9522Dof6-4和9522 野生型的抽穗动态调查结果显示,9522 野生型和9522Dof6-18 月20 日始穗,8 月24 日进入抽穗期,8 月26 日齐穗,播始历期为77 d,而突变体9522Dof6-3和9522Dof6-48 月23 日始穗,8 月27 日进入抽穗期,8 月29 日齐穗(图5-A,见上页),播始历期为80 d。突变体材料进入抽穗期的时间与野生型和阴性对照相比平均推迟3 d 左右(图5-B)。但在抽穗历期与抽穗速度上无显著变化。对突变体与野生型9522 和阴性对照9522Dof6-1的产量性状调查发现,突变体的平均分蘖数为15.70 和15.75 个,显著低于阳性对照9522 野生型的19.0 个和阴性对照9522Dof6-1的18.7 个,而突变体与野生型在株高、穗长、每穗粒数、结实率、千粒重等产量相关因素上无显著差异,突变体的单株产量由于分蘖数的下降而显著降低(表3)。由此可知,OsDof6的功能缺失影响到突变体材料的抽穗期、分蘖数和单株产量。
2.5 OsDof6功能缺失影响了Ghd7 的表达
为了探索OsDof6基因所参与的分子调控途径,选取了抽穗期调控网络中的几个重要的基因Hd1、Ghd7、Hd3a及RFT1。以幼穗发育初期叶片总RNA为模板,在突变体与野生型中进行了差异表达分析,结果显示,在突变体中Ghd7基因的表达量显著上调,Hd1基因的表达量没有显著变化;而成花素基因Hd3a及RFT1的表达量无显著变化(图6)。
3 讨论
抽穗期是水稻一个重要的农艺性状,它主要由品种的感温性、感光性和基本营养生长性决定[22]。目前已有大量的水稻抽穗期相关QTL被精细定位并克隆。如开花促进基因DTH3[24]、Ehd4[25],开花抑制基因Hd16[26],成花素基因Hd3a[27]和RFT1[28]等水稻Dof家族部分成员也是具有调控抽穗期的功能。其中,OsDof12基因过量表达可在长日条件下上调Hd3a和OsMADS14基因的表达从而缩短抽穗期,但其过量表达在短日条件下对抽穗期无影响[9]。OsDof4的过量表达也会导致长日条件下抽穗提前,短日条件下抽穗延迟[29]。
本研究利用CRISPR/Cas9技术,对水稻品种9522的OsDof6基因进行定点敲除,获得了两种不同突变类型的纯合功能缺失突变体。对这两份突变体材料的T1代生育期观察发现,突变体材料与野生型及阴性对照相比抽穗推迟3 d。而在产量性状中,突变体材料除分蘖数与野生型相比显著下降外,其他性状均无明显差异。并且,抽穗动态调查发现分蘖数的减少对抽穗历期与抽穗速率无显著影响。Dof家族中Dof功能结构域在不同物种间均表现出高度保守,其功能可能也存在着一定的保守。水稻Dof家族中OsDof12与OsDof4的功能均有报道为开花相关。对水稻Dof家族进行进化树分析,发现与OsDof6亲缘关系最近的成员是OsDof20。我们对其进行的时空表达模式预测结果显示其主要在花药发育与颖壳发育过程中表达,其具体功能有待进一步研究。值得注意的是,Tsuji等[30]发现成花素基因Hd3a在叶片韧皮部合成之后,除了会运输到茎尖分生组织影响水稻抽穗外,还会在腋生分生组织中积累,以促进水稻分蘖。对OsDof6的时空表达进行研究发现该基因在水稻根、茎、叶中的表达量较高,在内外稃发育后期表达量最高,与预测结果吻合。对OsDof6序列分析得知在其启动子中含有大量的光响应元件,少量组织表达元件、非生物胁迫响应元件以及激素响应元件,推测其可能具有响应光周期的功能。在抽穗期主要调控基因差异表达实验中,Ghd7基因的表达量极显著上调。Dai等[31]的研究表明,在长日照的环境下,Ghd7的表达量上升可以抑制Hd3a与RFT1的表达使水稻的抽穗期延迟,与Dof6突变体的表型一致。成花素基因Hd3a与RFT1表达量没有显著变化可能是由于抽穗期变化幅度较小、Dof家族基因功能冗余[32]所致。综上所述,OsDof6在长日条件下可能参与Ghd7-Hd1-Hd3a/RFT1通路,通过光周期调节或调节穗部发育的方式来影响抽穗期。
后续将对该突变体进行过量表达、功能互补等研究对该表型进行进一步验证。并对该基因的互作蛋白进行挖掘,以探究该基因在影响抽穗期过程中的分子机制及调控网络。
