乙型肝炎病毒HBx分子在弥漫大B细胞淋巴瘤中的表达及对细胞增殖、凋亡的影响
2020-09-16崔永哲
崔永哲
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤中的一种常见亚型[1]。临床治疗中发现,淋巴瘤患者常与肝炎病毒(Hepatitis B Virus,HBV)阳性密切相关,恶性淋巴瘤合并HBV感染仅次于肝癌[2],二者关系引起广大研究人员注意。乙型肝炎病毒X蛋白(hepatitis B virus X protein,HBx)是HBV病毒发挥作用的重要物质[3],在胞内信号转导,细胞增殖、凋亡中具有确切作用[4,5],但目前研究尚未解释HBV感染在DLBCL发生发展中的作用以及机制。本研究通过脂质体转染方式将HBx基因转入DLBCL细胞株SUDHL-4中,研究HBx对SUDHL-4细胞增殖、凋亡的影响,并初步探讨其可能机制,为DLBCL合并HBx患者治疗提供理论依据。
1 材料与方法
1.1 材料 DLBCL细胞株SUDHL-4购自上海斯信生物科技有限公司;BALB/c裸鼠[4周,体重10~15 g,饲养温度20~26℃,饲养温度40%~70%,光照周期12 h,动物许可证号:SCXK(粤)2016-0041]购自广东省医学实验动物中心;pcDNA3.1-EGFP质粒购自北京天恩泽基因科技有限公司;携HBx基因重组质粒pcDNA3.1-x为本室构建;RPMI-1640培养基、胎牛血清、胰蛋白酶购自江苏凯基生物技术股份有限公司;Trizol提取试剂盒、Lipofectamine 3000相关试剂购自Invitrogen公司;CCK-8实验相关试剂购自美国Promega公司;AnnexinV-FITC细胞凋亡检测试剂盒购自瑞士Roche公司。
1.2 方法
1.2.1 细胞培养:将SUDHL-4细胞冻存管取出,放入37℃水浴锅快速解冻,置于装有3 ml 10%胎牛血清的RPMI-1640培养基中离心管,离心后弃上清,加入1 ml 10%胎牛血清的RPMI-1640培养基,吹打混匀吸入无菌培养瓶,加入4 ml培养基混匀,置于环境为37℃、体积分数为5% CO2的恒温培养箱中,按照实验室方法传代培养。收集对数期细胞进行后续试验。
1.2.2 稳定转染SUDHL-4细胞及分组:采用Lipofec-tamin 3000试剂进行转染,使用Opti-MEM无血清培养基稀释pcDNA3.1质粒、pcDNA3.1-HBx重组质粒,并与Lipofectamin 3000按1∶1比例混合后室温孵育10 min,静置20 min,加入培养孔,放置于37℃、5%CO2培养箱中培养6 h,更换为含10% 胎牛血清的完全培养基,培养24 h后,置于倒置荧光显微镜下观察转染效率,更换为含G418(终浓度为400 μg/ml)的培养液继续培养细胞,每隔3 d更换培养液,筛选稳定转染细胞株,以含G418(终浓度为200 μg/ml)的培养液维持培养。转入pcDNA3.1-HBx重组质粒的SUDHL-4细胞为SUDHL-4-HBx组,转入pcDNA3.1质粒的SUDHL-4细胞为SUDHL-4-con组,设置未转染的SUDHL-4细胞为对照组。
1.2.3 qRT-PCR法检测HBx表达:采用RNA抽提试剂盒提取1.2.2各组细胞总RNA,应用Bio Rad逆转录试剂盒逆转录为cDNA,灭活逆转录酶活性,用去离子水将cDNA稀释10倍后-20℃保存。qRT-PCR程序设定为:95℃预热3 min,95℃ 30 s,60℃ 30 s,72℃ 15 s,以上3步骤经历35次循环,72℃ 5 min终止反应。HBx上游引物为5’-TCATCGCCAGCATCATCAAAC-3’,下游引物为5’-ATGTACGGCTGGAGGTCTGTCA-3’,扩增长度为463 bp。以GAPDH为内参基因,上游引物为5’-ATTGGAACGATACAGAGAAGATT-3’,下游引物为5’-GGAACGCTTCACGAATTTG-3’。
1.2.4 免疫印迹法(western blotting,WB)法检测蛋白表达:取1.2.2中各组细胞,加入300 μl蛋白裂解buffer(含1 mmol/L PMSF),提取总蛋白,通过BCA试剂盒检测蛋白浓度,以GAPDH为内参,采用WB法检测各组组织中HBx蛋白水平进行检测,Tanon 600图像分析系统拍照并进行定量分析。做3次重复,取平均值。
1.2.5 CCK-8法检测细胞增殖能力:按照1.2.2分组,取对数生长期细胞放入离心管内,1 000 r/min离心5 min弃上清,加入含10%胎牛血清的RPMI 1640培养基,吹打混匀,制成细胞悬液,取10 μl细胞悬液,加入含1 ml RPMI 1640的EP管内,吹打混匀,取10 μl稀释细胞悬液,细胞计数板计数,以1.0×105个/ml细胞密度接种于12孔板,每孔100 μl,每组6个复孔。在37℃、5% CO2、饱和湿度条件下培养24、48、72、96 h 后,每孔加入10 μl浓度为1.5 mg/ml的CCK-8,继续培养4 h,读取吸光度值(A),绘制细胞生长曲线,测定时以未接种细胞只加培养基孔的A值为空白对照调零。
1.2.6 皮下移植瘤法检测细胞增殖能力:选取四周龄雄性BALB/c裸鼠,喂养无菌水与食物。将约2×106个细胞(SUDHL-4)注入裸鼠右侧背部,出现明显肿瘤时,随机分为3组,每组10只,裸鼠瘤内分别注射100 μl RPMI-1640培养基、pcDNA3.1空载体、pcDNA3.1-HBx重组质粒,30 d后处死小鼠,摘除肿瘤计算肿瘤体积,肿瘤体积=长×宽2×1/2。
1.2.7 双染流式细胞术检测细胞凋亡能力:使用AnnexinV-FITC细胞凋亡检测试剂盒及流式细胞仪检测细胞凋亡情况。3组细胞缺氧培养48 h,胰酶消化收集细胞,预冷PBS洗涤2次,离心弃上清液,配制成1×106个/ml的细胞悬液,100 μl细胞悬液加入5 μl AnnexinV-FITC和5 μl PI混匀,室温避光孵育15 min,流式细胞仪检测凋亡率。实验重复3次。

2 结果
2.1 转染效率检测情况 荧光显微下SUDHL-4-HBx组、SUDHL-4-con组中细胞转染效率均>90%。与对照组比较,SUDHL-4-con组HBx mRNA、HBx蛋白差异无统计学意义(P>0.05),SUDHL-4-HBx组HBx mRNA、HBx蛋白表达显著升高(P<0.05);与SUDHL-4-con组比较,SUDHL-4-HBx组HBx mRNA、HBx蛋白表达显著升高,差异有统计学意义(P<0.05)。见图1、2,表1。
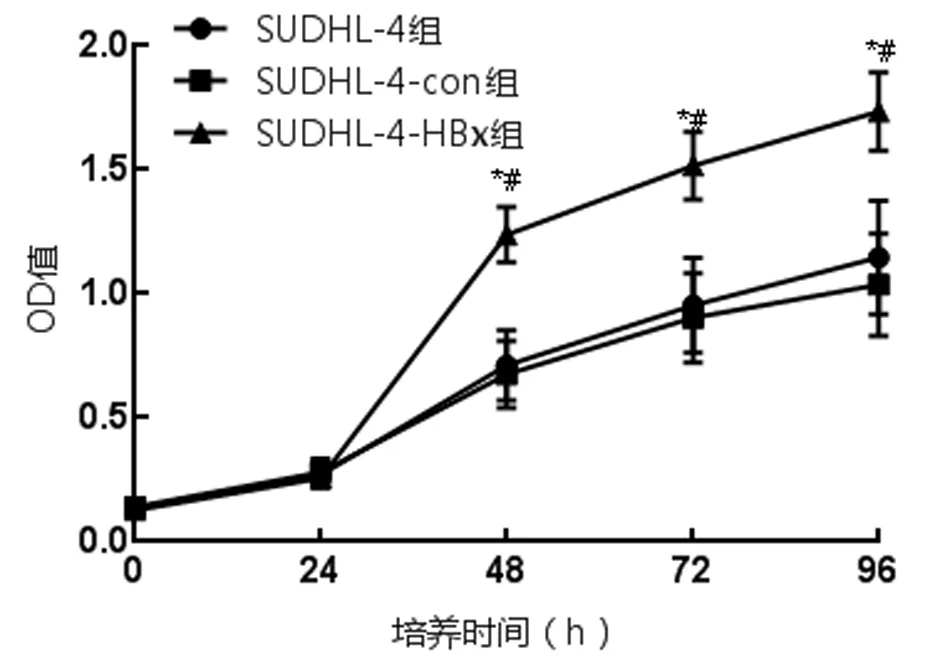
2.2 稳定表达HBx对SUDHL-4细胞增殖影响 CCK8试验显示,与空白组相比,SUDHL-4-con组各时间点OD值差异无统计学意义(P>0.05),SUDHL-4-HBx组转染后48、72、96 h OD值显著升高(P<0.05);与SUDHL-4-con组相比,SUDHL-4-HBx组转染后48、72、96 h OD值显著升高(P<0.05)。见图3,表2。

图1 荧光显微镜下转染效率检测

HBx蛋白表达条带图

表1 转染后HBx mRNA及HBx蛋白表达情况
注:与SUDHL-4组比较,*P<0.05;与SUDHL-4-con组比较,#P<0.05

表2 稳定表达HBx对SUDHL-4细胞增殖影响(OD值)
2.3 稳定表达HBx对裸鼠移植瘤生长影响 与SUDHL-4组比较,SUDHL-4-con组裸鼠肿瘤体积差异无统计学意义(P>0.05),SUDHL-4-HBx组裸鼠肿瘤体积显著升高(P<0.05);与SUDHL-4-con组比较,SUDHL-4-HBx组裸鼠肿瘤体积显著升高(P<0.05)。见表3。
2.4 稳定表达HBx对SUDHL-4细胞凋亡影响 与SUDHL-4组比较,SUDHL-4-con组细胞凋亡率差异无统计学意义(P>0.05),SUDHL-4-HBx组细胞凋亡率
表3 稳定表达HBx对裸鼠移植瘤生长影响

表3 稳定表达HBx对裸鼠移植瘤生长影响
组别肿瘤体积SUDHL-4组 816.37±34.18SUDHL-4-con组829.71±35.29SUDHL-4-HBx组1 526.85±56.72*#
注:与SUDHL-4组比较,*P<0.05;与SUDHL-4-con组比较,#P<0.05
显著降低(P<0.05);与SUDHL-4-con组比较,SUDHL-4-HBx组细胞凋亡率显著降低(P<0.05)。见图4,表4。

图4 稳定表达HBx对SUDHL-4细胞凋亡影响

表4 稳定表达HBx对SUDHL-4细胞凋亡影响
2.5 稳定表达HBx对SUDHL-4细胞增殖、凋亡相关蛋白表达影响 与SUDHL-4组比较,SUDHL-4-con组PCNA、Bax、Bcl-2、Caspase 3蛋白水平差异无统计学意义(P>0.05),SUDHL-4-x组PCNA、Bcl-2蛋白表达显著升高(P<0.05),Bax、Caspase 3蛋白表达显著下降(P<0.05);与SUDHL-4-con组比较,SUDHL-4-x组PCNA、Bcl-2蛋白表达显著升高(P<0.05),Bax、Caspase 3蛋白表达显著下降(P<0.05)。见图5,表5。

图5 稳定表达HBx对SUDHL-4细胞增殖、凋亡相关蛋白表达影响;A代表SUDHL-4组;B代表SUDHL-4-con组;C代表SUDHL-4-HBx组

表5 稳定表达HBx对SUDHL-4细胞增殖、凋亡相关蛋白表达影响
3 讨论
DLBCL是非霍奇金淋巴瘤中常见类型,占所有病例1/3左右,临床上以高侵袭性、中高度恶化为主要特点[6,7]。恶性淋巴瘤发病机制复杂,研究显示病毒的慢性感染在淋巴瘤发生发展中发挥重要作用[8]。HBV是一种嗜肝细胞病毒,其具有较强亲淋巴细胞特性[9]。临床数据显示DLBCL患者HBV感染率显著高于健康者及其他肿瘤患者,DLBCL合并HBV发生率仅低于肝癌[9]。上述研究均表明HBV病毒感染与DLBCL的发生可能有一定相关性。而HBx是HBV病毒基因组中开放编码区,是HBV复制的关键蛋白,在细胞分化、增殖、凋亡等方面发挥重要作用[10],有研究证明,HBx可促进肝癌细胞增殖、侵袭,抑制肝癌细胞凋亡[11-13],但HBx在DLBCL细胞中研究较少,本研究重点探讨HBx对人DLBCL细胞株SUDHL-4细胞增殖、凋亡的影响,为DLBCL合并HBx患者治疗提供理论依据。
Wang等[14]研究显示,人DLBCL患者中HBV感染率高。本研究中152例DLBCL患者检测出HBV感染30例,感染率为19.7%,分析发现,合并HBV感染与患者临床分期、肝功能有关,提示HBV感染可能影响DLBCL的发生发展过程。本研究进一步构建稳定表达HBx基因的SUDHL-4细胞模型,为HBV感染和DLBCL关系研究提供基础,另一方面也可以通过SUDHL-4-HBx筛选合适治疗药物。Zhu等[15]研究表明,HBx基因具有促进肝癌细胞增殖、侵袭的作用,HBx通过灭活p53蛋白活性,抑制其调控,从而发挥促进增殖。本研究中,转染后48、72、96 h,SUDHL-4-HBx组细胞OD值显著高于SUDHL-4-con组及SUDHL-4组,提示转染HBx后SUDHL-4细胞增殖能力增加。PCNA是DNA复制过程中所必须的调节蛋白,含量高低可反映细胞增殖活跃程度,广泛应用于恶性肿瘤及增生性疾病的增殖过程研究[16]。本研究中,SUDHL-4-HBx组增殖相关蛋白PCNA水平显著高于SUDHL-4-con组及SUDHL-4组,提示转染HBx后细胞增殖更活跃。荷瘤小鼠实验研究显示,表达HBx基因的裸鼠较不表达HBx的裸鼠瘤块生长速度更快,表明在体内HBx具有与体外相同的刺激瘤细胞增殖生长的作用。细胞凋亡是维持体内环境稳定,主动清除体内损伤细胞、感染细胞的过程,大量研究显示,癌细胞不仅存在增殖速度过快,凋亡过程也受到影响[17,18]。本研究中,转染48 h后SUDHL-4-HBx组细胞凋亡率显著低于SUDHL-4-con组及SUDHL-4组细胞,提示HBx过表达可抑制细胞凋亡过程。目前关于HBx引起的凋亡信号通路日益受到研究人员关注,但目前尚未形成统一定论[19]。促调亡基因Bax与抗调亡基因Bcl-2同属Bcl家族,二者比例决定细胞对凋亡信号的反应[20]。本研究SUDHL-4-HBx组促凋亡相关蛋白Bax、抑制抗凋亡蛋白Bcl-2表达显著高于SUDHL-4-con组与SUDHL-4组,此外执行凋亡蛋白Caspase 3表达低于SUDHL-4-con组与SUDHL-4组,提示HBx可能通过影响凋亡信号通路中的关键因子Bcl-2、Bax、Caspase 3等蛋白表达,抑制SUDHL-4细胞凋亡。
综上所述,HBV感染与DLBCL患者临床分期及肝损伤有关,过表达HBx可促进SUDHL-4细胞增殖,抑制其凋亡。
