大豆异黄酮开环转化菌株耐氧突变株脯氨酸体外累积及其抗氧化活性研究
2020-09-15刘玉霞曹伶俐窦世娟王秀伶
刘玉霞,曹伶俐,窦世娟,王秀伶
(1. 河北农业大学 生命科学学院,河北 保定 071001;2. 沧州医学高等专科学校,河北 沧州 061001)
脯氨酸(Proline,Pro),通常指L- 脯氨酸,其化学名称为吡咯烷酮羧酸,是一种重要的生物蛋白质氨基酸。由于其结构与性质的独特性(亚氨基酸、分子量小、水溶性大),除了作为蛋白质成分外,还发挥多方面生理功能。现有研究结果证实,许多植物在应激条件下会积累脯氨酸,此现象最早发现于枯萎的黑麦草中[1]。积累的脯氨酸除作为渗透调节物质外,还在清除活性氧、稳定蛋白质(酶)、调控蛋白合成和细胞周期转换等方发挥重要作用[2-5]。 在细菌中,脯氨酸的积累最初发现与其渗透胁迫耐受性密切相关[6],1981 年Csonka 的研究结果表明,鼠伤寒沙门氏菌的脯氨酸高产菌株获得了渗透抗 性[7];后来,Zaprasis 等的研究发现,枯草芽孢杆菌可通过从头合成与吸收、外源多肽水解或其他氨基酸代谢转化等方式积累胞内脯氨酸,对抗高渗透压的影响[8-9]。另外,有研究报道,大肠杆菌中积累的脯氨酸在热应激过程中可减少蛋白质聚集[10]。2014 年,Cheng 等研究结果还证实,脯氨酸和谷氨酰胺可通过上调NtrY/NtrX、PutA/GlnA 和加速DNA 结合蛋白CtrA 的降解来调控人单核细胞查菲埃立克体(一种严格细胞内寄生菌)的快速增殖,提高其致病力[11]。
试验菌株Clostridium sp. AUH-JLC108 是本实验室从公鸡新鲜粪样中分离得到的革兰氏阳性严格厌氧细菌,该菌株在厌氧条件下能将底物大豆异黄酮黄豆苷原开环转化为 O-Dma,为提高其耐氧能力,本实验室对其进行了耐氧驯化,并成功得到既能在有空气氧条件下生长又能高效转化的耐氧突变株Clostridium sp. Aeroto-AUH-JLC108[12]。与原出发菌株相比,在相同接种条件下,耐氧突变株Aeroto-AUH-JLC108 在有氧条件下的生长速度比原出发菌株在厌氧条件下明显加快,生物量(OD 值)是原出发菌株在厌氧条件下的2 ~3 倍。为探索该耐氧突变株在有氧条件下生长速度变快以及生物量成倍增加的原因,本研究对菌株发酵液中的代谢物进行检测,发现耐氧突变株在有氧条件下生长时,获得了积累脯氨酸的能力。本研究对耐氧突变株Aeroto-AUH-JLC108 脯氨酸合成动态进行检测,并从脯氨酸直接和间接抗氧化能力方面展开研究,以期为进一步研究脯氨酸对耐氧突变株菌体增殖的作用和机制提供重要参考。
1 材料与方法
1.1 材料、试剂和仪器
试验菌株为具有大豆异黄酮(黄豆苷原)转化活性的专性厌氧菌AUH-JLC108 (Clostridium sp.)及其耐氧突变菌株 Aeroto-AUH-JLC108,2 菌株均由本实验室分离保存。
脑心浸液培养基(BHI),美国BD 公司;化学限定培养基(配制1 L 培养基,需葡萄糖10 g、硫酸铵2 g、KH2PO42 g、K2HPO47 g、柠檬酸钠0.5 g、 MgSO40.2 g、无水氯化钙 20 mg、FeSO4·7H2O 10 mg、 L- 谷氨酰胺 0.6 g、L- 半胱氨酸 0.6 g);L- 脯氨酸,北京索莱宝科技有限公司;FMOC-Cl,上海阿拉丁生化科技股份有限公司;三氟乙酸,上海麦恪林生化科技有限公司;1, 1-二苯基-2-三硝基苯肼(DPPH),美国Sigma 公司;NADH 氧化酶和过氧化物酶检测试剂盒,南京建成生物工程研究所;乙腈(色谱纯),北京牛牛基因技术有限公司。
Concept 400 型厌氧工作站,英国Ruskinn 公司;BCM-1000A 型超净工作台,苏州安泰空气技术有限公司;ZXDP-B2080 型电热恒温培养箱,上海智城分析仪器制造有限公司;高效液相色谱仪,美国 Waters 公司;DU-650 型紫外可见分光光度计,美国Beckmen 公司;5417R 型低温高速离心机,德国Eppendorf 公司。
1.2 菌株培养条件
严格厌氧梭菌AUH-JLC108 的培养条件为:在厌氧工作站内以10%的接种量将种液接种到盛有 1 mL 新鲜BHI 液体培养基的带盖螺口玻璃试管中,接种后在厌氧工作站内静置培养。厌氧工作站内混合气体种类及配比为:5% CO2,10% H2和85% N2,厌氧工作站内温度设定为37 ℃。
耐氧突变株Aeroto-AUH-JLC108 的培养条件为: 在超净工作台内以10%接种量将种液接种到盛有 4 mL 新鲜BHI 液体培养基(或化学限定培养基)的带盖螺口玻璃试管中,将接种后的试管放在37 ℃电热恒温培养箱内静置培养。
1.3 脯氨酸的高效液相检测
1.3.1 标准溶液和衍生溶液的配制 标准溶液:准确称取色谱纯脯氨酸标品适量,用超纯水溶解成浓度为10 mg/mL 的标准母液,然后梯度稀释至 0.1、0.2、0.4、0.6、0.8 和1.0 mg/mL。
FMOC-Cl 乙腈溶液:准确称取FMOC-Cl 适量,用乙腈溶解成浓度为0.2 mol/L 的溶液。
四硼酸钠水溶液:准确称取四硼酸钠适量,用超纯水溶解成浓度为0.125 mol/L 的溶液。
1.3.2 HPLC 检测 标准溶液或细菌发酵上清液参考文献[13],衍生化后进行HPLC 检测。色谱柱为Agilent C18(250 mm× 4.6 mm,5 μm);流速为1 mL/min;流动相 A 为 0.05% 三氟乙酸水溶液,B 为 0.05% 三氟乙酸乙腈溶液;检测波长 263 nm, 进样量10 μL,梯度洗脱条件如下:0 ~5 min, 70% A; 5 ~10 min, 70% ~60% A; 10 ~15 min, 60% ~50% A; 15 ~20 min, 50% ~40% A; 20 ~25 min, 40% ~60% A; 25 ~28 min, 60% ~ 70% A。
1.4 脯氨酸的产生动态
按照1.2 的方法培养菌株Aeroto-AUH-JLC108,每隔3 h 取发酵液测定OD600,同时取离心后发酵上清夜,按照1.3 的方法进行衍生及高效液相色谱检测,试验重复 3 次。分别记录不同取样时间脯氨酸的出峰面积,根据标准曲线计算发酵液中脯氨酸含量,绘制 Aeroto-AUH-JLC108 的脯氨酸产生动态。
1.5 脯氨酸的抗氧化活性测定
1.5.1 DPPH 清除能力测定 参考本实验室以前报道[14]的方法进行。
1.5.2 H2O2清除能力测定 参考文献[15]方法略有改动,将Aeroto-AUH-JLC108 接种于含有(或不含有)10 mmol/L 脯氨酸的化学限定培养基中生长至OD600为0.3。离心收集细胞沉淀,洗涤并重悬于磷酸盐缓冲液(pH 7.4)中至OD600为0.1。然后加入5 mmol/L H2O2,于不同时间点取样,在230 nm 波长处测定吸光度值,计算H2O2清除率。同时在磷酸盐缓冲液中,将脯氨酸(10 mmol/L)和H2O2(5 mmol/L)一起孵育,相同时间点测定单纯的脯氨酸对H2O2的清除能力。
1.5.3 氧化胁迫与抗氧化胁迫试验 参考文献[16 ~ 17]方法进行设计和试验,原理是通过添加外源氧化剂和抗氧化剂所分别造成的氧胁迫或抗氧胁迫环境,检测氧化剂和抗氧化剂对细菌生长,以及抗氧化酶活性的影响。
具体方法为:分别配制1 mol/L H2O2和200 mol/L 脯氨酸母液,0.22 μm 微孔滤膜过滤除菌后,于超净工作台中加入灭菌培养基至适当终浓度。将Aeroto-AUH-JLC108 分别接种于外源添加或不添加H2O2和脯氨酸的液体培养基中,37 ℃恒温培养箱内静置培养至对数生长末期,测其OD600。取菌液离心收集细胞,用磷酸盐缓冲液洗涤2 次,然后重悬于800 μL 生理盐水中超声破碎细胞,4 ℃离心除去细胞碎片,按照试剂盒说明书测定上清液中过氧化物酶(POD)和NADH 氧化酶的活性。
2 结果与分析
2.1 菌株发酵液中脯氨酸的检测
在BHI 液体培养基中37 ℃下分别培养原出发菌株AUH-JLC108(厌氧工作站内)及其耐氧突变菌株Aeroto-AUH-JLC108(普通恒温培养箱内),以不接菌的BHI 新鲜液体培养基为对照,测定发酵液和新鲜BHI 液体培养基中的脯氨酸含量,结果如图1 所示。
由图1 可以看出,脯氨酸标准品(图1A)的出峰时间在21 min 左右,而不接菌的新鲜BHI 培养基(图1B)在相同的保留时间亦有相应的物质峰,通过添加脯氨酸内标后峰面积的变化规律,证实图1B中在相同保留时间出现的物质峰为脯氨酸,该结果表明,在BHI 培养基中含有一定量的游离脯氨酸。类似地,在未驯化的原出发菌株AUH-JLC108(图1C)的培养液中同样检测到了与脯氨酸标准品的保留时间相同、且峰面积大小与新鲜BHI 培养基中的脯氨酸相近的物质峰。由于在未驯化原出发菌株AUH-JLC108 不同培养时间的培养液中检测到的脯氨酸的量比较接近,因此推测,原出发菌株AUHJLC108 可能不产生脯氨酸;或者产生与消耗脯氨酸的速度相近。与未驯化的原出发菌株AUH-JLC108类似,在耐氧突变株 Aeroto-AUH-JLC108(图1D)的培养液中检测到了脯氨酸的物质峰,但不同的是,脯氨酸的峰面积却明显高于BHI 培养基中以及未驯化菌株AUH-JLC108 发酵液中的检测量。故推测,与未驯化的原出发菌株AUH-JLC108 相比,耐氧突变株 Aeroto-AUH-JLC108 产脯氨酸能力明显加强;或者耐氧突变株Aeroto-AUH-JLC108 产脯氨酸能力与驯化前相比无明显加强,但消耗利用脯氨酸能力却明显减弱,因而导致了菌株培养液中脯氨酸的累积。
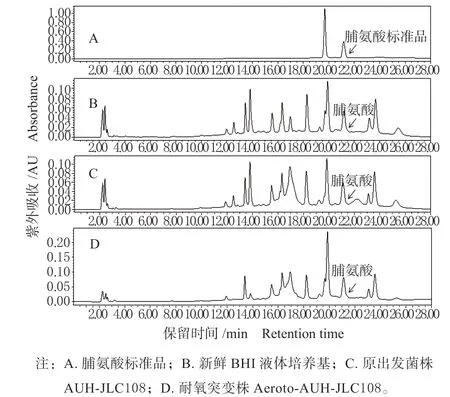
图1 BHI 培养基及菌体培养液中脯氨酸含量 检测的高效液相色谱图Fig.1 HPLC elution profiles of proline detected in fresh BHI liquid medium and cultural broth
2.2 耐氧突变株脯氨酸合成能力的验证
本研究发现,BHI(脑心浸液培养基)本身含有一定量的游离脯氨酸(图1B)。另外,BHI 培养基含有大量动物蛋白,在菌体产生蛋白酶作用下,一些含脯氨酸的蛋白质也有可能产生游离脯氨酸。化学限定培养基成分确定,为消除培养基本身含有的脯氨酸的干扰,本研究在化学限定培养基中添加已知浓度的脯氨酸,并检测不同培养时间培养液中的脯氨酸含量。结果表明,耐氧突变株Aeroto-AUH-JLC108 接种后0 h 能检测到一定量的脯氨酸 (1.44 mmol/L)(图2B),这是因为用于制备耐氧突变株Aeroto-AUH-JLC108 的种子液的是BHI培养基,而耐氧突变株Aeroto-AUH-JLC108 在BHI培养基中能够产生较大量的脯氨酸。当耐氧突变株Aeroto-AUH-JLC108 在化学限定培养基中培养6 h后(图2C),检测到脯氨酸的量(2.79 mmol/L)比培养0 h 时增大近1 倍。因此,可以肯定的是,耐氧突变株Aeroto-AUH-JLC108 在有氧条件下培养时能够合成和积累脯氨酸。需指出的是,原出发菌株AUH-JLC108 在化学限定培养基中、在厌氧条件下并不能生长,因此,本研究未能检测原出发菌株AUH-JLC108 在化学限定培养基中产脯氨酸能力。
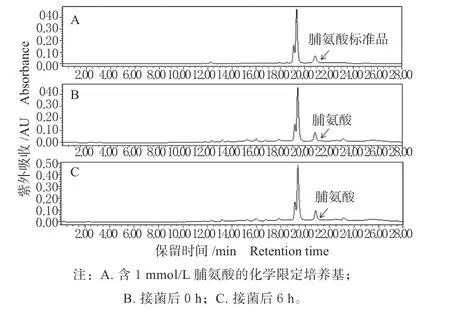
图2 化学限定培养基中脯氨酸含量检测的高效液相色谱图Fig.2 HPLC elution profiles of proline detected in the pure chemically defined cultural medium
2.3 耐氧突变株脯氨酸产生动态
由于接种用种子液中含有一定浓度的脯氨酸,因而,在接种后0 h 能检测到1 mmol/L 左右的脯氨(见图3),但随着菌体开始生长,培养液中脯氨酸的量不断增加。接种后0 ~9 h 为细菌对数生长期,接种后9 h,培养液中脯氨酸的量达到一个高值,之后6 h 有所下降。总体看,脯氨酸产量的变化趋势和细菌生长曲线大致吻合。
本实验室前期研究结果表明,与原出发菌株AUH-JLC108 相比,在相同接种条件下,耐氧突变株Aeroto-AUH-JLC108 在有氧下的生长速度比原出发菌株在厌氧条件下明显加快,生物量是原出发菌株在厌氧条件下的2 ~3 倍。通过本研究发现,耐氧突变株Aeroto-AUH-JLC108 在有空气氧条件下生长时产脯氨酸能力明显加强,且脯氨酸产量变化与细菌生长曲线相吻合,故推测脯氨酸在耐氧突变株快速生长和生物量成倍增加中可能发挥着重要作用。
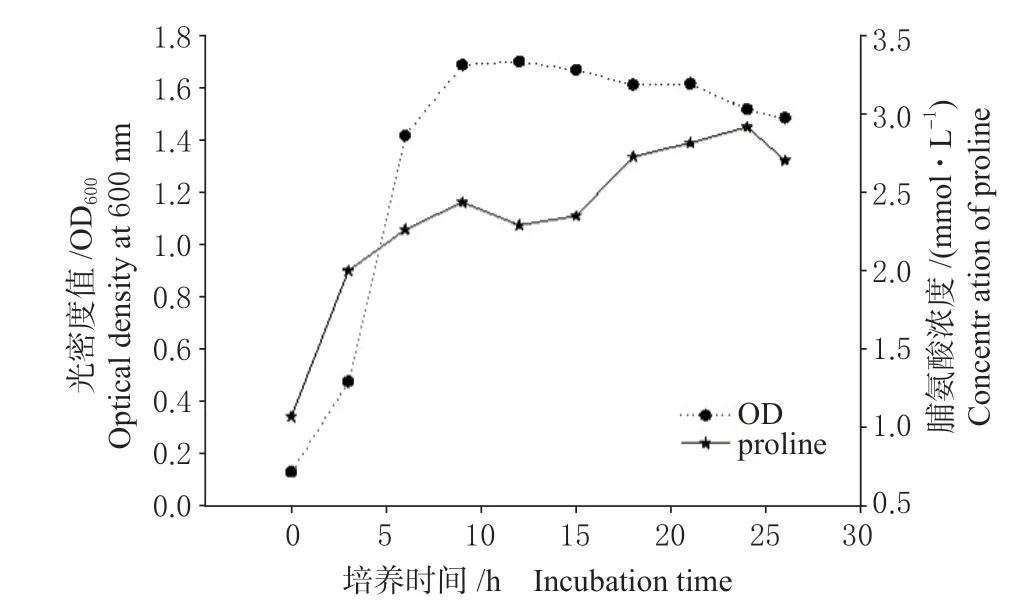
图3 耐氧突变株 Aeroto-AUH-JLC108 脯氨酸产生动态 Fig.3 Kinetics study of proline produced by the oxygentolerant mutant strain Aeroto-AUH-JLC108
2.4 脯氨酸的抗氧化活性检测
2.4.1 DPPH 自由基清除能力 将不同浓度脯氨酸(0.1、0.2、0.4、0.5 和1.0 mmol/L)与DPPH 自由基避光反应,于不同时间(1、24、48 和72 h)测定其对DPPH 自由基的清除效果(图4)。由图4 可以看出,不同浓度的脯氨酸对DPPH 自由基均有一定的清除作用,且在相同反应时间内,随脯氨酸浓度的增加,其对DPPH 自由基的清除能力明显增强。另外,本研究还发现,随反应时间的延长,相同浓度的脯氨酸对DPPH 自由基的清除能力亦明显提高,浓度为 1.0 mmol/L 的脯氨酸在1 、24、48 和72 h 时的清除率分别为13.48%、34.86%、44.07%和45.41%。
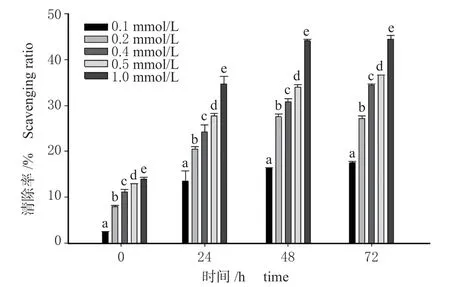
图4 不同浓度脯氨酸在不同反应时间对DPPH 自由基的清除能力Fig. 4 DPPH free radical-scavenging activity of different concentrations of proline under different reaction periods
2.4.2 抗氧化胁迫能力 ①不同浓度的外源H2O2对耐氧突变株有氧生长的影响。本研究将耐氧突变株Aeroto-AUH-JLC108 培养在外源添加不同浓度(1、2.5、5、7、8、9、10 mmol/L)H2O2的培养基中,对数生长末期取样测其OD600,结果如图5A 所示。由图5A 可以看出,当外源添加的H2O2浓度范围在1 ~7 mmol/L 时,耐氧突变株Aeroto-AUH-JLC108在有空气氧条件下生长的OD 值几乎不受影响;当外源添加的H2O2浓度增至8 mmol/L 时,耐氧突变株的生长明显受到抑制,当H2O2浓度增至10 mmol/L 时,则完全受到抑制。

图5 外源添加不同浓度的H2O2 对耐氧突变株Aeroto-AUH-JLC108 有氧生长的影响Fig. 5 Influence of different concentrations of H2O2 added in the cultural medium on growth of the oxygen-tolerant mutant strain Aeroto-AUH-JLC108 when grown under aerobic conditions
②添加脯氨酸对耐氧突变株有氧生长的保护作用。由上述外源H2O2氧化胁迫影响试验,发现浓度为8 mmol/L 的外源H2O2对耐氧突变株Aeroto-AUH-JLC108 在有空气氧条件下的生长产生了明显的抑制作用(图5A)。为探索脯氨酸的抗氧化胁迫能力,本研究将耐氧突变株Aeroto-AUH-JLC108 接种在同时含有外源添加H2O2(8 mmol/L)和脯氨酸(2 mmol/L)的BHI 培养基中,测定外源添加物对耐氧突变株生物量(OD600)的影响(图5B)。 由图5B可以看出,与无外源脯氨酸添加的对照相比,培养基中添加2 mmol/L 的脯氨酸能明显缓解H2O2(8 mmol/L)对耐氧突变株Aeroto-AUH-JLC108 有氧生长的抑制作用。该研究结果表明,耐氧突变株Aeroto-AUHJLC108 在有空气氧条件下生长时,菌体产生的脯氨酸可缓解H2O2对耐氧突变株生长的抑制作用。
③脯氨酸对抗氧化酶活性的保护作用。培养基中添加一定浓度脯氨酸可缓解H2O2对耐氧突变株有氧生长的抑制作用,但经检测发现,无论是耐氧突变株Aeroto-AUH-JLC108 的菌体细胞,还是单纯的脯氨酸,对H2O2的直接清除能力甚微。据报道,外源脯氨酸可通过提高抗氧化酶(过氧化氢酶和过氧化物酶)的活性,来减轻盐胁迫对烟草BY-2 悬浮培养细胞生长的影响。本实验室前期研究结果表明,耐氧突变株Aeroto-AUH-JLC108 不产生过氧化氢酶,但具有较高的NADH 氧化酶活性。因此,本研究分别检测了对照组、H2O2组以及H2O2+proline 组中耐氧突变株产生的过氧化物酶和NADH 氧化酶活性(见图6)。结果表明,与对照相比,H2O2组NADH 氧化酶活性显著降低,而H2O2+proline 组该酶活性虽显著低于对照,但同时也明显高于H2O2组。该研究结果表明,耐氧突变株产生的脯氨酸可有效保护抗氧化酶NADH 氧化酶的活性。
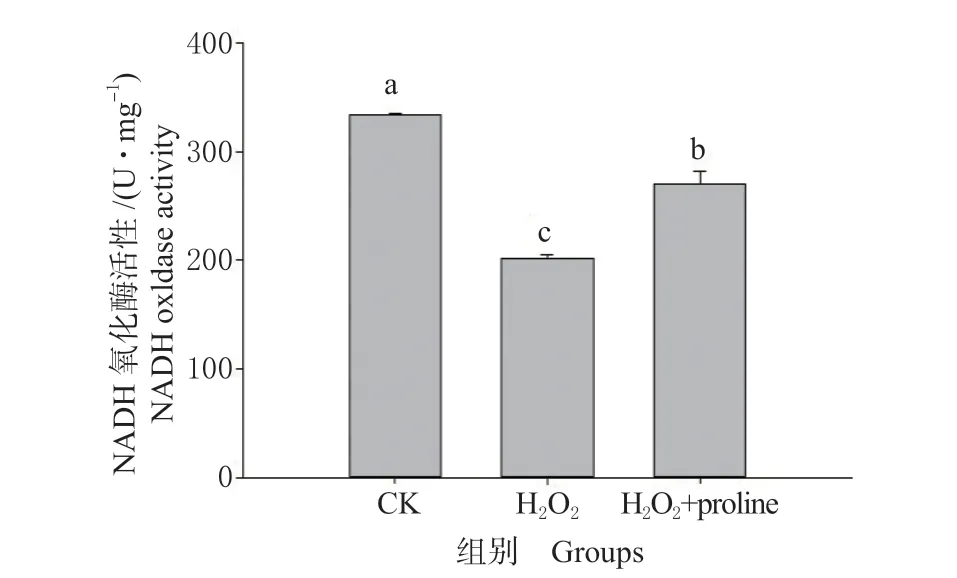
图6 H2O2 胁迫下脯氨酸对耐氧突变株NADH 氧化酶活性的影响Fig. 6 Influence of proline on NADH oxidase activity produced by the oxygen-tolerant mutant strain under H2O2 stress
3 结论与讨论
游离脯氨酸的功能通常与活性氧(ROS)平衡的调节相关[18]。据报道,脯氨酸除能直接清除某些类型的活性氧外,还能保护多种抗氧化酶的稳定性,激活其他的解毒途径[19]。关于脯氨酸本身的抗氧化活性,以前报道较多的是关于其对超氧阴离子()、过氧化氢(H2O2)、羟基自由基(·OH)和单线态氧(1O2)的清除能力,表明脯氨酸体外是有效的1O2和·OH 清除剂[20-24]。但目前也有一些不同的说法:Kaul 等报道脯氨酸不抑制邻苯三酚的自氧化[25],这是一种涉及超氧自由基(O2·-)产生的反应;Signorelli 等证明脯氨酸不能淬灭水缓冲液中的1O2[26],从而引起脯氨酸对1O2抗氧化作用的反思。DPPH 是一种很稳定的氮中心的自由基,广泛用于抗氧化成分的体外抗氧化性评价,但尚未见用于脯氨酸抗氧化的报道。本研究经检测发现,低浓度的脯氨酸即对DPPH 自由基具有显著的清除活性,但脯氨酸对H2O2的体外清除能力甚微,这与之前的报道一致[15,21]。
目前已表征了大量与ROS 清除相关的酶类,如超氧化物歧化酶(SOD)、过氧化氢酶、过氧化物酶、NADH 氧化酶(NOX)、烷基氢过氧化物酶等。其中,NADH 氧化酶是一种能催化NADH 氧化为NAD,并消耗氧气的氧化还原酶,根据产物的不同分为H2O2型和H2O 型,前者主要分布于需氧菌和部分兼性厌氧菌中,后者则主要存在于厌氧菌和部分兼性厌氧菌中[27]。近年研究发现,NADH 氧化酶与细菌的抗氧化能力密切相关[28-30],如大部分乳酸菌有氧生长过程中均会表现出该酶的活性,催化氧气变成水分子,进而减少氧气诱发的ROS 毒害[28];乳酸乳球菌(L. lactis)的NADH 氧化酶在光滑球拟酵母和酿酒酵母中的异源表达均发现可有效降低有氧发酵条件下的 ROS 水平[31-32];Kang 等发现NADH 氧化酶-NADH 过氧化物酶系统是Lactobacillus panis PM1 主要的抗氧化应激机制[33]。现有研究结果证实,在不同胁迫条件下,脯氨酸对植物中多种抗氧化酶,如抗坏血酸-谷胱甘肽循环酶、过氧化氢酶和过氧化物酶、超氧化物歧化酶活性的保护或增强作用[17,34,35]。本研究首次发现,在氧化胁迫条件下,脯氨酸对耐氧突变株产生的NADH氧化酶活性具有保护作用。
已报道在动植物和微生物中,ROS 可作为一种信号分子,直接或间接地作用于信号转导途径,影响细胞分化、细胞增殖、细胞周期等[16]。NADH氧化酶除可以保护细胞免受自由基形成的损害外,其另一个重要作用是调节细胞内NADH/NAD+的比率,从而改变菌体的代谢路径[27]。耐氧突变株Aeroto-AUH-JLC108 具有较强的NADH 氧化酶活性,推测该菌株在有空气氧条件下生长时,脯氨酸可能通过影响NADH 氧化酶的活性来发挥其作用,如通过影响ROS 的产生与清除或通过影响NADH/NAD+的比率,进而影响细菌生长和增殖,具体机制还有待进一步研究。
