金属与酸反应的易错题
2020-09-10单秀丽
单秀丽



以金属与酸反应为背景的题目在中考出现的频率高,分值较大。让我们和壮壮同学一起跟随单老师厘清金属与酸反应的易错题吧!
壮壮的错题1
壮壮:单老师,下面这道题我答的是:“2Fe + 3H2SO4 Fe2(SO4)3 + 3H2↑,Cu + H2SO4 CuSO4 + H2↑”。答案为什么是“Fe + H2SO4 FeSO4 + H2↑”?哪里错了呢?
【题1】把铁丝和铜丝插入稀硫酸中,有气泡产生,反应的化学方程式为 。
单老师:做对这个题的前提是牢记金属活动顺序表。活泼金属能置换出盐酸或稀硫酸中的氢元素,生成氢气和一种金属化合物,活泼金属是指排在金属活动性顺序表中氢前面的金属。金属活动性顺序表如下:
根据金属活动性顺序表,铁是氢前金属,铁元素在化合物中可能显+2价,也可能显+3价。当铁与酸发生置换反应时,生成的化合物中铁元素为+2价,即应生成FeSO4。而铜在金属活动性顺序表中位于氢后,与稀硫酸不反应。
【检测1】下列化合物不能用金属与酸直接反应制得的是( )。
A. FeCl3 B. AlCl3 C. ZnSO4 D. MgSO4
答案:A
壮壮的错题2
壮壮:单老师,下面这道金属与酸反应和天平平衡结合的题目我没有思路,麻烦您给我讲讲吧!
【题2】如图1所示,在托盘天平的两个托盘上各放一只烧杯,分别加入相同质量分数、相同质量的稀盐酸,天平平衡。向左边的烧杯中加入10 g金属锌,向右边的烧杯中加入10 g金属镁。当反应停止后,金属都有剩余,天平指针的指向是( )。
A. 分度盘的左边 B. 分度盘的中间
C. 分度盘的右边 D. 3种情况都有可能
单老师:两托盘烧杯中加入等质量同种酸后天平平衡,再加入等质量的不同金属,加入的瞬间天平两盘增重相同,所以天平仍然平衡,但因为锌、镁与酸反应都生成氢气,最终指针指向由生成氢气的质量决定,即生成氢气(即托盘上损失质量)多的一侧轻。但本题中最终金属都有剩余,生成氢气的质量受到酸的限制。而两烧杯中的稀盐酸质量相等、质量分数相同,完全参加反应生成的氢气一样多,所以天平指针应该指在分度盘的中央,故选项B正确。
【检测2】在托盘天平的两端各放一只烧杯,调节天平平衡,在两只烧杯中分别加入足量相同质量、相同质量分数的稀盐酸,然后在右盘加入锌粉,在左盘加入铁粉,金属质量相等,当金属均完全反应后,天平指针将( )。
A. 偏左 B. 偏右 C. 居中 D. 条件不充分,无法确定
答案:B
壮壮的错题3
壮壮:单老师,下面这道题正确答案是C,可我选了D,我错在哪里了呢?
【题3】等质量且颗粒大小相同的甲、乙、丙三种金属,分别放入足量的同种稀硫酸中,产生氢气的质量与反应时间的关系如图2所示(已知甲、乙、丙在生成物中化合价均为+2价),则下列说法中不正确的是( )。
A. 金属活动性:乙>甲>丙
B. 生成氢气的质量:甲>乙>丙
C. 相对原子质量:乙>丙>甲
D. 消耗稀硫酸的质量:甲>乙>丙
单老师:A选项,由图象可知,等质量的甲、乙、丙三种金属完全反应时,乙用的时间最少,丙用的时间最多。金属的活动性越强,与酸反应的速率越快,用时便越少,则金属活动性顺序为:乙>甲>丙,故选项A说法正确。B选项,完全反应后,拐点纵坐标所对应的数值表示生成气体的多少,则生成氢气的质量为:甲>乙>丙,故选项B说法正确。C选项,由于化合价相同,产生的氢气质量与金属的相对原子质量成反比,产生氢气质量越多,说明该金属的相对原子质量越小,则相对原子质量:丙>乙>甲,故选项C说法错误。D选项,由质量守恒定律,生成氢气的质量等于硫酸中氢元素的质量,生成氢气的质量越多,消耗的稀硫酸的质量越多,则消耗稀硫酸的质量:甲>乙>丙,故选项D说法正确。故本题应选择C。
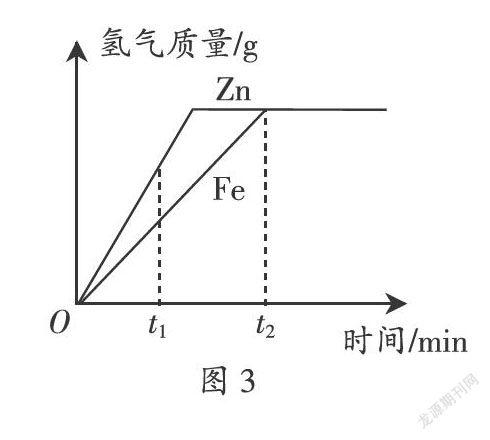
【检测3】相等质量的铁、锌分别和相等质量的稀盐酸反应,产生氢气的质量与时间关系如图3所示,下列说法不正确的是( )。
A. t1時,锌产生的氢气较铁多
B. t1时,锌产生氢气的速率比铁大
C. t2时,锌、铁消耗的稀盐酸质量相同
D. t2时,锌一定有剩余,铁不一定有剩余
答案:D
