广东炭步芋头组培快繁技术体系的建立
2020-09-10魏利国罗燕羽刘伟光秦鹏张木清
魏利国 罗燕羽 刘伟光 秦鹏 张木清

摘 要:以广东炭步芋头为研究材料,研究不同外源激素对芋头组培苗不定芽诱导、增殖、生根的影响,以及不同育苗基质对芋头组培苗的影响,以期建立一套完整的炭步芋头组培快繁技术体系。结果表明:最佳的不定芽诱导培养基为:MS+4.0mg/L6-BA+0.1mg/LNAA,诱导率为85%;最佳增殖培养基为:MS+2.0mg/L6-BA+0.2mg/LNAA,增殖系数为4.2;最佳的生根培养基为:1/2MS+0.1mg/LNAA,生根率为100%;炼苗基质最佳的为蛭石,成活率可达到98%。
关键词:炭步芋头;组织培养;快速繁殖
1 前言
炭步芋头是广东省广州市花都区炭步镇的特产,其母芋(芋头)呈椭圆筒形,一般长20~32cm,直径40~55cm,皮薄呈棕黄色,单个母芋重1.4~5.6kg,每个母芋基部可产生4~6个重25~125g的小芋子,母芋体大形美,芋肉带紫红色槟榔花纹。煮食时,香味四溢,口感酥松、粉嫩、香醇。因其个头大、肉质粉、味香、绵软等特点而闻名海内外。
近几年随着种植结构的调整,炭步镇种植槟榔芋的面积逐年扩大,槟榔芋已成为该镇主栽蔬菜品种之一[1]。然而长期的无性繁殖导致了芋头植株病虫害严重、种性退化等,尤其是近几年,发病率达到80%以上,到最后采收的商品率仅为15%左右,严重影响了炭步芋头的发展。
目前生产上芋头种植普遍采用块茎繁殖,其自然繁殖系数较低,所以即便同一地区的同一“品种”也不是从一个单株个体产生而来,导致了芋头品种内的遗传性状千差万别[2]。另外,芋头等块根、块茎类作物在繁殖过程中容易被病毒侵染,而且会不断累积,造成品质下降、产量降低,进而影响其产品的品质性状[3]。
本文以炭步文岗槟榔香芋茎尖为试验材料,通过试验研究出一套炭步文岗槟榔香芋的茎尖组培快繁技术体系,促进炭步地区芋头产业健康、快速发展。
2 材料与方法
2.1 试验材料
供试芋头为炭步槟榔芋头,由花都区炭步文岗香芋合作社提供的。
2.2 试验方法
2.2.1 外植体的处理与消毒
选用炭步芋头为材料,挑选健壮、无病虫害、地下块茎100g左右的芋头植株,用自来水清洗干净,于遮阳通风处晾干表面水分,然后切取2cm×2cm×3cm大小的茎尖,置于超净工作台中进行灭菌处理。用75%的酒精浸泡1min,无菌水清洗3~4次后,取出放入0.1%升汞溶液中灭菌10min,期间不断振荡,最后用无菌水清洗5~6次,置于接种盘上,剥取直径为3~5mm的茎尖,接种于不定芽诱导培养基中。
2.2.2 不定芽的诱导与增殖培养
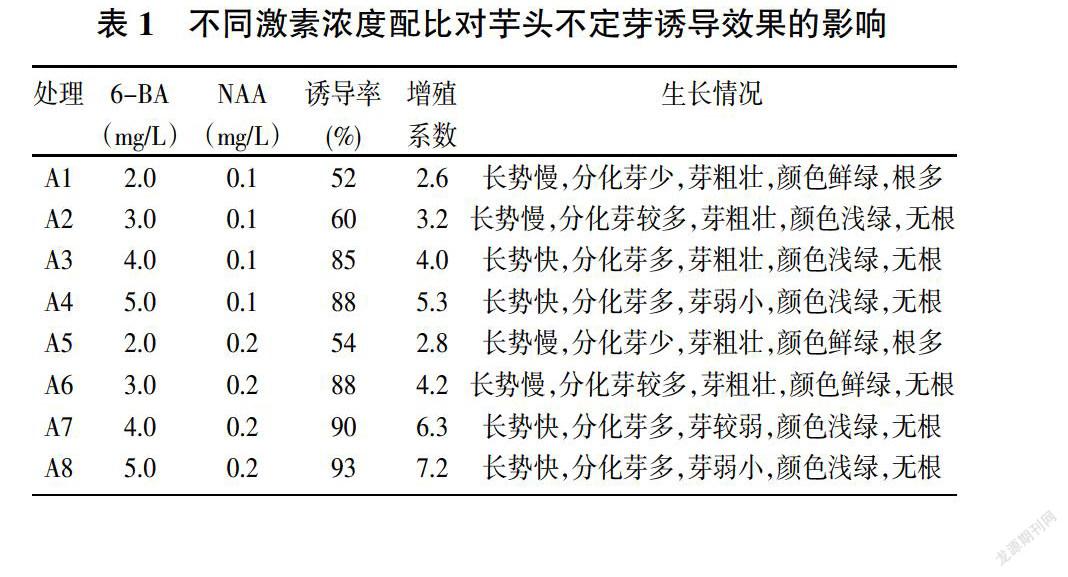
以MS+3%蔗糖+5g/L卡拉胶为基本培养基(pH=5.8~6.0),添加不同浓度的6-BA(2.0、3.0、4.0、5.0mg/L)和NAA(0.1、0.2mg/L)进行不定芽诱导培养和增殖培养。
不定芽的诱导培养,每瓶1个外植体,每种培养基接种50瓶,培养30天后观察分化情况,统计不定芽诱导率。增殖培养,每种培养基50瓶,每瓶接种6丛,每丛2~3个芽,三个重复,培养20天观察增殖情况,统计增值率。
2.2.3 生根培养
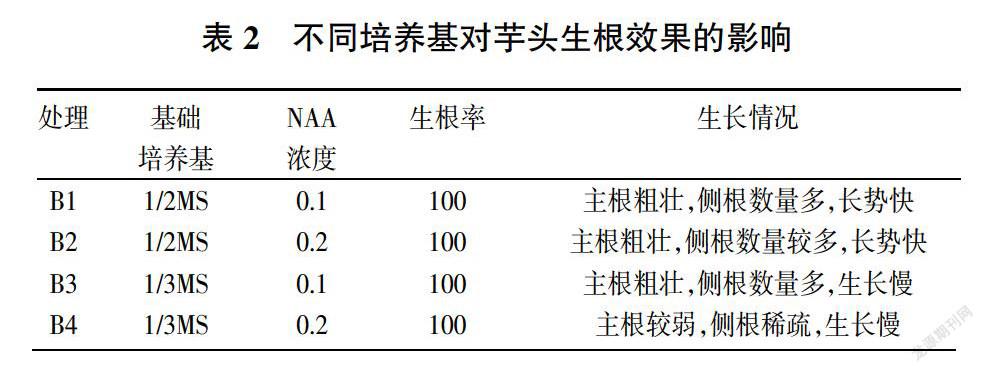
设置4种生根培养基:B1:1/2MS+0.1mg/LNAA+3%蔗糖+5g/L卡拉胶+0.5g/L活性炭;B2:1/2MS+0.2mg/LNAA+3%蔗糖+5g/L卡拉胶+0.5g/L活性炭;B3:1/3MS+0.1mg/LNAA+3%蔗糖+5g/L卡拉胶+0.5g/L活性炭;B4:1/3MS+0.2mg/LNAA+3%蔗糖+5g/L卡拉胶+0.5g/L活性炭。每种培养基接种50瓶,每瓶接种10株,培养20天观察生根情况,统计生根率。
2.2.4 移栽
芋头组培苗生根完成后,将其置于无太阳光直射的温室内进行炼苗2~3天,然后半开盖继续炼苗2~3天。炼苗完成后清洗掉根部培养基,移栽入装好不同基质的穴盘(5×10)中。
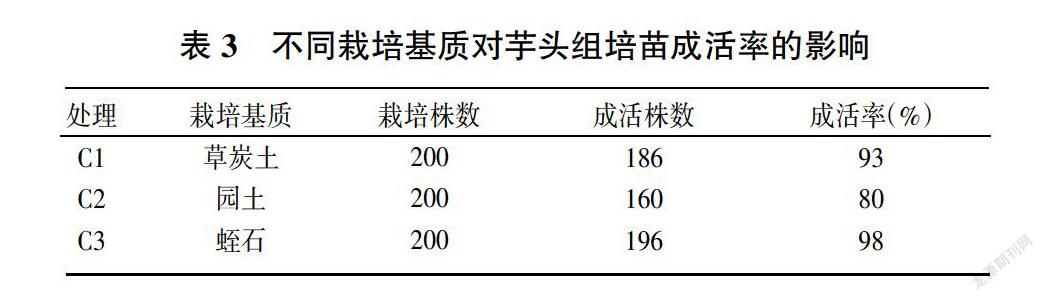
育苗基质为:C1:草炭土;C2:园土;C3:蛭石。育苗30天,观察记录幼苗生根率和生长情况。
3 结果与分析
3.1 不同激素浓度配比对不定芽诱导培养的影响
从表1中可以看出,在同一NAA浓度下,随着6-BA浓度的升高,芋头不定芽的诱导率越高。
在较低6-BA浓度情况下,虽然诱导出的芽比较粗壮,但是长势较慢、分化的芽少,不利于芋头的快速繁殖。在同一6-BA濃度下,适当提高NAA的浓度,有利于不定芽的诱导,分化的芽数也较多,但在较高浓度激素配比情况下,分化的芽较弱小。因此,最佳的芋头不定芽诱导培养基为A3,不定芽诱导率不仅可以达到85%,且分化出来的芽,芽粗壮、芽体多、长势快。
3.2 不同激素浓度配比对丛芽增殖培养的影响
将诱导出来的芋头芽,切除上部茎叶,保留距基部1~2cm,按2~3个芽一丛接种至增殖继代培养基中。由表1可知,较高浓度的激素浓度配比有利于提高芋头不定芽的增殖系数,当6-BA浓度为5mg/L,NAA浓度为0.2mg/L时,芋头不定芽的增殖系数最高,达到7.2,但不定芽较弱,且颜色浅绿。较低的浓度激素配比虽然芽体粗壮、颜色鲜绿,但增殖系数低,且有大量的根出现,不利于增殖继代。最优的浓度激素配比为A6培养基,不仅增殖系数高,可达到4.2,且芽体粗壮、颜色鲜绿,且没有根的生长。
3.3 不同培养基对芋头生根的影响
将长至6cm左右的增殖芽切成单株接种至生根培养基中,经过20天的生根培养,通过观察记录发现,芋头组培苗生根容易,在试验的4种生根培养基中都能较好的生根,不过在不同培养基中生根质量还是存在差异的。总体上来看,1/2MS培养基比较有利于芋头组培苗的生根,且在NAA浓度为0.1mg/L时生根质量最佳,不仅主根粗壮、侧根数量多,且长势快,有利于缩短生根时间。
3.4 不同栽培基质对成活率的影响
将生根完成后的芋头组培苗清洗掉根部培养基移栽于不同的基质中,栽培15天后,结果如表3所示。总体上芋头组培苗移栽成活率还是比较高的,其中蛭石最有利于芋头组培苗的移栽,成活率可达到98%;其次是草炭土,成活率也可达到93%;最差的为园土,不适合于芋头组培苗的移栽,成活率仅为80%。
4 结论与讨论
在炭步芋头不定芽诱导和增殖继代过程中,6-BA和NAA的浓度配比具有关键作用。在不定芽诱导过程中,在较高浓度激素配比情况下,虽然有利于不定芽的诱导,分化的芽数也较多,但分化的芽较弱小,不利于后期的增殖和生根培养;在较低浓度激素配比情况下,虽然诱导出的芽体粗壮,但长势慢、芽数少,影响后期增殖速度。在增殖培养过程中,高浓度激素配比,虽然增殖系数高,芽体较弱,且颜色浅绿;较低的浓度激素配比虽然芽体粗壮、颜色鲜绿,但增殖系数低,且有大量的根出现,不利于增殖继代。
可见,过高或过低的激素浓度配比都不利于炭步芋头不定芽的诱导和增殖培养,本研究与郭克婷[4]的研究结果一致。本试验结果表明,最适宜的不定芽诱导激素浓度配比為:4mg/L6-BA+0.1mg/L NAA,最适宜的增殖继代激素浓度配比为:3mg/L6-BA+0.2mg/L NAA。
观察发现,炭步芋头组培苗生根比较容易,在增殖继代过程中就会有少量根出现,试验中的4种生根培养都能较好的生根,不过1/2MS培养基还是比较有利于生根的,这可能跟培养基中的营养成分有关,1/2MS培养基营养较充分,所以生根质量较好,最佳的生根培养为1/2MS+NAA0.1mg/L。
本试验中采用了草炭土、园土和蛭石,其中蛭石的成活率最高,可见,疏松透气的基质有利于提高炭步芋头组培苗移栽的成活率,这与符少萍[5]等的研究结果一致,疏松透气的基质有利于组培苗移栽的成活率。虽然蛭石移栽的成活高,但蛭石当中不含任何营养成分,移栽成活后要及时施肥,否则很容易出现苗弱,或者叶片黄化的现象,在一定程度上海增加了生产成本。对此,可考虑在园土中适当添加蛭石,以改善土壤结构,提高芋头组培苗移栽成活率,降低生产成本。
参考文献
[1] 谭卫萍,许敏娜,肖熙鸥.广州市文冈香芋发展现状与应对策略[J].南方农业,2011,5(9):77-79.
[2] 郑永敏.芋头脱毒快繁与栽培技术[J].安徽农业科学,2006,34(22):5824-5932.
[3] 刘玉平.芋脱毒快繁体系建立的初步研究[D].武汉:华中农业大学,2008.
[4] 郭克婷,何金明.张溪香芋茎尖组培快繁技术研究[J].广东农业科学,2015,42(6):25-29.
[5] 符少萍,李瑞梅,惠杜娟,等.木薯试管苗炼苗移栽技术研究[J].广东农业科学,2011,38(11):39-40.
