基于荧光素的TPA型Cu+反应探针研究
2020-09-08陈孝云汤耀南袁梦娅袁书侠
陈孝云,邓 鑫, 汤耀南, 袁梦娅,袁书侠
(江苏科技大学 环境与化学工程学院,镇江 212003)
众所周知,铜是人体中含量前三的过渡金属元素,是生物体内不可或缺的微量元素之一[1].铜元素的变价属性,使得它能作为蛋白质中的催化和结构辅助因子,并参与到生命体的呼吸、代谢、细胞生长和分化、氧运输以及信号转导等各种基本生命过程[2-4].因此,摄入适量的铜并保持铜在生物体中微妙的平衡,对生物体的正常运行有着极其重要的作用.研究表明,生物体摄入过量的铜或铜缺乏(统称铜失调)会引起一系列的疾病,如阿尔茨海默氏症、亨廷顿氏症和帕金森症等神经退行性疾病[5-8],Menkes疾病与Wilson等遗传性疾病[6,9-10],以及糖尿病和肥胖等代谢紊乱性疾病等[11-12].生物体一般从食物中补充的为Cu2+,因此在进入肠道后要先被还原成Cu+才能完成后续的吸收、运输等工作[13].研究铜在生物体内的作用,主要需要研究生物体内的Cu+在某些特定生命过程的行为.因此,如何实现Cu+在某一代谢过程的可视化追踪尤为重要.如果能够实现Cu+在特定区域内可视化实时原位检测,对于明确其生物作用很有帮助.随着小分子探针研究工作的不断发展,越来越多的小分子探针被成功应用于活体内各种金属离子的可视化检测[14-18].一系列性能优异的Cu+荧光探针应运而生,如基于肽链的Cu+荧光探针[18-20]、以含N和S的冠醚及其类似结构为Cu+接受基团的探针[21-27]和以三(2-吡啶甲基)胺(TPA)为接受基团的Cu+的选择性荧光探针[28-31]等.2010年,文献[32]报道了一类性能优异的基于荧光素的TPA类Cu+荧光探针FluTPA(图1).该探针具有良好的膜透性,可以很好地穿透细胞膜进入细胞内,并能在细胞内的水溶液中很好地分散.此外,该探针是一个反应性探针:首先TPA与还原形式的荧光素母环通过苄醚键连接起来,此时整个探针分子呈现荧光淬灭.但当该探针分子遇到Cu+后,TPA首先与Cu+络合,通过进一步氧化还原反应使得苄醚键断裂,生成相应的荧光素而呈现极强的荧光性质(图2).
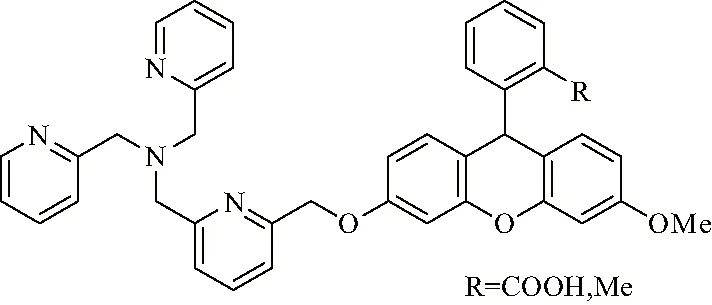
图1 Cu+选择性荧光探针(FluTPA)Fig.1 Selective fluorescent probe of Cu+(FluTPA)
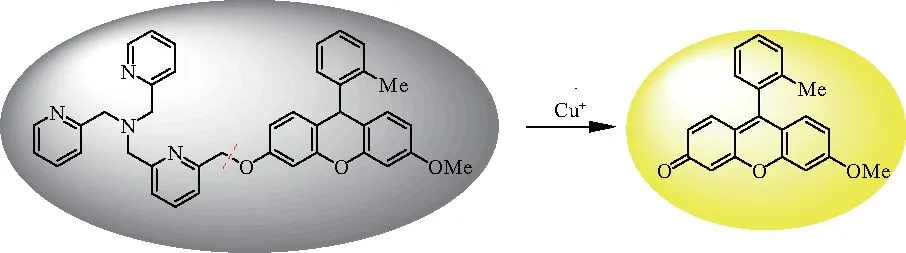
图2 FluTPA类探针的工作原理Fig.2 Principle of FluTPA sensors
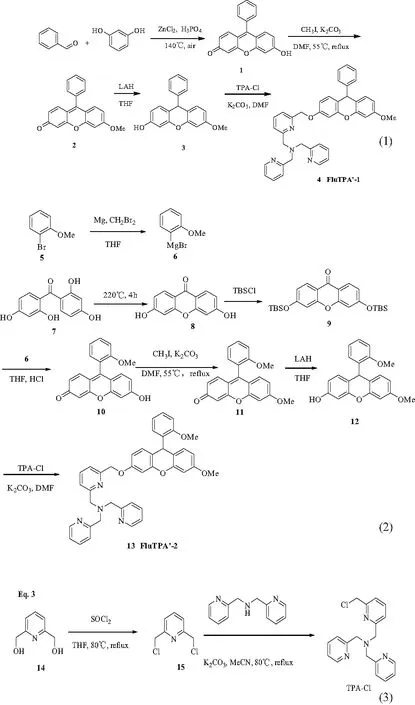
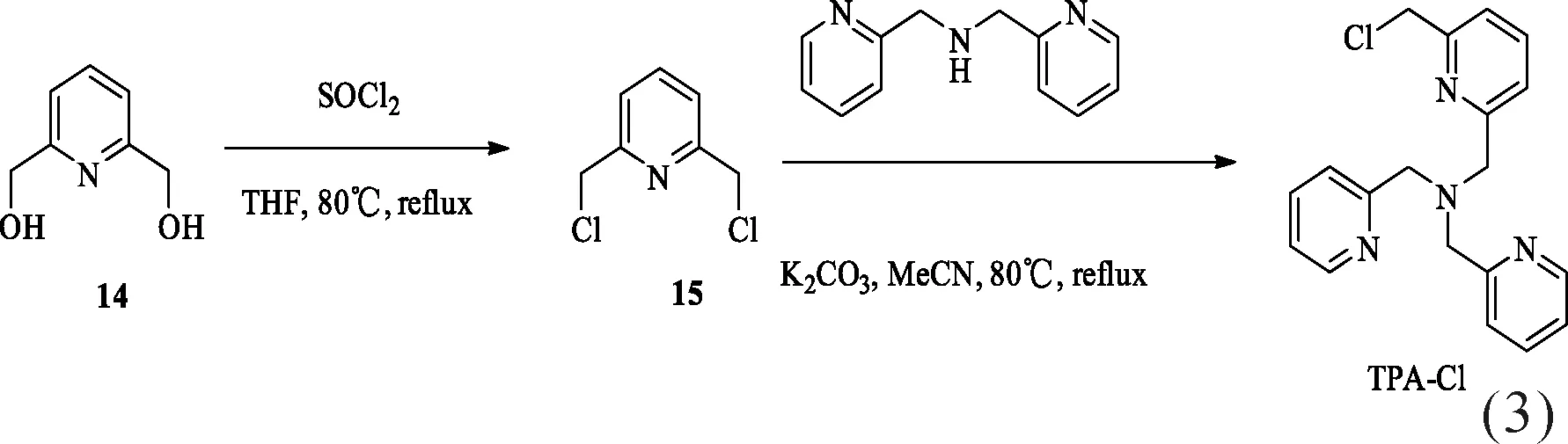
此类反应性探针分子对Cu+具有极好的选择性,可以消除一般探针分子的高背景荧光的共性问题[28, 31].荧光素及具有类似结构的罗丹明是极常见的一类染料,不仅具有好的膜透性和水溶性,而且还有很高的荧光量子产率、较长激发波长和发射波长等优点.因此,如能基于文献[32]的工作,设计并合成出性能更好的类似荧光探针,对检测活体内Cu+大有裨益.目前,仍需对以下几个问题进行进一步研究:(1) 合成难度较大,特别是后处理较难.需找到合适的路线合成出一系列9-Ar取代的荧光素类TPA型Cu+选择性探针.(2) 荧光素环上的9号位取代芳环上的取代基类型及位置对该类探针性质的影响.理论上来讲,当9号位的取代基与荧光素间的共轭作用越大且共轭区域内的电子云密度较大时,荧光针的荧光强度会增强,所需的激发波长也越靠近红外光.此类探针与Cu+络合后会发生氧化还原反应,从而使得苄醚键断裂,生成有强荧光的荧光酮.但是,探针分子共轭区域内的电子云密度越大,苄醚键越不容易断裂.鉴于上述原因,文中设计并合成了共轭面更大的9-Ph取代的探针分子4(FluTPA’-1)和具有更大电子云密度的9-(2-MeOPh)探针分子13(FluTPA’-2)两种类似探针分子,测定了其基本性质.FluTPA’-1的合成路线见式(1)[32-34],FluTPA’-2的合成路线见式(2)[35-38],TPA-Cl的制备路线见式(3)[39-41].
1 实验
1.1 仪器与试剂
美国安捷伦公司的傅立叶变换红外光谱仪;美国安捷伦公司Agilent质谱仪;德国布鲁克公司Bruker-Avance DRX-400MHZ和Bruker AVANCE-500核磁共振仪, DMSO-d6/CDCl3为溶剂, TMS 为内标;日本岛津 EDX-720 型荧光光谱仪; 德国Bruker Apex IV型高分辨液-质联用仪.所用药品均为分析纯试剂.
1.2 实验方法
1.2.1 一步法合成荧光素母环
荧光素衍生物1的合成[32]和络合基团TPA-Cl的合成参考文献[39-41]的方法.
化合物2的合成步骤如下[42]:称取适量的化合物1(280 mg,1.5 mmol)和无水碳酸钾(414 mg,3 mmol)溶于3 mL无水DMF中,加入碘甲烷(186 μL,3 mmol).混合液置于55 ℃油浴下搅拌反应30 min,待混合液冷却至室温后加入10 mL饱和碳酸氢钠溶液以淬灭反应,然后混合液用乙酸乙酯(3×10 mL)萃取.合并有机相,并用无水Na2SO4干燥.经减压旋蒸浓缩后,用油泵抽走DMF后得粗产物,通过硅胶快速色谱法(VDCM∶VMeOH=50 ∶1)纯化,得367 mg红色固体2,产率为81%.1H NMR (400 MHz, CDCl3) δ:7.50 (d, J=2.4 Hz, 2H), 7.28 (dd, J=6.6, 2.9 Hz, 2H), 7.21~7.00 (m, 3H), 6.88 (d, J=2.4 Hz, 1H), 6.71 (dd, J=9.0, 2.5 Hz, 1H), 6.52 (dd, J=9.7, 1.9 Hz, 1H), 6.39 (d, J=1.9 Hz, 1H), 3.85 (s, 3H).
荧光素类衍生物荧光分子探针FluTPA’-1的合成:将化合物2(151 mg,0.5 mmol)加入反应管并抽充氮气3次,加入无水THF(2 mL)后,置于-78 ℃下搅拌反应10 min.在氮气保护下加入四氢铝锂(152 mg,4 mmol),搅拌5 min,反应升温至室温并继续反应30 min,溶液由橙红色变为灰色.加入10 mL 1mol/L稀硫酸溶液淬灭反应后,用乙醚(3×5 mL)萃取,合并有机相,用无水Na2SO4干燥.经减压旋蒸浓缩后,得不稳定化合物3的粗产品,然后进行下一步反应.
氮气保护下,依次加入无水碳酸钾(552 mg,4 mmol)、KI(17 mg,0.1 mmol)、配体TPA-Cl(135 mg,0.4 mmol)和无水DMF(2 mL)于装有化合物3粗产品的反应瓶中.混合液在室温下搅拌5 min后,加热至90 ℃下反应2 h后直接用油泵抽除DMF,得到粗产物,并用硅胶快速色谱法(VDCM∶VMeOH=20 ∶1)纯化,得201 mg浅棕色油状物质,产率为83%.1H NMR (400 MHz, CDCl3) δ: 8.44 (d, J=4.1 Hz, 2H), 7.58 ~7.52 (m, 3H), 7.50 (d, J=7.8 Hz, 2H), 7.42 (d, J=7.6 Hz, 1H), 7.27 (d, J=7.6 Hz, 1H), 7.18~7.13 (m, 2H), 7.10~7.01 (m, 5H), 6.80 (dd, J=8.8, 4.4 Hz, 2H), 6.64(d,J=2.5 Hz,1H), 6.54 (dt, J=5.8, 2.9 Hz, 2H), 6.45 (dd, J=8.5, 2.6 Hz, 1H), 5.07 (s, 2H), 5.02 (s, 1H), 3.83 (d, J=2.8 Hz, 6H), 3.68 (s, 3H).13C NMR (101 MHz, CDCl3) δ:159.25, 159.16, 158.87, 158.07, 156.41, 151.52, 151.49, 149.03, 147.04, 137.29, 136.56, 130.52, 130.40, 128.68, 128.38, 126.52, 123.06, 122.11, 121.85, 119.54, 117.21, 116.58, 110.72, 110.26, 102.33, 101.08, 70.78, 60.17, 60.09, 55.40, 43.16. HRMS (EI), m/z: [M+H] Calcd for C39H35N4O3607.2704, found 607.2696.
1.2.2 多步法合成荧光素母环
化合物6、8、9和10的合成参考文献[36-38, 43]的方法.
化合物11的合成:将化合物10(477 mg,1.5 mmol)和无水碳酸钾(408 mg,3 mmol)溶于3 mL 无水DMF中,加入碘甲烷(186 μL,3 mmol),反应混合液加热至55 ℃搅拌反应30 min.用10 mL饱和碳酸氢钠溶液淬灭反应,用乙酸乙酯(3×10 mL)萃取,合并有机相,用Na2SO4干燥.经减压旋蒸浓缩后,用油泵抽除DMF后得粗产品,用硅胶快速色谱法(VDCM∶VMeOH=50 ∶1)纯化,得到413 mg红色固体11,产率为83%.1H NMR (400 MHz, DMSO-d6) δ ∶7.62 (ddd, J=8.3, 7.4, 1.8 Hz, 1H), 7.35~7.27 (m, 2H), 7.25~7.16 (m, 2H), 7.05 ~6.90 (m, 3H), 6.44 (dd, J=9.7, 1.9 Hz, 1H), 6.23 (d, J=2.0 Hz, 1H), 3.92 (s, 3H), 3.71 (s, 3H).
化合物12的合成:将化合物11(166 mg,0.5 mmol)加入反应管并抽充氮气3次,加入无水THF(2 mL),随后置于-78 ℃下搅拌反应10 min,在氮气保护下加入四氢铝锂(20 mg,4 mmol),搅拌5 min.反应升温至室温并继续反应30 min,溶液由橙红色变为灰色.加入10 mL 1mol/L稀硫酸溶液淬灭反应后,用乙醚(3×5 mL)萃取,合并有机相,用无水Na2SO4干燥.经减压旋蒸浓缩后,用硅胶快速色谱法(VDCM∶VMeOH=50 ∶1)纯化,得107 mg还原型荧光素12,产率为64%.1H NMR (400 MHz, CDCl3) δ ∶7.17 (ddd, J=8.2, 7.2, 1.8 Hz, 1H), 7.06~6.88 (m, 4H), 6.85 (td, J=7.4, 1.1 Hz, 1H), 6.64 (dd, J=21.4, 2.6 Hz, 2H), 6.52 (ddd, J=38.3, 8.4, 2.6 Hz, 2H), 5.70 (s, 1H), 3.87 (s, 3H), 3.82 (s, 3H).13C NMR (101 MHz, CDCl3) δ:159.00, 156.29, 154.95, 152.04, 151.94, 135.92, 130.37, 130.12, 127.52, 121.11, 117.31, 117.10, 111.10, 110.77, 110.02, 102.91, 100.98, 55.64, 55.41, 35.76.
荧光素类探针FluTPA’-2的合成:在氮气保护下,将碳酸钾(552 mg,4 mmol)、KI(17 mg,0.1 mmol)、还原型罗丹明化合物12(150 mg,0.45 mmol)和配体TPA-Cl(130 mg,0.4 mmol)依次加入反应瓶中,最后加入2 mL无水DMF.混合液在室温下搅拌5 min,随后加热至90 ℃继续反应2 h.待冷却至室温后,用油泵抽除DMF得粗产品,并通过硅胶快速色谱法(VDCM∶VMeOH=20 ∶1)纯化,得211 mg浅棕色固体,即荧光素类探针FluTPA’-2,产率为83%.1H NMR (400 MHz, DMSO-d6) δ ∶ 8.54~8.43 (m, 2H), 7.84~7.70 (m, 3H), 7.57 (dd, J=17.6, 7.8 Hz, 3H), 7.36 (d, J=7.6 Hz, 1H), 7.24 (ddd, J=7.5, 4.9, 1.2 Hz, 2H), 7.13 (dt, J=8.7, 4.5 Hz, 1H), 7.03~6.91 (m, 3H), 6.86~6.74 (m, 3H), 6.73 ~6.52 (m, 3H), 5.58 (s, 1H), 5.14 (s, 2H), 3.85~3.71 (m, 12H).13C NMR (101 MHz, DMSO-d6) δ:159.32, 159.24, 159.16, 158.12, 156.33,151.88, 151.85, 149.28, 137.92, 137.00, 135.85, 130.42, 130.34, 129.69, 128.11, 123.08, 122.61, 122.04, 121.20, 120.41, 117.42, 116.85, 112.10, 111.19, 110.57, 102.32, 101.26, 70.97, 59.87, 59.74, 56.11, 55.69, 35.81. HRMS (EI), m/z: [M+H] Calcd for C40H37N4O4637.2809, found 637.2803.
1.3 荧光光谱测定
探针分子储备液配制:称取一定量的FluTPA’-1和FluTPA’-2溶解在HEPES缓冲溶液(2 μmol/L HEPES,pH=7.2, CH3CN-H2O(V/V=24 ∶1))中,配制成浓度分别为5 μmol/L和1 μmol/L的探针分子储备液.
金属离子储备液制备:准确称量一定量的Co(NO3)2·6H2O、Zn(NO3)2·6H2O、Fe(NO3)3·9H2O、NaNO3、Ni(NO3)2·6H2O、Cu(NO3)2·3H2O、Cr(NO3)3·9H2O、Bi(NO3)3·5H20、AgNO3、MnCl2·H2O、SnCl2、AlCl3、PdCl2、FeCl2·4H2O及C8H12CuF6N4P等无机盐类,溶解于HEPES 缓冲溶液 (2 μM HEPES,pH=7.2, CH3CN-H2O(V/V=24 ∶1))中,配制成浓度分别为2 μmol/L和5μmol/L的各离子储备液.
荧光光谱测定条件:室温下,狭缝宽度为2 nm,激发波长为460 nm,测试荧光波长范围为350~750 nm.除测试与Cu+最佳反应时间的实验外,其他加有金属离子的测试液的光谱均在探针离子与金属离子混合2 h后进行.
2 结果与讨论
2.1 合成过程的尝试及遇到的问题
合成过程中主要尝试了一步缩合法和多步合成法构建荧光素母环.其中,用一步缩法合成了9-Ph取代的 FluTPA’-1.虽然此反应步骤简短,操作简单,但反应底物具有较大局限性,对于富电子的芳香醛不太适用;此外,其产率较低.而用多步合成法制备FluTPA’-2时,先合环制备荧光酮,之后再与相应的格氏试剂反应制备出各种9号位芳香取代的荧光素反应.整个反应的步骤虽较多,但均为成熟的反应类型.因此,改变格氏试剂可以制备9号位不同取代的产物.
2.2新型荧光素类Cu+荧光探针的性能研究
文中对荧光探针的如下性能进行了测试:(1)具有不同9号位取代芳基的荧光素探针分子(探针-1和探针-2)对Cu+的响应;(2)对pH稳定性的测试;(3)稳定性测试;(4)离子选择性;(5)与Cu+络合的工作曲线(Job’s plot).
2.2.1 探针分子络合Cu+后的荧光强度变化
首先测试了FluTPA’-1(9-Ph)或FluTPA’-2(9-(2-OMe)Ph)的探针分子与Cu+反应后的荧光强度变化(图3),并由此得出两种探针分子中9-Ar性质对于此类探针性质的影响.由测试结果可发现:空白的FluTPA’-1和FluTPA’-2溶液在λ≥500 nm时没有明显的荧光变化.但是,加入1 equiv. Cu+后,FluTPA’-1在λ=533 nm处有明显的荧光发射.而荧光探针FluTPA’-2在加入1 equiv. Cu+后没有表现出显著的荧光增强.因此,和文献[32]的FluTPA的探针相比:FluTPA’-2的9位苯基的邻位上有供电能力强于Me的基团的OMe存在时,该类探针络合Cu+后,其与TPA相连的苄氧基不能及时断裂,生成相应的荧光素,而实现探针分子的荧光“开启”状态.当9号位Ph上无取代基时,络合Cu+后发现了反应,并且实现了荧光发射波长的红移(从513 nm到533 nm变化).这证实了设计时的思路:没有任何取代的苯基与荧光素母环更倾向处于同一平面,从而能实现最终的荧光素类衍生物具有更大的共轭面,进而引起发射波长的红移和荧光强度的增加.
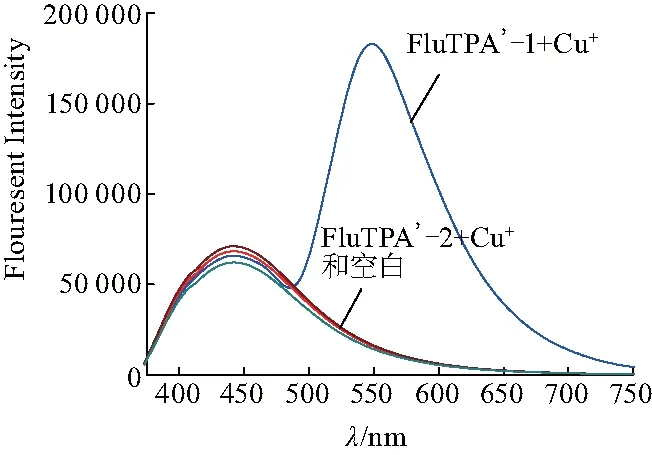
图3 FluTPA’-1与FluTPA’-2对Cu+的荧光响应Fig.3 Fluorescence response of FluTPA’-1 and FluTPA’-2 to Cu+
2.2.2 FluTPA’-1在不同pH下的稳定性
配置pH值依次为1.0、2.1、3.0、4.1、5.0、6.0、7.1、8.0、9.0、10.0的1 μmol/L的FluTPA’-1(加有1equiv. Cu+)的储备液(2 mM HEPES,pH=7.2, CH3CN-H2O(V/V=24 ∶1)),测试其荧光发射光谱,见图4.由图可知:随着pH的变化,探针分子的荧光强度也会随之变化.pH在1~5之间时,荧光强度随着pH值的增大略微增强;当5
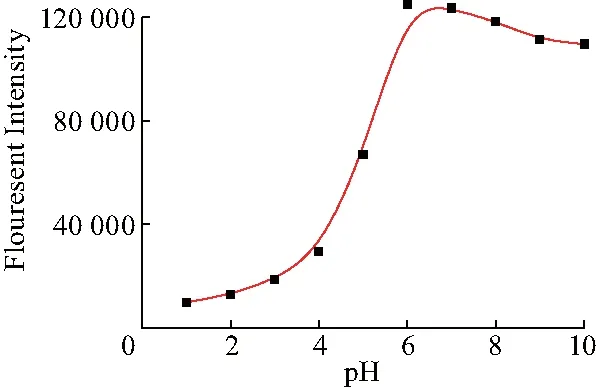
图4 pH对探针分子FluTPA’-1荧光强度的影响Fig.4 Effect of pH on the fluorescence intensity of the FluTPA’-1
2.2.3 FluTPA’-1与Cu+反应时间的检测
每隔2 min测试1次1 μmol/L的FluTPA’-1与1equiv. Cu+离子的混合溶液(2 mM HEPES,pH=7.2, CH3CN-H2O (V/V=24 ∶1))的荧光发射光谱(图5).从图中可以看出:随着络合时间的延长,在λ=533 nm处,荧光强度也随之增强,当络合时间超过120 min时,荧光强度趋于稳定.因此,此探针分子FluTPA’-1与Cu+的反应在2 h内几乎进行完全.随后的测试均在探针分子FluTPA’-1与Cu+混合2 h后进行.
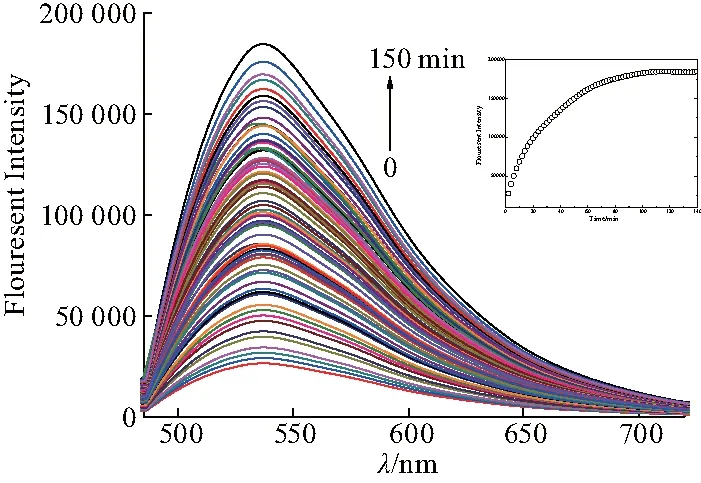
图5 FluTPA’-1与Cu+络合时间稳定性Fig.5 Complexation time stability of FluTPA’-1 with Cu+
2.2.4 FluTPA’-1的离子选择性
测试了荧光探针FluTPA’-1对不同金属离子的选择性.首先,向FluTPA’-1的空白测试液中分别加入各离子储备液(Co(NO3)2·6H2O、Zn(NO3)2·6H2O、Fe(NO3)3·9H2O、NaNO3、Ni(NO3)2·6H2O、Cu(NO3)2·3H2O、Cr(NO3)3·9H2O、Bi(NO3)3·5H20、AgNO3、MnCl2·2H2O、SnCl2、AlCl3、PdCl2、FeCl2·4H2O),混合均匀配制成浓度为5 μmol/L FluTPA’-1+Mn+的测试溶液,测试其荧光光谱,结果见图6.
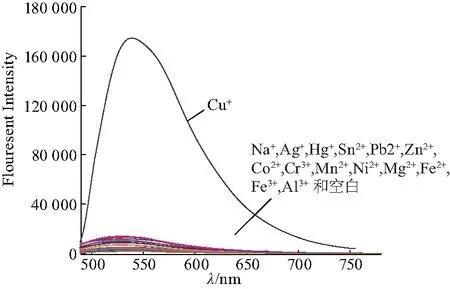
图6 FluTPA’-1离子选择性Fig.6 Ion selectivity of FluTPA’-1
从图中可看出,加入Cu+的测试液的荧光强度明显高于加入其他金属阳离子的测试液的荧光强度,FluTPA’-1对Cu+表现出极好的选择性.
2.2.5 FluTPA’-1与Cu+反应的Job’s plot实验
为了进一步确定FluTPA’-1与Cu+络合的最佳反应比例,进行了Job’s Plot实验.用HEPES 缓冲液 (2 mmol/L HEPES,pH=7.2, CH3CN-H2O(V/V=24 ∶1))配置了一系列不同浓度比的FluTPA’-1与Cu+混合溶液,并保持其总浓度为20 μmol/L.所测试的溶液中两种物质的比例分别为[Cu+]/([Cu+]+FluTPA’-1)=0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9.其荧光强度见图7.由图可知:当[Cu+]/([Cu+]/FluTPA’-1+[Cu+])=0.5时,出现最大荧光强度.因此每个FluTPA’-1分子络合一个Cu+就会反应生成荧光素.
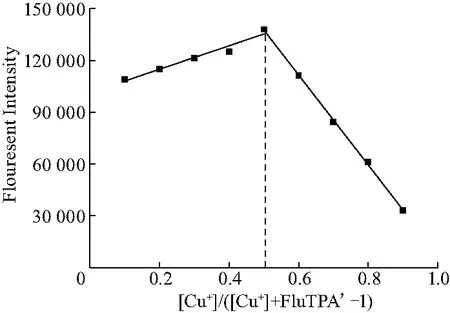
图7 FluTPA’-1与Cu+络合后的Job’s plot实验Fig.7 Job’s plot experiment of FluTPA’-1 complexed with Cu+
3 结论
采用不同方法合成荧光素母环各有利弊:对于9号位-简单芳烃取代的荧光素,可以用一步法构建9-Ar荧光素;当9-Ar上有供电子基团特别是如OCH3等强供电子基团时,用一步法合成时所用富电子芳香醛不稳定、易聚合.因此先合成荧光酮,再与相应的格氏试剂反应合成相应的荧光素衍生物.合成的两个化合物FluTPA’-1和FluTPA’-2,仅有苯基合成的探针分子FluTPA’-1对Cu+有荧光响应.与类似荧光素探针相比,在保证了相同反应活性的前提下,成功实现了荧光发射波长的红移(513-533 nm).而探针分子FluTPA’-2因其苯基邻位存在甲氧基,导致共轭平面内电子云密度较大,影响FluTPA’-2与Cu+络合后C-O键的断裂,无法实现探针分子的荧光“开启”状态.同时,通过检测结果可知,探针分子FluTPA’-1在pH约为7时与1equiv. 的Cu+络合,2 h左右会反应生成荧光素,从而显示出荧光“开启”状态.
