MgH2-Na2Ti3O7微米棒复合材料的吸氢性能及其改性机制
2020-09-08张刘挺蔡泽亮颜年华
张刘挺, 季 亮, 蔡泽亮, 孙 泽, 颜年华
(江苏科技大学 能源与动力工程学院,镇江 212003)
如今,能源危机和环境问题日益严峻,寻找出一种经济有效且可再生的能源来替代化石燃料是创造可持续和清洁世界的迫切需求.在许多新能源载体中,由于氢气能通过燃料电池等设备转化为电能而不排放污染物,因此被认为是最有前景的能源之一[1].然而,“氢经济”的实现需要一种高能量密度的安全储氢技术,而这目前仍然是全球科学家共同面临的挑战.由于氢化镁(MgH2)的储氢容量高(110g H2/L和7.6%H2)和优异的可逆性[2],并且可以直接由储量丰富的镁与氢反应形成,成为了近几十年来储氢材料的研究热点.然而,过于稳定的热力学性能和缓慢的动力学性能阻碍了MgH2的实际应用,因此需要利用适当的技术手段来改善其吸氢性能.近年来,国内外学者通过纳米化[3]、多元合金化[4]、催化掺杂[5]等多种途径对MgH2体系的吸氢热力学与动力学性能进行调控研究,均取得了一定的进展.在所有研究中,经过过渡金属和其化合物改性后的MgH2系统表现出更好的储氢性能,例如,文献[6]将FeS2与MgH2复合制造出微米球,通过在原位形成的含Fe物质和具有高催化活性的MgS提供更多的氢扩散通道和活性位点来提高MgH2的吸氢性能.MgH2-16.7%FeS2复合材料在150 ℃时可以吸收3.71%H2,吸氢速率是球磨后纯MgH2的3.59倍.与金属催化剂相比,金属氧化物价格更便宜,由于其具有脆性,通过机械球磨技术更易于均匀地分散在MgH2中[7].文献[8]发现MgH2的吸氢动力学性能可以通过TiO2,V2O5,Cr2O3,Mn2O3和Fe3O4这样的过渡金属氧化物改性而大幅度提高.文献[9]证实了TiO2的催化效果与其形貌相关,并发现Na含量较高的钛酸盐微米棒可以更好地提高MgH2的储氢性能.
受上述研究的启发,认为Na2Ti3O7微米棒应该对MgH2的吸氢反应具有较好的催化作用.因此,文中制备了Na2Ti3O7微米棒并通过机械球磨掺杂到MgH2中,期望微米化的Na2Ti3O7对MgH2的储氢性能起到很好的催化作用.文中系统研究了微米Na2Ti3O7掺杂MgH2体系的吸氢性能并就其催化机理进行了详细地探讨.
1 实验
1.1 Na2Ti3O7微米棒的合成
通过固相法合成Na2Ti3O7微米棒.即将1 g TiO2和0.36 g NaOH(Alfa Aesar)在球磨罐中混合,并在行星式球磨机中以400 r/min的转速球磨4 h.球磨后的粉末在空气中以750 °C的温度煅烧20 h.
1.2 MgH2-Na2Ti3O7复合材料的合成
将制备好的Na2Ti3O7微米棒在球磨罐中与MgH2(Alfa Aesar)混合,其质量比为5 ∶95.然后将混合物在1 MPa H2压力下以400 r/min转速球磨2 h,球料比为40 ∶1,得到MgH2-Na2Ti3O7微米管复合材料.为了避免空气和水分的污染,样品的前期混合先在充满Ar的手套箱中进行,其后向球磨罐中充入氢气.
1.3 样品表征
样品的X射线衍射分析(XRD)测试在X'Pert Pro (PANalytical, the Netherlands)型衍射仪上进行,采用40 kV、40 mA的Cu Kα(λ=0.154 05 nm)辐射,以连续扫描方式采样,扫描速度为4 °/min和0.02°/step,扫描范围是10°~90°.在样品的转移和扫描过程中为了避免受到氧气和水气的污染,采用了充满氩气的密封装置.用配备了X射线能谱仪(EDX,HORIBAX-MAX)的透射电子显微镜(TEM,Tecnai G2 F20,工作电压200 kV)进一步分析样品的形貌和成分.所用TEM样品制备都在手套箱内进行,且同样在转移过程中使用特殊保护装置与氩气吹扫,防止样品与水或者氧气反应.采用实验室自制的Sieverts式储氢性能测试仪测试球磨后的MgH2-Na2Ti3O7微米棒复合样品和纯MgH2的储氢性能.样品吸氢动力学性能测试采用等温吸氢方式,抽真空完毕后设置温控仪以固定升温速率加热到预定温度(50 ℃,150 ℃和275 ℃),调节反应器外部压力使氢压在反应器打开瞬间能够达到实验设计值(3.2 MPa).样品开始吸氢后,记录下整个吸氢过程氢压随时间的变化,绘制吸氢动力学曲线.值得注意的是,由于测试的样品量较少,为了避免测试时的误差,必须保证测试环境温度的稳定并在测试前对测试装置进行检漏以确保密闭性.计算储氢量时包含催化剂的质量.
2 结果与讨论
2.1 Na2Ti3O7的微观结构和形貌
图1为通过固相法制备的Na2Ti3O7微米棒的XRD图谱,从XRD图谱中可以看出,所制备的催化剂与Na2Ti3O7完全匹配.
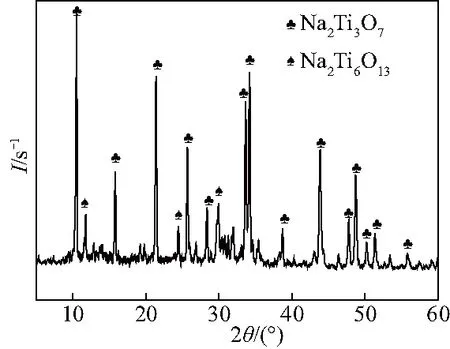
图1 制备的Na2Ti3O7微米棒XRD图谱Fig.1 XRD pattern of prepared Na2Ti3O7 microrods
此外,XRD图谱还表明所制备的Na2Ti3O7中存在少量的Na2Ti6O13,这与先前的报道一致[10].图2为制备的Na2Ti3O7的TEM图像,表明所制备的Na2Ti3O7具有光滑表面,呈棒状形态(直径在0.1~0.5 μm).TEM和XRD结果均表明成功制备出了Na2Ti3O7微米棒.
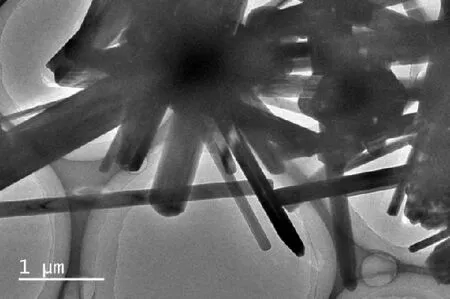
图2 制备的Na2Ti3O7微米棒TEM图Fig.2 TEM pattern of prepared Na2Ti3O7 microrods
2.2 MgH2-Na2Ti3O7 微米棒复合材料的微观结构和形貌
为了研究Na2Ti3O7对MgH2吸氢性能的影响,采用球磨法将Na2Ti3O7微米棒加入到MgH2中.图3是纯MgH2和球磨后的MgH2-Na2Ti3O7微米棒复合材料的XRD图谱.由于所购买的MgH2存在杂质,所有样品的XRD图谱都显示出Mg的存在.由图3清楚地发现复合物的衍射峰比商用MgH2的峰宽,这是由于球磨过程中晶粒细化和剧烈碰撞引起的位错增加所致[11].此外,在MgH2-Na2Ti3O7微米棒复合材料中,可以很容易地区分出Na2Ti3O7.从XRD分析可知,球磨后的复合材料中没有明显的化学反应,这表明MgH2-Na2Ti3O7微米棒复合材料仅仅是物理混合物.
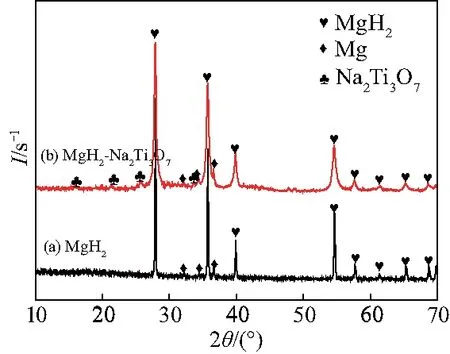
图3 MgH2和MgH2-Na2Ti3O7微米棒复合材料的XRD图谱Fig.3 XRD patterns of MgH2 and MgH2-Na2Ti3O7 microrods composites
采用SEM和TEM研究了球磨后MgH2-Na2Ti3O7微米棒复合材料的形貌和微观结构,如图4,5.在图中可以观察到复合材料的颗粒尺寸明显减小(从块状的约20 μm到掺杂的0.5 μm)[12],从图6的EDX映射数据可以看出,Na,Ti,O元素在所测试区域均匀分布,表明Na2Ti3O7微米棒是均匀分布在MgH2基体中,这将促进MgH2的吸氢反应[10].

图4 纯MgH2的SEM图Fig.4 SEM image of pure MgH2
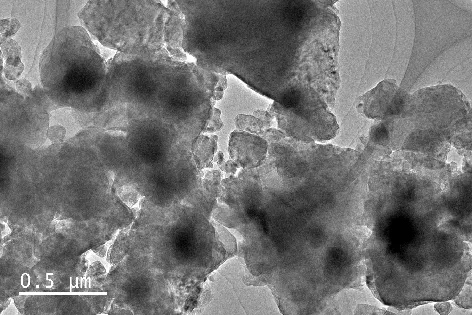
图5 MgH2-Na2Ti3O7微米棒复合材料TEM图Fig.5 TEM image of MgH2-Na2Ti3O7 microrods composite
2.3 Na2Ti3O7微米棒对MgH2吸氢性能的催化效果及其机理
为了比较Na2Ti3O7微米棒与MgH2复合后的吸氢性能,将纯MgH2与MgH2-Na2Ti3O7微米管复合材料在相同条件下放氢后分别在275 ℃,氢压为3 MPa下进行等温吸氢测试,结果如图7.可以看出,MgH2在30 s内仅仅吸收0.1% H2,加入Na2Ti3O7微米棒后在相同时间内可吸收5.3% H2.将MgH2-Na2Ti3O7微米棒复合样品的放氢产物分别在50 ℃,150 ℃和275 ℃下进行等温吸氢实验,氢压为3.2 MPa,结果如图8.复合样品在275 ℃和150 ℃下吸收3% H2的时间分别为10 s和15 min,甚至在低至50 ℃下30 min内亦可吸收1% H2.上述结果表明,在加入Na2Ti3O7微米棒后,MgH2的吸氢性能明显提高,且随着吸氢温度的升高,复合材料能显示出更快的动力学性能.
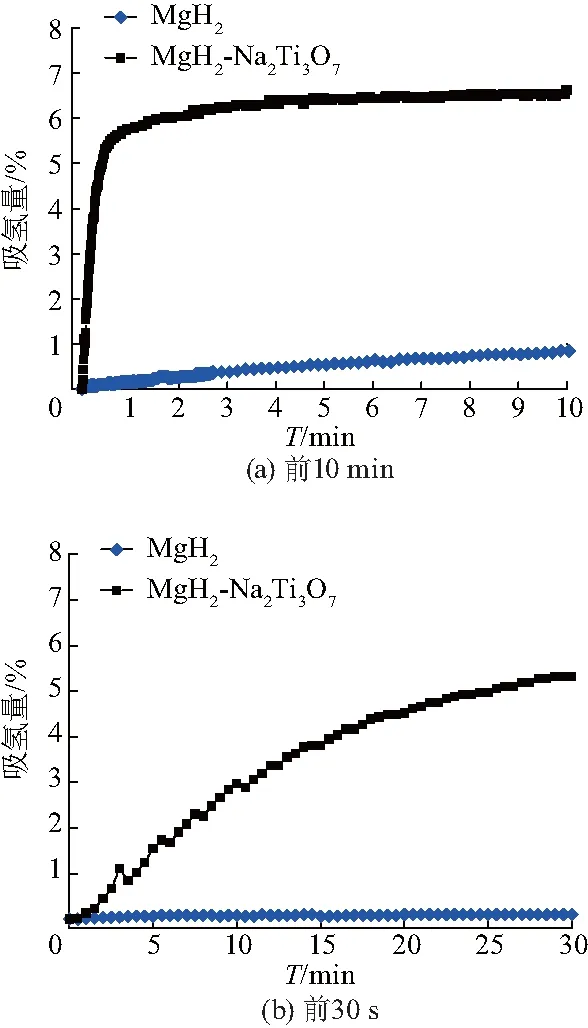
图7 放氢后的MgH2和MgH2-Na2Ti3O7微米棒复合材料的等温吸氢曲线Fig.7 Isothermal absorption curves of dehydrogenated
sample of MgH2and MgH2-Na2Ti3O7microrods composites
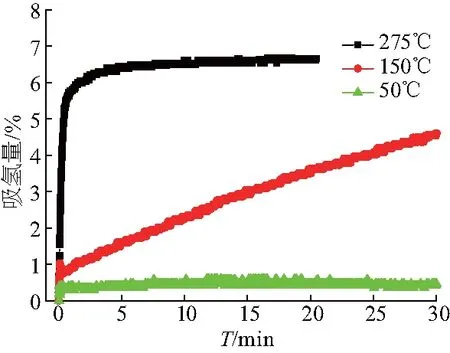
图8 放氢后的MgH2-Na2Ti3O7微米棒复合材料在不同温度的等温吸氢曲线Fig.8 Isothermal absorption curves of MgH2-Na2Ti3O7 microrods composites at different temperatures
上述实验结果表明Na2Ti3O7微米棒对提高MgH2的吸氢动力学性能具有优异的效果,但是其催化机理仍不清楚.为了研究Na2Ti3O7微米棒的催化机理, 对吸氢后的MgH2-Na2Ti3O7微米棒复合材料进行了微结构表征.图9是吸氢后MgH2-Na2Ti3O7微米棒复合材料的XRD图谱,图9(a)表明MgH2是吸氢状态下的主相,由于Na2Ti3O7微米棒掺杂量低,为了清楚地观测Na2Ti3O7微米棒的循环演变过程,放大图9(a)虚线矩形部分,如图9(b).值得注意的是,吸氢复合物中形成了一个TiH2的峰,文献[13]证明它对MgH2的吸氢动力学性能有积极的影响.
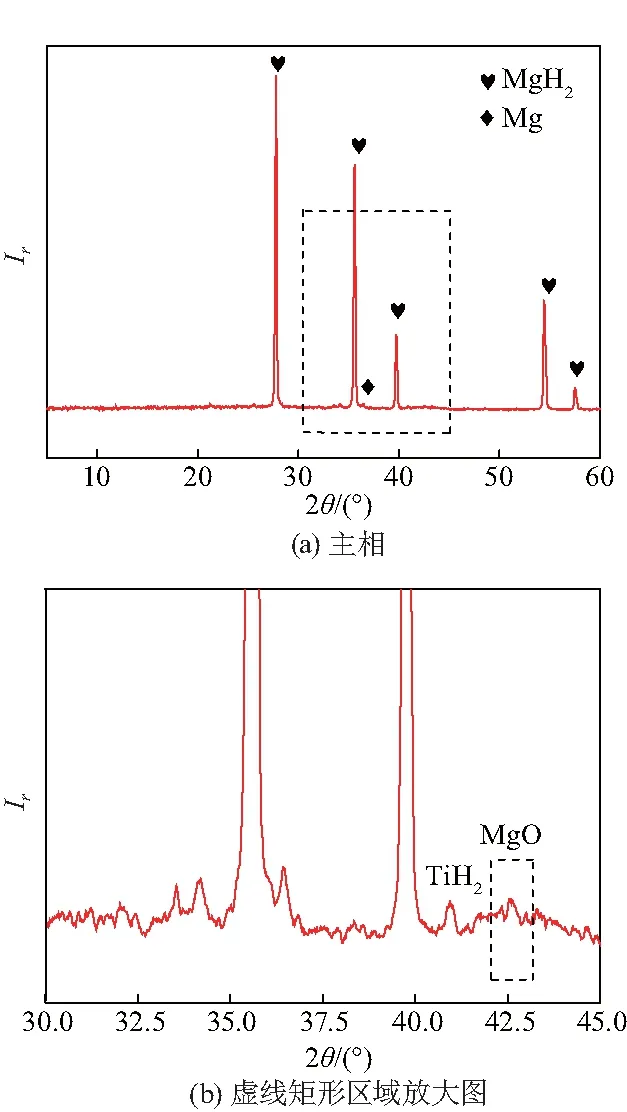
图9 吸氢后MgH2-Na2Ti3O7微米棒复合材料的XRD图谱Fig.9 XRD patterns for hydrogenated MgH2-Na2Ti3O7 mcrorods composite
综合上述分析,MgH2的吸氢动力学性能显著提高可归因于以下原因:球磨过程中Na2Ti3O7颗粒尺寸达到微米级别,且均匀分布在MgH2中,使得催化剂与基体之间的连接增强,以此提高催化效果[14].另外,循环过程中在原位形成的TiH2可作为“氢泵”[13],有效提高MgH2的吸氢动力学性能.
3 结论
文中成功合成了Na2Ti3O7微米棒催化剂,并将其用于改性MgH2的吸氢性能.Na2Ti3O7微米棒对MgH2的吸氢动力学性能显示出了优异的催化作用, MgH2-Na2Ti3O7微米棒复合材料可在275 ℃下10 s内吸收3%的H2,甚至可以在50 ℃的低温下30 min内吸收1%的H2.MgH2吸氢性能的大幅度提高归因于催化剂在MgH2中的均匀分布以及TiH2的生成.文中的创新性在于采用Na2Ti3O7微米棒作为催化剂,通过球磨实现Na2Ti3O7的均匀分布,并在氢化物表面提供大量微米通道,从而明显提高了MgH2的吸氢性能.
