超声造影在鉴别腮腺多形性腺瘤病理分型中的价值
2020-09-08张芳芳王宏桥贾暮云齐晓杰高杏娜孙杨
张芳芳,王宏桥,贾暮云,齐晓杰,高杏娜,孙杨
1.青岛大学医学部临床医学院,山东青岛 266000;2.青岛大学附属医院腹部超声科,山东青岛 266000;3.青岛大学附属医院口腔颌面外科,山东青岛 266000;4.青岛大学附属医院病理科,山东青岛 266000;*通讯作者 王宏桥 qyfywhq@163.com
多形性腺瘤(pleomorphic adenoma,PA)是涎腺常见的肿瘤。在涎腺良性肿瘤中,位于腮腺的PA占65%~80%[1]。PA 由上皮与间质构成,上皮和间质成分比例的不同与患者预后密切相关[2]。目前临床主要采用CT 和MRI 对PA 进行诊断[3-4];也有研究开始应用超声对常见的腮腺良性肿瘤进行诊断[5]。但超声诊断PA 的病理分型研究较少,常规二维超声难以预测PA 的病理分型。本研究拟分析不同病理分型PA 的超声造影时间-强度曲线(TIC)及动态血管模式曲线(dynamic vascular pattern curve,DVPC),探讨超声造影参数及其DVPC 在诊断腮腺PA 组织病理学分型中的价值。
1 资料与方法
1.1 研究对象 回顾性分析2015年9月—2019年5月于青岛大学附属医院经超声造影检查并具有手术病理结果的52 例腮腺PA 患者,其中男16 例,女36 例;年龄21~67 岁,平均(44.1±12.3)岁。由2 位病理科主治医师对病理切片进行评估,并根据间质含量分为间质缺乏型16 例、丰富型26 例和中间型10 例。检查前患者均签署造影检查知情同意书。排除标准:①复发性腮腺PA;②临床资料不全者;③未行手术或经穿刺活检证实为PA 者。
1.2 仪器与方法 使用GE Logiq E9 超声诊断仪,探头9L,探头频率9 MHz,机械指数0.09。超声造影剂采用SonoVue,用5 ml 生理盐水配置振荡摇匀至混悬液备用。首先行常规超声检查,观察病灶大小、位置、形态等;选择病灶最佳切面并保持探头位置不变,行超声造影检查。推注造影剂的同时启动计时器,连续获得2 min 造影动态图像,并以DICOM 原始数据格式存盘。
1.3 图像分析 所有超声造影及图像分析由2 名经验丰富的超声主任医师共同完成。将超声造影动态图像导入SonoLiver 软件进行分析。分别选择病灶区及参考区,选取病灶时尽可能包含多的肿瘤区域,但不包括坏死或囊性区域;参考区选择应与病灶区在相同深度的正常腮腺区域内,并尽可能在避开大血管区域的同时保证取样区域面积相同。获取TIC 参数及DVPC,要求图像拟合度>75%。TIC 相关参数包括峰值强度(maximum intensity,IMAX)、上升时间(rise time,RT)、达峰时间(time to peak,TTP)、平均渡越时间(mean transit time,MTT)。计算其他造影参数:峰值强度减半时间(DT/2),即造影剂廓清至峰值强度50%时的时间;上升速率(ascending slope,AS),即造影剂灌注从峰值强度10%~90%的平均曲线斜率;下降速率(descending slope,DS),即造影剂灌注从峰值强度下降至50%的平均曲线斜率的绝对值。
DVPC 是以周围正常腮腺增强强度为横轴,PA 增强强度为纵轴,描绘PA 与正常腮腺的增强程度对比的曲线。DVPC 曲线分为以下4 种类型。①正向波:病灶区的TIC 曲线始终高于参考区;②正负双向波:病灶区的TIC 曲线前一部分高于参考区,后一部分由于病灶区廓清的快,低于参考区;③负正双向波:病灶区的TIC 曲线前一部分低于参考区,后一部分由于病灶区廓清的慢,高于参考区;④负向波:病灶区的TIC 曲线始终低于参考区。
1.4 病理分型 根据PA 的间质含量对整个病变的面积的占比分为3 种类型:肿瘤间质含量<40%定义为缺乏型,间质含量40%~60%定义为中间型,肿瘤间质含量>60%定义为间质丰富型[6]。
1.5 统计学方法 采用SPSS 20.0 软件,非正态分布的连续变量以M(P25,P75)表示,组间比较采用Mann-Whitney 秩和检验;计数资料组间比较采用χ2检验。采用Spearman 相关法计算PA 内的间质量与超声造影参数之间的相关性。P<0.05 表示有统计学意义。
2 结果
2.1 超声造影定量分析结果 PA 间质量与AS、DS和IMAX 均呈显著负相关(r=-0.674、-0.629、-0.770,P<0.001;图1)。间质含量与RT、TTP、mTT、DT/2无显著相关性(P>0.05)。间质缺乏型与中间型和丰富型AS 比较,差异均有统计学意义(P<0.001);间质丰富型DS、IMAX 与中间型和缺乏型比较,差异均有统计学意义(P<0.001,表1)。
2.2 DVPC 分析 3 种病理分型的PA 患者DVPC类型比较,差异有统计学意义(P<0.001,表2)。
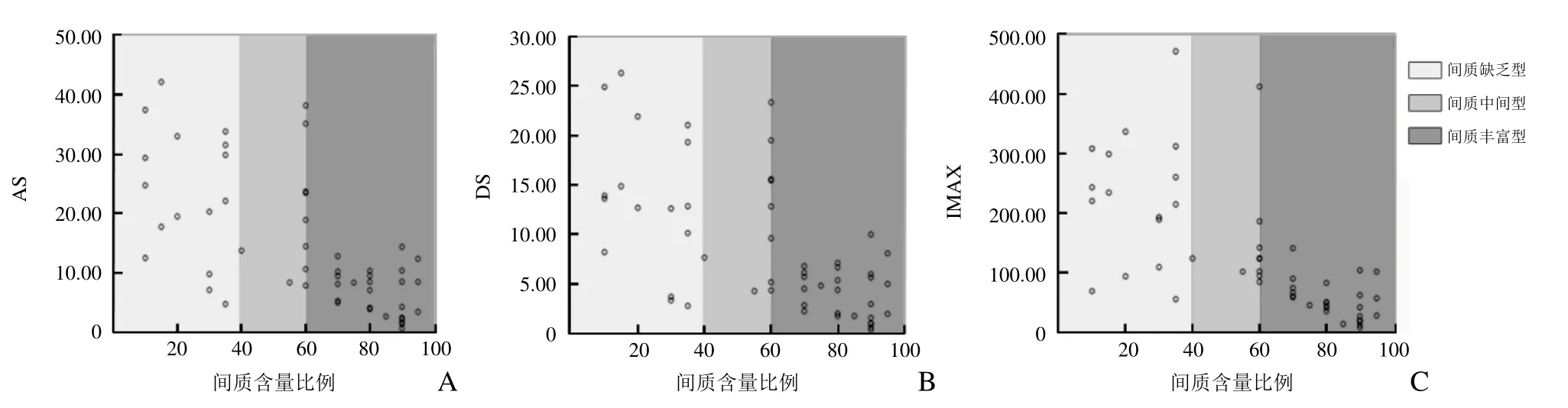
图1 AS、DS、IMAX 与PA 间质含量比例的相关性。A~D 分别为AS、DS、IMAX 与间质含量比例的关系
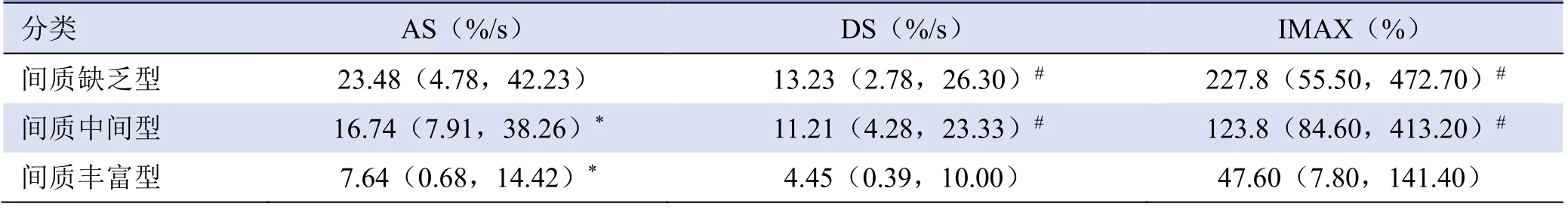
表1 间质丰富型、中间型及间质缺乏型PA 的AS、DS、IMAX 比较[M(P25,P75)]
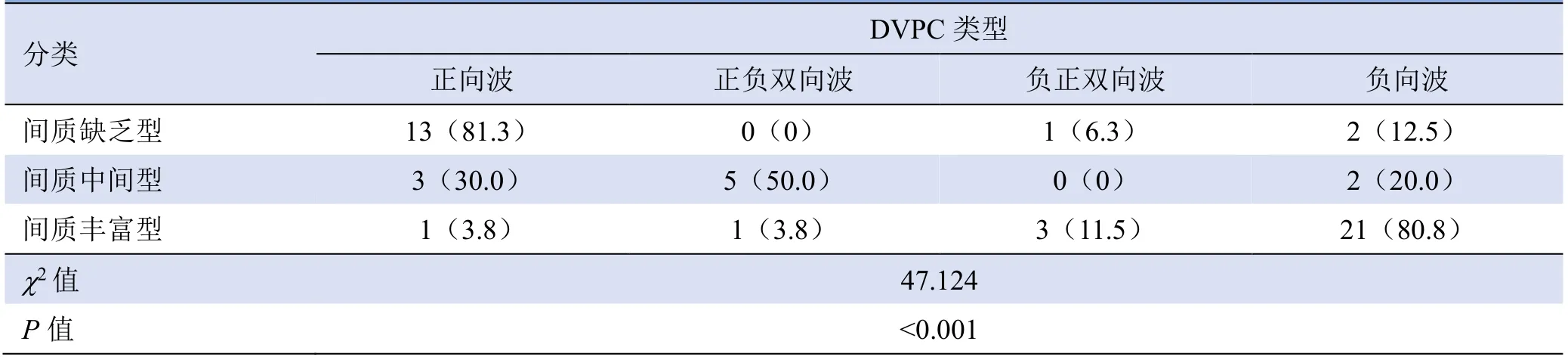
表2 3 组PA 患者DVPC 类型比较[例(%)]
3 讨论
PA 常发生于腮腺,主要由包膜、上皮细胞和肌上皮细胞、间叶或间质成分组成[7],其中间质成分是其重要组分,根据形态可分成黏液样、软骨样或透明样间质,有时能构成肿瘤的大部分。
对于PA 具体的病理分型,早期Seifert 等[8]根据间质与上皮成分的比例分成4 类:Ⅰ型为经典的PA,间质构成肿瘤的30%~50%;Ⅱ型PA 的间质量约占肿瘤的80%;Ⅲ型PA 的间质量占肿瘤的20%~30%;Ⅳ型PA 的间质量与Ⅲ型间质比例相似,但上皮结构相对单一。Handa 等[6]根据标准细胞学涂片区域面积,将PA 分为间质缺乏型(间质含量占肿瘤面积<40%)、间质中间型(间质含量占肿瘤面积40%~60%)、间质丰富型(间质含量占肿瘤面积>60%)。对于PA 的处理常采用手术切除,目前最广泛接受的手术方式是面神经解剖的部分或完全浅表腮腺切除术;也有选择部分或全腮腺切除术和囊外剥离术[9],复发率为2%~45%[10-12]。一般认为间质丰富型相对较易复发,推测原因为此型肿瘤通常具有更广泛区域的局灶性包膜缺失和薄包膜存在[13-14]。细胞丰富型PA(即间质缺乏型)的局灶性包膜缺失率为34%,细胞缺乏型PA(即间质丰富型)的局灶性包膜缺失率达74%。Stennert 等[14]研究发现,间质丰富型的肿瘤中伪足和子瘤的发生率也明显较高。
因此,区别不同病理类型对于外科手术切除腮腺范围至关重要。90%以上的腮腺肿瘤位于腮腺浅叶,超声作为一种无侵入性且实时成像技术,几乎是评估腮腺疾病的首选检查[15];但常规二维超声无法准确区分PA 的病理类型[16]。超声造影可以描述组织微血管结构和实时的组织血流灌注,为PA 的分型提供了比较量化的指标[17]。本研究除坏死或囊性区域外,所有肿瘤区域均尽可能选取,同时在等深的正常腮腺区域内选取参考对照区,并排除大血管区域的干扰。结果显示,PA 的间质含量与AS、DS、IMAX 均呈显著相关性;间质丰富型PA 患者的AS、DS 显著低于中间型和间质缺乏型,且间质丰富型的TIC 曲线的上升支及下降支相对中间型和间质缺乏型比较平缓,提示间质丰富型PA 的TIC 曲线呈“慢进慢退”型,间质缺乏型PA 的TIC 曲线呈“快进快退”型;这可能是由于间质丰富型PA 中间质含量多,血管密度低而血供不丰富所致。为进一步评估间质量对微血管密度的影响,本研究对IMAX 进行分析。通常血管密度越高,造影剂流量越多,相应的峰值强度也越大[5]。本研究发现,间质丰富型肿瘤中IMAX 低于中间型和间质缺乏型,提示间质丰富型PA 的微血管密度和灌注显著低于中间型和间质缺乏型。DVPC 通过建立参考区基线,将感兴趣区信号强度与参考区对比,基线以上为高增强,可直观地显示感兴趣区增强水平的动态变化[18]。PA不同病理分型间DVPC类型也存在差异,其中81.3%的间质缺乏型表现为正向波,提示该分型的微血管密度较周围正常组织高;80.8%的间质丰富型表现为负向波,即该分型腺瘤的微血管密度较周围正常组织低;50%的中间型呈负正双向波,即TIC 曲线前部分高于参考区,后部分低于参考区,提示病灶区造影剂廓清比正常腮腺组织区较快。鉴于此,DVPC 的波形可以对预测腮腺PA 术前的病理类型提供较大的帮助。
本研究样本量较少,无法确定AS、DS、IMAX 以及DVPC 等指标与PA 间质含量间的具体数量关系;且与CT 相比,诊断准确率仍需进一步提高。但超声造影因其方便性及廉价性,可大量应用,因此,进一步提高其诊断精度或结合其他方法进行术前PA 的病理分型诊断很有必要。
总之,通过术前行超声造影分析AS、DS、IMAX以及DVPC 曲线等指标,判断PA 的间质含量及相应的病理分型,对指导外科手术切除范围及引导细针穿刺细胞学检查可能具有重要意义。
