猪瘟病毒和牛病毒性腹泻病毒双重荧光RT-PCR 检测方法的建立
2020-09-07张宏伟王建华陈本龙麻丽丹
张宏伟,王建华,陈本龙,麻丽丹,宋 喆,蒲 静
(1.西华师范大学生命科学学院,四川南充 637002;2.天津海关,天津 300456;3.丹东海关,辽宁丹东 118002;4.北京海关,北京 100026)
在病毒学分类中,猪瘟病毒(classical swine fever virus,CSFV)和牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)均属于黄病毒科瘟病毒属成员,为单股、正链RNA 病毒,具有相似的基因组结构,其基因组全长约12.3 kb,由5'非编码区(5'UTR)、1 个大的开放阅读框和3'非编码区(3'UTR)组成,编码1 个含有约4 000 个氨基酸的前体多聚蛋白。该前体多聚蛋白在宿主细胞信号肽酶和病毒非结构蛋白的作用下,被加工为病毒的各种结构蛋白和非结构蛋白[1]。
猪瘟(classical swine fever,CSF)是由CSFV引起猪的一种急性、热性和高度接触性传染病,曾给我国养猪业造成很大经济损失[2]。自20 世纪50年代以来,通过实施CSFV 兔化弱毒苗免疫接种,我国CSF 疫情已得到有效控制,发病率和死亡率显著降低,但以非典型、低龄化和散发性为特点的非典型CSF 在各地时有发生[3]。早在1971年,Stewart 等[4]就观察到BVDV 对猪的自然感染现象;1996年,王新平等[5]从我国疑似CSF 病料中检出BVDV。近年来猪的BVDV 感染在我国部分地区猪群中呈散发性、地方性流行态势[6-8]。研究发现,猪感染BVDV 后可产生类似慢性CSF 的临床症状和病理变化,从而干扰CSF 的临床诊断[9]。此外,猪感染BVDV 后产生的BVDV 抗体对CSFV 有一定的抑制作用,会影响CSF 疫苗的免疫效果[9]。因此,了解猪群中的BVDV 感染状况,对于防范猪群BVDV 感染和做好CSF 防制和净化工作具有重要指导意义。
近年来,国内外研究人员根据CSFV 和BVDV 基因组各自的5'端的保守区,已建立了多种单一的检测CSFV 和BVDV 的荧光RT-PCR 方法[10-13],而同时检测猪源临床样本中的CSFV 和BVDV 的双重荧光RT-PCR 检测方法则少见报道。为此,本研究以CSFV 与BVDV 的5'端保守区为扩增靶序列,设计特异性引物和TaqMan 探针,建立了一种同时鉴别检测CSFV 与BVDV 的双重荧光PCR 检测方法,为CSF 防制和净化提供了一种有效的技术手段。
1 材料与方法
1.1 病毒、RNA 标准对照和主要试剂
CSFV、猪伪狂犬病病毒(PRV)、猪繁殖与呼吸道综合征病毒(PRRSV)、猪流行性腹泻病毒(PEDV)和猪传染性胃肠炎病毒(TGEV)以 及BVDV NADL 株(BVDV-1)和890 株(BVDV-2)的核酸材料,由天津海关动植物与食品检测中心反刍动物检疫实验室保存。TaKaRa MiniBEST Universal RNA Extraction Kit、One Step PrimeScript™ RT-PCR Kit(Perfect Real Time),购自大连宝生物工程(北京)有限公司。RiboMAXTMLarge Scale RNA Production System T7,购自Promega 公司。
1.2 引物和探针设计与合成
根据GenBank 发表的CSFV 毒株基因序列(AJ133738.1)、BVDV-1 型NADL 毒株基因序列(AJ133738.1)和BVDV-2 型890 毒株基因序列(AF039180.1),在NCBI 网站(www.ncbi.nlm.nih.gov/),对这3 株病毒的5'UTR 序列进行BLAST序列比对,选取BVDV-1 型和BVDV-2 型5'UTR 序列的共同保守序列设计合成引物对和探针,选取CSFV 5'UTR 序列的保守序列设计合成引物对和探针,由Sangon Biotech 公司合成。经预试验确定的引物及探针序列见表1,扩增片段长度为91 bp。

表1 引物与探针序列
1.3 标准RNA 对照制备
分别选取CSFV 毒株、BVDV-1 型NADL 毒株和BVDV-2 型890 毒株的5'UTR 序列,送由上海杰瑞生物技术公司合成并克隆至PCR2.1 载体连接,构建重组克隆载体PCR2.1-CSFV-5'UTR、PCR2.1-BVDV-1-5'UTR 和PCR2.1-BVDV-2-5'UTR,然后转化至E.coliDH5α 感受态细胞;在AMP+LB 平板上挑选单个菌落,接种于新鲜AMP+LB 培养基中,37 ℃过夜培养,提取质粒;以经PstI 酶切线性化的重组质粒DNA 为模板,采用RiboMAX Large Scale RNA Production System-T7试剂盒,按说明书进行体外转录;对体外转录产物,经RQ1 DNA 酶消化及纯化后即制备成含有扩增靶序列的RNA 标准对照,分别命名为CSFV-5'UTRRNA、BVDV-1-5'UTR-RNA 和BVDV-2-5'UTRRNA;用核酸蛋白分析仪测定其浓度并按相应公式换算其拷贝数,浓度分别为2.7×109、3.6×109和3.2×109拷贝/μL。
1.4 荧光RT-PCR 反应条件优化
采 用One Step PrimeScript ™ RT-PCR Kit(Perfect Real Time)试 剂,在Light Cycler®480 Ⅱ荧光PCR(Rochi)仪上,以CSFV-5'UTRRNA(2.7×106拷 贝/μL)、BVDV-1-5'UTR-RNA(3.6×106拷 贝/μL)和BVDV-2-5'UTR-RNA(3.2×106拷贝/μL)为膜板,首先确定在25 μL反应体系中的各条引物和探针的最适浓度,然后确定最适退火和扩增温度,进而确定最适荧光RTPCR 反应条件。
1.5 标准曲线绘制和敏感性试验
对CSFV-5'UTR-RNA、BVDV-1-5'UTR-RNA和BVDV-2-5'UTR-RNA 进行10 倍系列稀释,然后分别吸取1 μL,按优化的荧光RT-PCR 反应条件进行试验;反应结束后,以Ct 值为横坐标、标准RNA 对照模板起始拷贝数浓度的对数为纵坐标,绘制定量标准曲线,同时确定检测标准RNA 对照模板的最低拷贝数。
1.6 重复性试验和特异性试验
对3 个浓度的CSFV-5'UTR-RNA、BVDV-1-5'UTR-RNA 和BVDV-2-5'UTR-RNA 各 取1 μL 为模板,分别进行组内试验和组间试验,确定该方法的重复性。以CSFV、BVDV、PRRSV、PEDV 和TGEV 的核酸为模板,按优化反应条件进行试验,确定该荧光RT-PCR 方法的特异性。
1.7 临床样本检测
对2017—2019年本实验室保留的采自国内猪场和屠宰场的152 份猪淋巴结样本,用TaKaRa MiniBEST Universal RNA Extraction Kit 试剂盒提取样本RNA,采用GB/T 27540—2011 的实时荧光RT-PCR(简称国标方法)进行CSFV 核酸检测,采用OIE《陆生动物诊断试验和疫苗手册》(2018版第3.4.7 章)的荧光RT-PCR(简称OIE 方法)进行BVDV 核酸检测,同时采用本研究所建立的方法进行CSFV 和BVDV 核酸检测,以评价该方法的实用性和符合率。
2 结果
2.1 荧光RT-PCR 反应条件优化
在Light Cycler® 480 Ⅱ荧光PCR(Rochi)仪上,以CSFV-5'UTR-RNA(2.7×106拷贝/μL)、BVDV-1-5'UTR-RNA(3.6×106拷 贝/μL)和BVDV-2-5'UTR-RNA(3.2×106拷贝/μL)为模板,进行不同浓度组合的引物和标记探针以及56~61 ℃范围内退火延伸温度的优化试验。试验确定的CSFV 和BVDV 双重荧光RT-PCR 反应体系为:在25 μL 反应体系中,依次加入2×One Step RT-PCR buffer Ⅲ12.5 μL,TaKaRa ExTaqHS(5 U/μL)0.5 μL,PrimeScript RT Enzyme Mix Ⅱ 0.5 μL,BVDV-F(10 mmol/L)、BVDV-R(10 mmol/L)、BVDV-P(4 mmol/L)、CSFV-F(10 mmol/L)、CSFV-R(10 mmol/L)、CSFV-P(4 mmol/L)各0.5 μL,模板1 μL,补足水至25 μL。反应参数为:42 ℃ 5 min,95 ℃ 10 s,然后95 ℃ 10 s,60 ℃ 30 s,45 个循环。在每次循环的60 ℃延伸扩增结束前,采集FAM 和HEX 通道的荧光信号。最适反应条件下的CSFV-5'UTR-RNA、BVDV-1-5'UTR-RNA 和BVDV-2-5'UTR-RNA 的动力学曲线分别见图1-A、1-B 和1-C。
2.2 定量标准曲线及最低检出限

图1 荧光RT-PCR 动力学曲线
对10 倍系列稀释的CSFV-5'UTR-RNA、BVDV-1-5'UTR-RNA 和BVDV-2-5'UTR-RNA,按优化后的双重荧光RT-PCR 反应条件进行检测,扩增曲线分别见图2-A、2-B 和2-C;以起始模板浓度的对数为X 轴、Ct 值为Y 轴,绘制成的标准曲线分别见图3-A、3-B 和3-C。对CSFV-5'UTRRNA 的定量检测的线性范围为2.7×101~2.7×108拷贝/μL,线性关系表达式为Y=-3.476X+41.7,相关系数(R2)为0.999;对BVDV-1-5'UTR-RNA 的定量检测的线性范围为3.6×101~3.6×109拷贝/μL,线性关系表达式为Y=-3.451X+41.53,相关系数(R2)为0.999;对BVDV-2-5'UTR-RNA 的线性范围为3.2×101~3.2×109拷贝/μL,线性关系表达式为Y=-3.39X+41.39,相关系数(R2)为0.999。由图3-A、3-B 和3-C 可知,该方法对CSFV-5'UTRRNA、BVDV-1-5'UTR-RNA 和BVDV-2-5'UTRRNA 最低可分别检出27、36 和32 拷贝/μL。

图2 荧光RT-PCR 扩增曲线
2.3 重复性试验
分别选取3 个浓度的CSFV-5'UTR-RNA、BVDV-1-5'UTR-RNA 和BVDV-2-5'UTR-RNA 标 准对照为模板,按优化的反应条件进行组内和组间重复试验,每个稀释度的Ct 值和标准差(SD)及变异系数(CV)分别见表2、表3 和表4。由表可见,组内和组间重复试验的Ct 值变异系数均小于1.5%,表明本试验所建立的荧光RT-PCR 检测体系稳定,具有良好的重复性。
2.4 特异性试验
用所建立的方法同时对CSFV、BVDV、PRRSV、PEDV 和TGEV 的核酸材料进行检测,扩增结果见图4。由图可知,仅CSFV 和BVDV的核酸呈现典型的扩增曲线,而PRRSV、PEDV和TGEV 的核酸材料均无扩增曲线出现,表明本研究建立的荧光PCR 方法具有良好的特异性。
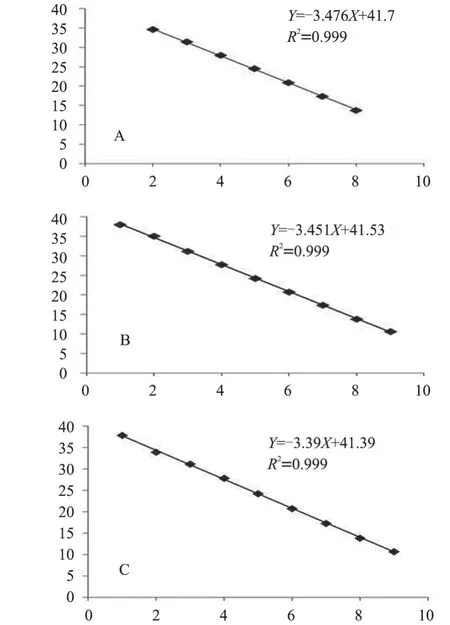
图3 荧光RT-PCR 标准曲线

表2 CSFV-5'UTR-RNA 荧光RT-PCR 重复性试验结果

表3 BVDV-1-5'UTR-RNA 荧光RT-PCR 重复性试验结果

表4 BVDV-2-5'UTR-RNA 荧光RT-PCR 重复性试验结果

图4 二重荧光RT-PCR 检测VDV 和CSFVB 的特异性
2.5 临床样本检测
在152 份猪淋巴结样本中,用国标方法检出CSFV 核酸阳性样品17 份,其余样品为CSFV 核酸阴性,用OIE 方法检出BVDV 核酸样品4 份,其余样品为BVDV 核酸阴性。对这152 份猪淋巴结样本,用本研究所建立方法检出单一CSFV 核酸阳性样品16 份、单一BVDV 核酸阳性样品3 份、CSFV 核酸和BVDV 核酸双阳性的样品1 份,检测结果与国标方法和OIE 方法一致。
3 讨论
流行病学研究表明,繁殖母猪的CSFV 持续感染是引发仔猪发生CSF 的源头。疫病净化是根除动物疫病最经济的有效手段。因此,加大种猪场CSF 病原学监测力度,坚决淘汰感染母猪,培育阴性种猪群和后备种猪群,是实现种猪场的CSF 净化乃至根除的有效措施。目前我国已开始实施了种猪场CSF 净化计划,通过实施CSF 净化显著提高了养猪企业经济效益,减少了疫病损失并大大降低了防疫成本[14]。然而。在种猪及生猪生产实际工作中,接种使用BVDV 污染的胎牛血清和牛睾丸制备的CSF 细胞疫苗,或者饲喂污染BVDV 的饲料,均可造成猪的BVDV 感染[15-16]。这不仅增加了CSF 诊断和防制的复杂性,也给种猪场的CSF阴性种猪群和后备种猪群的评价带来干扰。因此,在猪群中开展CSFV 和BVDV 检测,对我国CSF的防控和净化及无病场(区)的评价具有重要的实际应用价值。
多重实时荧光PCR 方法可同时检测多种病原核酸,具有一次扩增反应就能快速、敏感、特异地鉴别和检测多种病原的优点。基于CSFV 与BVDV 的5'端保守区,设计特异性引物和TaqMan探针,本研究建立了一种同时检测CSFV 与BVDV的双重荧光PCR 检测方法。试验结果表明,该方法仅对CSFV 与BVDV 呈现特异性扩增,不与PRRSV、PEDV 和TGEV 等常见相关猪病病毒发生交叉反应,最低可分别检出27 个拷贝数的BVDV-1-5'UTR-RNA 对照、36 个拷贝数的BVDV-2-5'UTR-RNA 对照和32 个拷贝数的CSFV-5'UTRRNA 对照。该方法的组内试验和组间试验的Ct 值变异系数介于0.11%~1.20%,具有良好的重现性。对152 份国内猪组织样本的检测结果表明,本研究建立的方法与对应的国标和OIE 方法的检出结果一致,且具有节省试剂和检测效率高的优点,可用于猪淋巴结等临床样本中CSFV 与BVDV 的同时检测。
