miR-369-3p对缺氧诱导海马神经元细胞增殖、凋亡的影响及其机制
2020-09-07吕喆蒋晓刚廉民学
吕喆,蒋晓刚,廉民学
1.西安大兴医院外科,陕西 西安 710082;2.西安交通大学医学部生物化学与分子生物学系,陕西 西安 710061;3.西安交通大学第一附属医院神经外科,陕西 西安 710061
阿尔茨海默症(Alzheimer's disease,AD)是一种进行性中枢神经系统退行性疾病,目前尚未有完全治愈的方法,神经元细胞凋亡是其主要病理特征之一[1]。因此,寻找可抑制神经元细胞凋亡的药物及治疗方式对AD的及早预防和治疗具有重要意义。研究AD的发病机制,以相应的病理因素为靶点,开发具有新药理活性的药物是目前治疗AD的研究热点[2]。MicroRNA(miRNA)是一类内源性非编码小RNA,其可通过调控靶基因的表达参与细胞的凋亡过程,且在AD的发生、发展过程中发挥重要作用[3]。有研究发现上调miR-369可以靶向下调SOX4抑制骨肉瘤细胞增殖并诱导细胞凋亡[4]。miR-369-3p通过干扰血管内皮细胞生长因子C(vascular endothelial growth factor C,VEGFC)基因的表达可抑制膀胱癌细胞的增殖,促进膀胱癌细胞的凋亡[5]。miR-369-3p在过氧化氢刺激的海马神经元细胞中显著上调表达[6]。酰胺磷酸核糖转移酶(nicotinamide phosphoribosyltransferase,NAMPT)是一种由脂肪细胞分泌的细胞因子,一个重要的神经保护因子,可能参与脑疾病的发生[7]。NAMPT还是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)合成的限速酶,其可能通过控制细胞和机体的NAD水平,从而影响细胞中活性氧簇(reactive oxygen species,ROS)的产生以及抗氧化酶的表达,进而影响衰老进程或促进AD形成[8]。然而miR-369-3p、NAMPT对缺氧诱导的海马神经元细胞凋亡的影响及其机制尚不清楚。本实验用缺氧处理海马神经元细胞建立缺氧损伤模型,研究miR-369-3p对缺氧诱导海马神经元细胞凋亡的影响及其机制是否与NAMPT有关,以期为AD的病理研究提供一定的理论依据和为AD的治疗提供靶点。
1 材料与方法
1.1 材料与试剂 DMEM培养基、胎牛血清、0.25%胰蛋白酶购自美国Gibico公司;神经元特异性烯醇化酶(neuron specific enolase,NSE)多克隆抗体和SP免疫组化试剂盒(即用型)购自北京中山生物技术有限公司;Trizol试剂、荧光定量试剂盒购自上海莼试生物技术有限公司;四甲基偶氮唑盐比色法(MTT)试剂盒购自上海联硕生物科技有限公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒购自上海经科化学科技有限公司;二辛可宁酸(BCA)试剂盒、RIPA蛋白裂解液购自北京百奥莱博科技有限公司;Bax、Bcl-2、Cyclin D1、P21、NAMPT、GAPDH多克隆抗体和山羊抗兔IgG-辣根过氧化物酶(horseradish peroxidase,HRP)购自北京博奥森生物科技有限公司;超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒购自上海茁彩生物科技有限公司;双荧光素酶报告基因检测试剂盒购自武汉纯度生物科技有限公司。
1.2 方法
1.2.1 海马神经元细胞Hhn分离培养与鉴定 参考赵秀鹤等[9]研究方法,取12~20周龄引产的胎儿,常规消毒后开颅,分离双侧海马,置于DMEM培养液中,剔除血管和脑膜组织,剪碎,加入0.125%的胰酶,消化完全,800 r/min离心5 min,去上清,加入DMEM培养液再次离心去上清,再加入DMEM培养液重悬,在37℃、5%CO2条件下培养,隔天换液一次,每天在显微镜下观察神经元生长情况,培养7~14 d时海马神经元胞体饱满,呈椭圆形或多边形,树突发达,相互交错;培养10 d后用NSE多克隆抗体进行免疫组化实验,神经元细胞会被染成棕色,此时期大部分细胞均被染色,说明多为神经元细胞,取这一时期的细胞用于实验。
1.2.2 细胞缺氧处理与分组 将Hhn细胞用无血清低糖的DMEM培养基培养,置于持续充入95%N2+5%CO2的密闭培养箱中进行缺氧处理48 h,作为缺氧组,正常培养的细胞作为对照组。取对数生长期细胞Hhn,培养24 h后更换培养基,将miR-NC、miR-369-3p、anti-miR-NC、anti-miR-369-3p分别转染至Hhn细胞中,分别记为miR-NC组、miR-369-3p组、anti-miR-NC组、anti-miR-369-3p组;将anti-miR-NC、anti-miR-369-3p、pcDNA3.1、pcDNA3.1-NAMPT 分别转染至Hhn细胞中再进行缺氧处理,分别记为缺氧+anti-miR-NC组、缺氧+anti-miR-369-3p组、缺氧+pcDNA3.1组、缺氧+pcDNA3.1-NAMPT组;将anti-miR-369-3p质粒分别与si-NC、si-NAMPT共转染至Hhn细胞中再进行缺氧处理,分别记为缺氧+anti-miR-369-3p+si-NC组、缺氧+anti-miR-369-3p+si-NAMPT组。转染按照LipofectamineTM2000试剂盒进行操作。
1.2.3 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测miR-369-3p表达水平 提取细胞总RNA,反转录成cDNA,按照荧光定量试剂盒说明进行PCR扩增,miR-369-3p以U6为内参,miR-369-3p正向引物序列:5'-CTCCTGGTACCTGAAGGGAGA-3',反向引物序列:5'-CTCCAAGGTGAGATTTGATACTGA-3';U6正向引物序列为:5'-CGCTTCGGCACATATAC-3',反向引物序列为:5'-TTCACGAATTTGCGTGTCAT-3'。反应条件:95℃变性 30 s,60℃退火 30 s;72℃延伸 30 s,共 40 个循环。相对表达量采用2-△△Ct法计算。
1.2.4 流式细胞术检测细胞凋亡 收集细胞,漂洗后用结合缓冲液重悬,加入Annexin V-FITC和PI,避光孵育,上流式细胞仪进行检测。实验重复3次,每次设3个复孔。
1.2.5 蛋白质印迹(Western blot)检测CyclinD1、P21、Bcl-2、Bax和NAMPT蛋白表达水平 提取细胞总蛋白,BCA法进行定量,电泳、转膜至PVDF,封闭2 h,加入一抗4℃孵育过夜;加入二抗室温孵育2 h,显影,定影,Quantity One软件测各条带灰度值,以目的条带和GAPDH条带的比值作为蛋白相对表达水平。
1.2.6 MTT检测细胞增殖活性 取分别培养24 h、48 h、72 h的细胞,加入20μL的MTT溶液,继续培养4 h;吸去培养液后加150μL的DMSO,振荡10 min,检测490 nm处吸光度(OD)值。细胞增殖活性(%)=实验组OD值/空白对照组OD值×100%。实验重复3次,每次设3个复孔。
1.2.7 SOD和MDA试剂盒分别检测SOD活性和MDA含量 收集细胞磷酸盐缓冲液(PBS)清洗3遍,消化,吹打,800 r/min离心10 min得细胞沉淀;PBS再洗3遍,加0.5 mL PBS吹打均匀,超声10 min使细胞裂解,40 r/min离心10 min取上清液,用于SOD活性和MDA含量检测,具体步骤分别按照SOD和MDA试剂盒进行。
1.2.8 双荧光素酶报告 实验检测miRR-369R-3p对NAMPT的靶向调控TargetScan预测显示NAMPT 3'UTR区域有miR-369-3p的结合位点。构建含miR-369-3p的结合位点的NAMPT 3'UTR野生型和突变型荧光素酶表达载体WT-NAMPT和MUT-NAMPT,将其分别与miR-NC和miR-369-3p共转染至Hhn细胞中。按照说明书操作进行,检测荧光活性,实验重复3次。
1.3 统计学方法 应用SPSS20.00统计软件分析实验数据,计量资料符合正态分布,以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两间比较采用t检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 miR-369-3p、NAMPT在缺氧诱导的细胞Hhn中的表达 与对照组相比,缺氧组Hhn细胞中miR-369-3p表达水平显著升高,NAMPT表达水平明显降低,差异有统计学意义(P<0.05),见图1和表1。

图1 NAMPT在缺氧诱导的细胞Hhn中的表达
表1 miR-369-3p、NAMPT在缺氧诱导的细胞Hhn中的表达(±s,n=9)
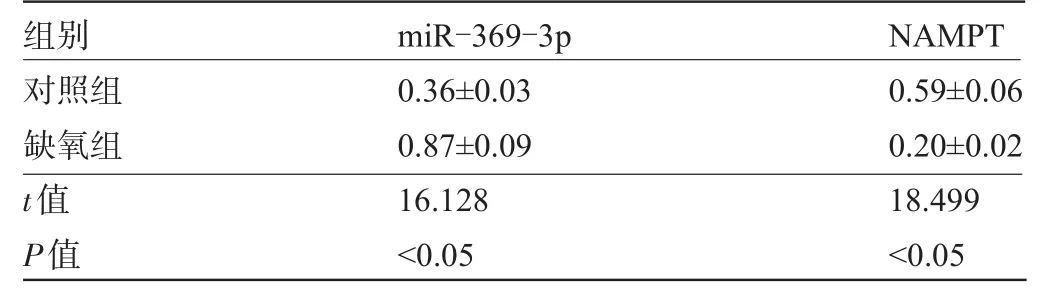
表1 miR-369-3p、NAMPT在缺氧诱导的细胞Hhn中的表达(±s,n=9)
对照组缺氧组t值P值0.36±0.03 0.87±0.09 16.128<0.05 0.59±0.06 0.20±0.02 18.499<0.05
2.2 抑制miR-369-3p对缺氧诱导的细胞Hhn增殖、凋亡及SOD、MDA的影响 与对照组相比,缺氧组Hhn细胞中miR-369-3p、P21、Bax表达水平明显升高,Cyclin D1、Bcl-2表达水平明显降低,细胞活性明显降低,细胞凋亡率明显升高,SOD活性明显降低,MDA含量明显升高,差异有统计学意义(P<0.05);与缺氧+anti-miR-NC组相比,缺氧+anti-miR-369-3p组Hhn细胞中miR-369-3p、P21、Bax表达水平明显降低,Cyclin D1、Bcl-2表达水平明显升高,细胞活性明显升高,细胞凋亡率明显降低,SOD活性明显升高,MDA含量明显降低,差异有统计学意义(P<0.05),见图2、表2和表3。

图2 抑制miR-369-3p对缺氧诱导的细胞Hhn增殖、凋亡的影响
表2 抑制miR-369-3p对缺氧诱导的细胞Hhn增殖的影响(±s,n=9)

表2 抑制miR-369-3p对缺氧诱导的细胞Hhn增殖的影响(±s,n=9)
注:与对照组比较,a P<0.05;与缺氧+anti-miR-NC组比较,b P<0.05。
组别miR-369-3p Cyclin D1 P21细胞活性(490 nm)对照组缺氧组缺氧+anti-miR-NC组缺氧+anti-miR-369-3p组F值P值0.34±0.03 0.86±0.09a 0.83±0.08 0.45±0.04b 147.529<0.05 0.85±0.08 0.20±0.02a 0.22±0.02 0.70±0.07b 327.942<0.05 0.31±0.03 0.82±0.08a 0.84±0.08 0.38±0.03b 195.514<0.05 24 h 0.56±0.05 0.23±0.02a 0.22±0.02 0.44±0.04b 202.959<0.05 48 h 0.98±0.09 0.35±0.03a 0.34±0.03 0.79±0.08b 228.000<0.05 72 h 1.63±0.16 0.54±0.05a 0.55±0.05 1.23±0.12b 230.207<0.05
表3 抑制miR-369-3p对缺氧诱导的细胞Hhn凋亡及SOD、MDA的影响(±s,n=9)
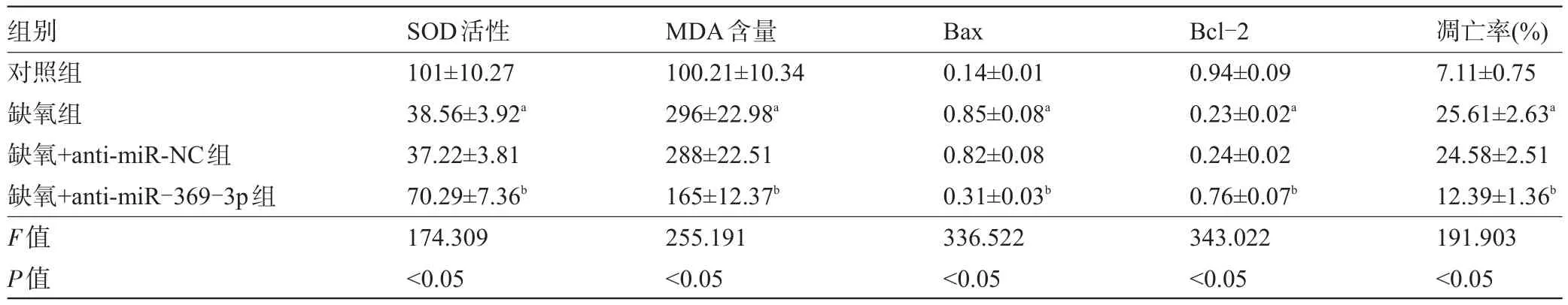
表3 抑制miR-369-3p对缺氧诱导的细胞Hhn凋亡及SOD、MDA的影响(±s,n=9)
注:与对照组比较,a P<0.05;与缺氧+anti-miR-NC组比较,b P<0.05。
组别对照组缺氧组缺氧+anti-miR-NC组缺氧+anti-miR-369-3p组F值P值凋亡率(%)7.11±0.75 25.61±2.63a 24.58±2.51 12.39±1.36b 191.903<0.05 SOD活性101±10.27 38.56±3.92a 37.22±3.81 70.29±7.36b 174.309<0.05 MDA含量100.21±10.34 296±22.98a 288±22.51 165±12.37b 255.191<0.05 Bax 0.14±0.01 0.85±0.08a 0.82±0.08 0.31±0.03b 336.522<0.05 Bcl-2 0.94±0.09 0.23±0.02a 0.24±0.02 0.76±0.07b 343.022<0.05
2.3 miR-369-3p靶向、调控NAMPT的表达 TargetScan在线软件预测显示NAMPT与miR-369-3p存在结合位点(图3A)。双荧光素酶报告实验结果(表4)显示,相较于miR-NC组,miR-369-3p组转染野生型NAMPT载体的细胞Hhn荧光素酶活性明显降低,差异有统计学意义(P<0.05);而转染突变型NAMPT载体的细胞Hhn荧光素酶活性差异无统计学意义(P>0.05)。相较于miR-NC组,miR-369-3p组NAMPT表达水平明显降低;相较于anti-miR-NC组,anti-miR-369-3p组NAMPT表达水平明显升高,差异具有统计学意义(P<0.05),见图3B和表5。
2.4 过表达NAMPT对缺氧诱导的细胞Hhn增殖、凋亡及SOD、MDA表达的影响 与缺氧+pcDNA3.1组相比,缺氧+pcDNA3.1-NAMPT组Hhn细胞中P21、Bax表达水平明显降低,NAMPT、Cyclin D1、Bcl-2表达水平明显升高,细胞活性明显升高,细胞凋亡率明显降低,SOD活性明显升高,MDA含量明显降低,差异有统计学意义(P<0.05),见图4、表6和表7。

图3 miR-369-3p靶向、调控NAMPT
表4 双荧光素酶报告实验(±s,n=9)
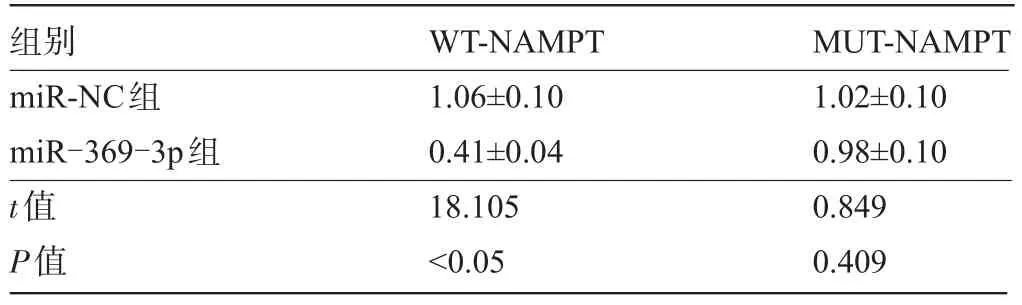
表4 双荧光素酶报告实验(±s,n=9)
组别miR-NC组miR-369-3p组t值P值WT-NAMPT 1.06±0.10 0.41±0.04 18.105<0.05 MUT-NAMPT 1.02±0.10 0.98±0.10 0.849 0.409
表5 miR-369-3p调控NAMPT的表达(±s,n=9)

表5 miR-369-3p调控NAMPT的表达(±s,n=9)
注:与miR-NC组比较,a P<0.05;与anti-miR-NC组比较,b P<0.05。
组别miR-NC组miR-369-3p组anti-miR-NC组anti-miR-369-3p组F值P值NAMPT 0.53±0.05 0.21±0.02a 0.54±0.05 0.82±0.08b 189.661<0.05
2.5 抑制NAMPT表达能逆转抑制miR-369-3p对缺氧诱导的细胞Hhn增殖、凋亡及SOD、MDA表达的影响 与缺氧+anti-miR-NC组相比,缺氧+anti-miR-369-3p组Hhn细胞中P21、Bax表达水平明显降低,NAMPT、Cyclin D1、Bcl-2表达水平明显升高,细胞活性明显升高,细胞凋亡率明显降低,SOD活性明显升高,MDA含量明显降低,差异均具有统计学意义(P<0.05);与缺氧+anti-miR-369-3p+si-NC组相比,缺氧+anti-miR-369-3p+si-NAMPT组Hhn细胞中p21、Bax表达水平明显升高,NAMPT、Cyclin D1、Bcl-2表达水平明显降低,细胞活性明显降低,细胞凋亡率明显升高,SOD活性明显降低,MDA含量明显升高,差异均具有统计学意义(P<0.05),见图5、表8和表9。

图4 过表达NAMPT对缺氧诱导的细胞Hhn增殖、凋亡蛋白表达的影响
表6 过表达NAMPT对缺氧诱导的细胞Hhn增殖的影响(±s,n=9)
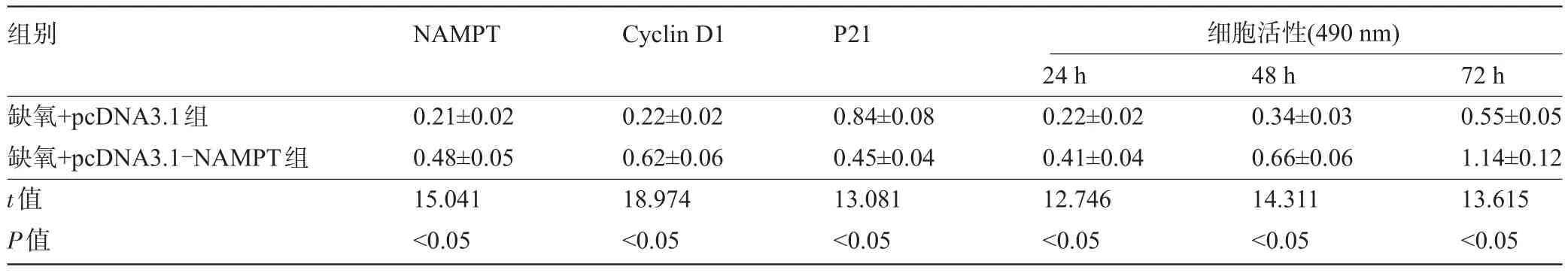
表6 过表达NAMPT对缺氧诱导的细胞Hhn增殖的影响(±s,n=9)
组别NAMPT Cyclin D1 P21细胞活性(490 nm)缺氧+pcDNA3.1组缺氧+pcDNA3.1-NAMPT组t值P值0.21±0.02 0.48±0.05 15.041<0.05 0.22±0.02 0.62±0.06 18.974<0.05 0.84±0.08 0.45±0.04 13.081<0.05 24 h 0.22±0.02 0.41±0.04 12.746<0.05 48 h 0.34±0.03 0.66±0.06 14.311<0.05 72 h 0.55±0.05 1.14±0.12 13.615<0.05
表7 过表达NAMPT对缺氧诱导的细胞Hhn凋亡及SOD、MDA的影响(±s,n=9)
表7 过表达NAMPT对缺氧诱导的细胞Hhn凋亡及SOD、MDA的影响(±s,n=9)
组别缺氧+pcDNA3.1组缺氧+pcDNA3.1-NAMPT组t值P值SOD活性37.22±3.81 63.25±6.36 10.533<0.05 MDA含量288±22.51 184±15.47 11.423<0.05 Bax 0.82±0.08 0.46±0.04 12.085<0.05 Bcl-2 0.24±0.02 0.60±0.06 17.076<0.05凋亡率(%)24.58±2.51 14.12±1.51 10.713<0.05
表8 抑制NAMPT表达能逆转抑制miR-369-3p对缺氧诱导的细胞Hhn增殖的影响(±s,n=9)
表8 抑制NAMPT表达能逆转抑制miR-369-3p对缺氧诱导的细胞Hhn增殖的影响(±s,n=9)
注:与缺氧+anti-miR-NC组比较,a P<0.05;与缺氧+anti-miR-369-3p+si-NC组比较,b P<0.05。
组别NAMPT Cyclin D1 P21细胞活性(490 nm)缺氧+anti-miR-NC组缺氧+anti-miR-369-3p组缺氧+anti-miR-369-3p+si-NC组缺氧+anti-miR-369-3p+si-NAMPT组F值P值0.23±0.02 0.52±0.05a 0.51±0.05 0.30±0.03b 123.810<0.05 0.22±0.02 0.70±0.07a 0.72±0.07 0.28±0.03b 230.919<0.05 0.84±0.08 0.38±0.03a 0.36±0.03 0.68±0.07b 151.237<0.05 24 h 0.22±0.02 0.44±0.04a 0.45±0.04 0.26±0.02b 128.625<0.05 48 h 0.34±0.03 0.79±0.08a 0.81±0.08 0.42±0.04b 141.020<0.05 72 h 0.55±0.05 1.23±0.12a 1.26±0.12 0.73±0.07b 126.854<0.05
表9 抑制NAMPT表达能逆转抑制miR-369-3p对缺氧诱导的细胞Hhn凋亡及SOD、MDA的影响(±s,n=9)

表9 抑制NAMPT表达能逆转抑制miR-369-3p对缺氧诱导的细胞Hhn凋亡及SOD、MDA的影响(±s,n=9)
注:与缺氧+anti-miR-NC组比较,a P<0.05;与缺氧+anti-miR-369-3p+si-NC组比较,b P<0.05。
组别缺氧+anti-miR-NC组缺氧+anti-miR-369-3p组缺氧+anti-miR-369-3p+si-NC组缺氧+anti-miR-369-3p+si-NAMPT组F值P值凋亡率(%)24.58±2.51 12.39±1.36a 12.20±1.31 18.68±1.88b 93.639<0.05 SOD活性37.22±3.81 70.29±7.36a 71.25±7.40 45.67±4.73b 73.745<0.05 MDA含量288±22.51 165±12.37a 162±13.01 225±19.63b 105.126<0.05 Bax 0.82±0.08 0.31±0.03a 0.30±0.03 0.66±0.06b 205.500<0.05 Bcl-2 0.24±0.02 0.76±0.07a 0.78±0.07 0.33±0.03b 258.892<0.05
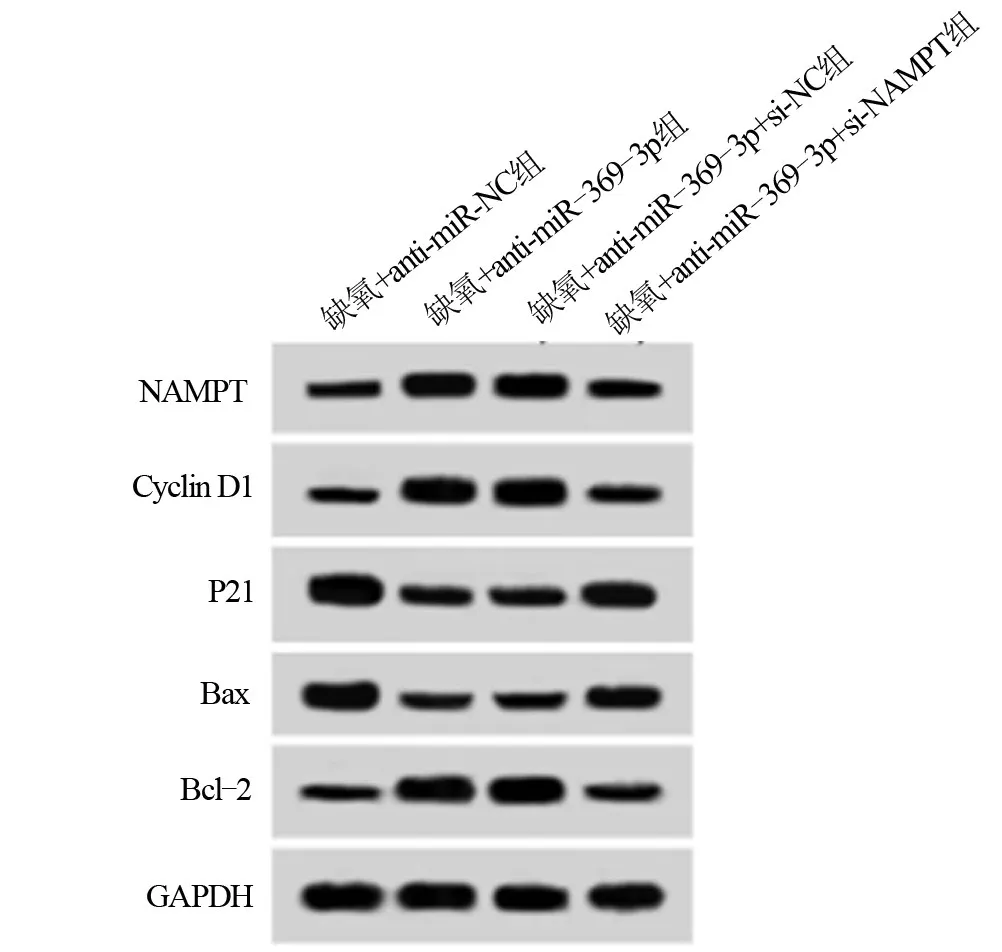
图5 抑制NAMPT表达能逆转抑制miR-369-3p对缺氧诱导的细胞Hhn增殖、凋亡蛋白表达的影响
3 讨论
AD发病机制复杂,氧化应激是其发生的重要因素之一[10]。有研究发现AD患者的海马组织中神经元凋亡率明显较高[11];说明海马神经元细胞凋亡与AD的发生有关。而缺氧可诱导大鼠海马神经元凋亡[12]。因此,本实验缺氧处理细胞Hhn建立AD细胞模型,结果显示,细胞凋亡率升高,细胞活性降低,超氧化物歧化酶(superoxide dismutase,SOD)活性降低,丙二醛(malondialdehyde,MDA)含量升高;说明缺氧可诱导Hhn细胞凋亡和氧化应激的产生,从而导致Hhn细胞损伤;AD细胞模型成功建立。
研究表明miRNA与AD的进展密切相关,药物的靶向治疗策略是AD的新治疗策略,miRNA可作为AD新型药物研发的靶点[13]。有研究报道AD患者中miR-369-3p表达水平增加,miR-369-3p可能与AD的发生发展有关[14]。研究报道抑制miR-369-3p表达可抑制细胞活力,促进放射诱导的细胞凋亡[15]。本实验结果显示,在缺氧处理的细胞Hhn中miR-369-3p高表达,抑制miR-369-3p表达可提高CyclinD1、Bcl-2表达水平,降低p21、Bax表达水平,降低细胞凋亡率,提高细胞活性,降低SOD活性,提高MDA含量。说明抑制miR-369-3p表达可抑制缺氧诱导的Hhn细胞凋亡和氧化应激反应,保护缺氧诱导的Hhn细胞损伤。
NAMPT参与NAD的合成,与神经退行性疾病以及心脑血管疾病密切相关[16]。有研究报道老年小鼠脑缺血情况下NAD水平明显降低,补充NAD对脑缺血具有保护作用[17]。此外,研究报道上调NAMPT可提高SAMP8小鼠的认知功能[18]。以上研究表明NAMPT可能参与脑部疾病的进展过程,但其对缺氧处理的神经元损伤的影响还尚不清楚。本实验结果显示,在缺氧处理的细胞Hhn中NAMPT低表达,过表达NAMPT可提高CyclinD1、Bcl-2表达水平,降低p21、Bax表达水平,降低细胞凋亡率,提高细胞活性,降低SOD活性,提高MDA含量。说明过表达NAMPT可抑制细胞凋亡和氧化应激反应,保护缺氧诱导的Hhn细胞损伤。此外,本实验还发现miR-369-3p靶向调控NAMPT;而抑制NAMPT表达能逆转抑制miR-369-3p对缺氧诱导的细胞Hhn增殖促进、凋亡抑制及提高SOD活性、降低MDA含量的作用。提示,miR-369-3p可能通过调控NAMPT影响缺氧诱导的细胞Hhn损伤。
综上所述,抑制miR-369-3p表达可促进缺氧诱导的海马神经元细胞增殖,抑制细胞凋亡,减轻氧化应激反应,即可保护缺氧诱导的海马神经元细胞损伤,其机制可能与NAMPT相关,将可为阿尔兹海默症的防治提供新思路和新靶点。
