大豆皂苷B组分的分离纯化研究
2020-09-03易清清孟拥军梁冬雨章雨婷姜国伟
易清清 孟拥军 常 庆 梁冬雨 章雨婷 姜国伟
(上海健康医学院附属嘉定区中心医院中心实验室1,上海 201800)(上海健康医学院附属嘉定区中心医院药剂科2,上海 201800)(上海健康医学院药学院3,上海 201318)
工业生产大豆异黄酮的过程会产生很多废水,这些废水中含有大豆皂苷组分[2]。大豆皂苷是一种生物活性物质,近年来,国内外许多专家、学者对大豆皂苷的生物学、生理学和药理学进行了研究,发现大豆皂苷对人体不仅无毒害作用,而且具有许多有益的生理功能。大豆皂苷具有多种生理活性和良好药理作用,具有抗癌、调节免疫功能、降低血清中胆固醇含量、防治心血管疾病、抗菌、抗病毒、护肝、减肥等多重生理功效[1]。结构不同的大豆皂苷生物活性不同,其中大豆皂苷B组分具有更强的生物活性[3,4]。大豆皂苷B组分是由低聚糖及齐墩果烯三萜缩合形成的一类化合物[5]。大豆皂苷A组分和大豆皂苷B组分具有极其相似的化学性质,因此单独分离和选择性利用大豆皂苷B组分非常困难[6]。本研究探索了从工业生产大豆异黄酮的废水中分离纯化大豆皂苷B组分的工艺参数,从而建立大豆皂苷B组分的分离纯化工艺。
1 仪器和试剂
1.1 仪器
RE-52C旋转蒸发仪;KQ-25OB回流冷凝管;HP1100高效液相色谱仪;2X-8旋片式真空泵;WMZK-01温度指示控制仪。
1.2 试剂
98%磷酸、碳酸氢钠、碳酸氢钠、均为分析纯;甲醇、冰醋酸,均为色谱纯;98% A组分苷元标准品;97% B组分苷元标准品;AB-8大孔树脂;D101型大孔树脂。
2 方法
2.1 分离纯化方法
2.1.1 酸碱度对分离纯化的影响
由于大豆异黄酮废液含有一些小的多肽和黏多糖类物质,当酸性太强时,会导致废液变性,从而使废液变成黏稠状,不易上柱吸附[7]。此外,大豆皂苷在碱性溶液中不稳定,而且强碱性也会使一些小肽和蛋白质变性,故pH的选择应为弱酸性,本研究选取pH为5、7两个水平。
2.1.2 洗脱试剂的选择
选用极性较弱的甲醇或乙醇溶液进行洗脱。
2.1.3 大孔树脂的选择
根据文献和实验室基础条件[8],考察选用D101和AB-8大孔树脂。皂苷的苷元部分为疏水性,能被非极性树脂所吸附,同时皂苷分子较大,故应选择孔径较大的非极性吸附树脂。AB-8型大孔吸附树脂是苯乙烯型弱极性共聚体,比表面积高于DM-301,最适宜水溶性、弱极性物质的分离和纯化。D101大孔吸附树脂是一种具有多孔海绵状结构人工合成的聚合物吸附剂,依靠树脂骨架和被吸附的分子(吸附质)之间的范德华力,通过树脂巨大的比表面积进行物理吸附,从而从水溶液中分离纯化水溶性较差的有机大分子。
以树脂选择、 上柱pH、洗脱剂作为考察因素,各取2个水平,以测定提取产物的总质量和大豆总皂苷B组分的含量为指标,选用析因设计表进行实验(表1)。收集80%洗脱剂的洗脱物,旋转蒸发仪蒸干,通过HPLC检测计算大豆皂苷B组分的含量。

表1 不同考察因素的分离纯化方法
2.2 分离纯化步骤
将直径为4.5 cm,高度为80 cm的玻璃柱固定,下面放入纱布包的玻璃珠。然后将大孔树脂导入含水烧杯中,搅拌均匀,缓慢倒入玻璃柱中。加入适量大孔树脂,一般以加到玻璃柱的2/3左右为宜。每根玻璃柱约装入500 g大孔树脂。
调废水pH:根据表1,用3%~5%左右的HCl和NaOH溶液来调节废液至所需的pH值。
废液上柱:2 500 mL(约2.5倍柱体积)废液沿柱壁分批加入相应的大孔树脂柱,废液流速约为20 mL/min。分批上柱过程中小心废水留空,避免色谱柱产生气泡。
解吸附:根据表1,先用去离子水4 000 mL(约4倍柱体积)洗脱,至洗脱液为无色;再用体积分数为10%相应溶剂2 500 mL(约2.5倍柱体积)洗脱;最后用体积分数为80%的相应溶剂1 000 mL(约1倍柱体积)洗脱,收集中间部分约500 mL 的洗脱液(前100 mL和后400 mL舍弃)。
蒸干:利用旋转蒸发仪分批将500 mL洗脱液浓缩蒸干,蒸发过程中避免暴沸。收集圆底烧瓶中的固体产物,于研钵中研磨至细粉状,称重,储存备用。
2.3 结晶纯化
考察因素[9]:pH、乙醇体积分数、料液比。
pH选择:根据大豆皂苷的稳定性,选取pH为5、7。
乙醇体积分数:B组分大豆皂苷不溶于冷的低浓度乙醇溶液,而A组分大豆皂苷和其他的一些杂质能够溶解,故选取纯水、体积分数为10%乙醇、体积分数为20%乙醇作为考察对象。
料液比:每2 g样品分别加入12 mL、18 mL、24 mL相应溶剂进行结晶。
结晶实验设计:以乙醇浓度、溶剂pH、料液比作为考察因素,各取3个水平,以测定纯化产物的总质量和大豆总皂苷B组分的含量为指标,选用正交设计表进行实验(表2)。

表2 不同考察因素的纯化方法
根据表2,用1%的HCl和NaOH溶液,调节结晶溶剂的pH至所需值。选用2.2中纯化的产物作为结晶的初始样品。分别取2 g初始样品加入相应的溶剂中,各组大豆皂苷溶液放入700 W超声波仪中溶解40 min,随后放入80 ℃水浴锅中溶解2 min,静置冷却至室温,通过布氏漏斗抽真空过滤,收集滤纸上的不溶物,最后真空抽滤机蒸干,收集蒸干后的固体,研磨成细粉。采用HPLC对大豆皂苷B组分的含量进行检测。
3 结果与讨论
3.1 沸水蒸干后产物的HPLC图谱
A组分大豆皂苷标准品图谱如图1a;B组分大豆皂苷标准品图谱如图1b;废水蒸干后产物的HPLC图谱如图1c。由图1可知,A组分大豆皂苷标准品出峰时间为8.684 min,峰面积为407.481 40;B组分大豆皂苷标准品出峰时间为21.740 min,峰面积为552.607 79。沸水蒸干之后所得粉末取样量为41.53 mg,其中A组分皂苷的出峰时间为8.506 min,计算得质量分数为3.62%;B组分皂苷的出峰时间约为21.3 min,计算得质量分数为0.67%。

图1 废水蒸干后产物的HPLC图谱
3.2 分离纯化产物的HPLC图谱
图2为1.1~1.8分离纯化方法所得产物的HPLC图谱。表3为1.1~1.8分离纯化方法所得产物中大豆皂苷A组分和大豆皂苷B组分的含量。故综合考虑,选择的最佳大孔树脂分离纯化工艺为1.3,即调节废水pH=5,选取D101树脂进行吸附,最后用乙醇解脱吸附。

图2 分离纯化产物的HPLC图谱

表3 不同分离纯化方法中大豆皂苷B组分的含量
3.3 结晶纯化产物的HPLC图谱
图3为2.1~2.6结晶纯化方法所得产物的HPLC图谱。表4为2.1~2.6结晶纯化方法所得产物中大豆皂苷A和大豆皂苷B的含量。从结晶实验数据可以看出,结晶纯化工艺2.3为最佳的工艺路线,即2 g分离纯化产物加入到24 mL,pH5的20%乙醇中进行结晶纯化。

图3 结晶纯化产物的HPLC图谱
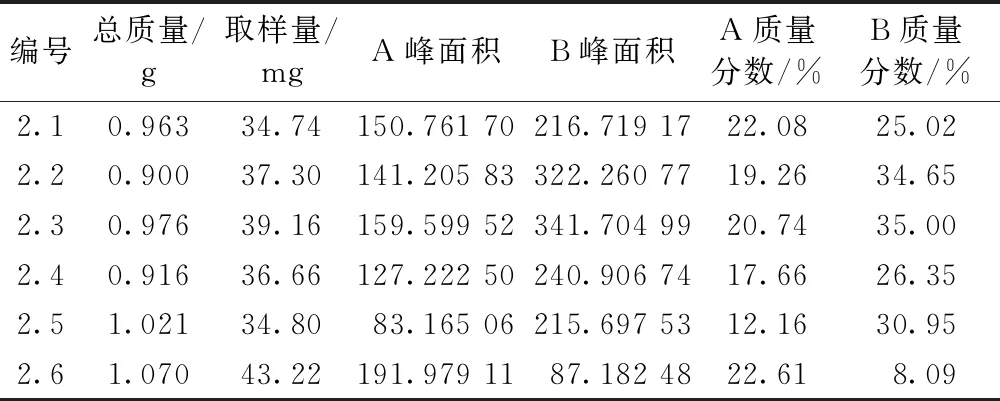
表4 不同结晶纯化方法中大豆皂苷B组分的含量
采用大豆皂苷的分离纯化技术及结构分析测定方法,可以得到较多较纯的大豆皂苷,并应用于食品、化妆品和药品等领域[10,11]。大豆皂苷可阻止由脂质过氧化引起的皮肤疾病, 减少皮肤病的发生。日本学者已经研究出含有大豆皂苷的化妆品,其实用效果已经得到证实[12]。大豆皂苷具有发泡性和乳化性,可在食品中作为添加剂。此外,从工业废水中分离纯化大豆皂苷还具有较大的经济和环保价值。因此,对大豆皂苷B组分从工业废水中分离纯化的工艺进行深入研究,通过改进分离纯化和结晶纯化工艺以获得高质量高纯度的产物,具有重大的研究意义。
4 结论
研究了分离纯化工艺参数对从生产大豆异黄酮的废水中分离纯化大豆皂苷B组分的影响,并在此基础上,探索建立了一种简单经济且可适用于以废水为原料生产大豆皂苷B组分的制备工艺。建立了大豆皂苷B组分的分离纯化方法,采用大孔树脂纯化大豆皂苷 B 组分,选用D101型树脂为层析柱的填充料,以水-乙醇体系进行洗脱,得到纯度为18.96%的大豆皂苷 B 组分,此时主要杂质为大豆皂苷 A 组分。建立了大豆皂苷 B 的结晶纯化方法,一些未知杂质和大豆皂苷 A 组分较易溶解于低浓度乙醇,通过利用低浓度的乙醇进行结晶以获得纯度更高的大豆皂苷 B 组分,纯度可提高至35%。
本研究建立的大豆皂苷B组分的分离纯化方法,虽然能够提高大豆皂苷B组分的含量,但与预期的纯度还有很大差距,还需要进一步的研究探索。
