不同加工方式的铁核桃油对HepG2细胞胆固醇合成的影响及机制初探
2020-09-03刘睿杰王兴国
高 盼 刘睿杰 王兴国
(武汉轻工大学食品科学与工程学院1,武汉 430023)(大宗粮油精深加工教育部重点实验室;武汉轻工大学2,武汉 430023)(江南大学食品学院3,无锡 214122)
铁核桃是我国独有的核桃种类,主要生长于我国高海拔的西南部地区。铁核桃是常绿乔木,树体高大,抗寒抗病性优越,产量也较高,是良好的生态型经济树种[1]。由于铁核桃极易存活,多长于野外,不占用耕地等优良性能,近几年在我国云南、西藏等地被大量种植,是当地重要的经济林业作物,铁核桃在我国核桃资源的占比逐年增加,现已成为我国两大主要核桃种类之一。铁核桃是我国独有的核桃油原料,由于其种植成本较低,深受核桃油生产企业的欢迎,但铁核桃油的相关研究很少[2,3],其功能特性尚不清楚。
加工方式是影响核桃油组成特性的主要因素之一,油脂的品质强烈地依赖于所使用的加工方法[4],通过不同方法提取的坚果油品质特性有所差异[5],为了获得营养价值更高的核桃油,必须采用适当的加工方法。低温压榨是一种传统的提取坚果油的方法,已广泛用于制取杏仁油、南瓜子油和松子油中,也是最为常见的核桃油制取方法[6]。焙烤压榨能增强风味[7],作为一种加工前处理方式也广泛用于种子或果仁的食用油制备,但除了Vaidya和Eun[8]报道了焙烤压榨-正己烷浸出对薄皮核桃油理化特性和氧化稳定性的研究以外,焙烤压榨较少应用于核桃油中。溶剂浸出常用于坚果油的工业萃取,因为这种加工方式可以提高油的产率[9],易于蒸发且成本较低。目前实验室和工业上使用的主流溶剂是正己烷[10]。亚临界丁烷萃取与传统的加工方法相比,具有安全、高效、成本低廉的优点,在低温下可通过系统减压完全除去丁烷,萃取后的丁烷可完全回收[11]。超临界二氧化碳萃取是近年来发展起来的一种新型制油方法,它不会造成萃取组分的热降解,也不会导致萃取物中残留溶剂[12]。这五种加工方式都具有极好的实用性,适合用来加工核桃油。
核桃油作为营养油,其营养价值备受关注,但目前鲜见铁核桃油营养研究报道。受中国传统观念的影响,对核桃油营养价值的期待是具有健脑功效。研究发现,健脑与胆固醇代谢密切相关,通过对阿尔茨海默症(AD)患者的尸检报告[13]研究发现,有90%左右的AD患者生前同样患有动脉粥样硬化等心血管疾病;有临床研究证实[14],他汀类药物可以通过降低胆固醇水平抑制痴呆的进一步发展;更有大量的研究[15,16]证明,胆固醇代谢的相关基因,在AD中也具有显著的影响。因此,认为胆固醇代谢在AD的发病机制中可能起到了重要的作用[17]。同时核桃油对动脉粥样硬化的作用存在争议[18-20],胆固醇积累是动脉粥样硬化的根本原因,研究核桃油对胆固醇代谢的作用是研究核桃油抗动脉粥样硬化的基础。因此,探索核桃油对胆固醇代谢的作用,对核桃油营养功效的评估极为重要。胆固醇合成途径如图1所示。
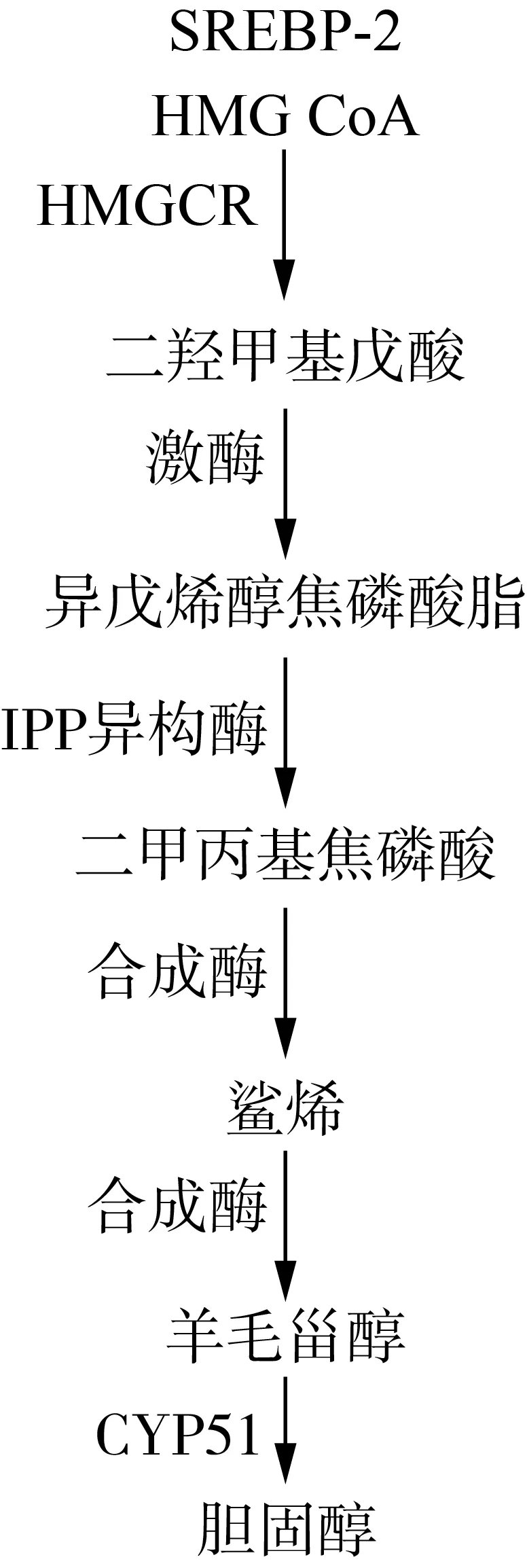
图1 胆固醇合成途径
胆固醇的合成受到了多种酶和蛋白的综合调控。SREBP-2位于内质网上,具有较长的转录激活域,是一种调节胆固醇合成的转录因子。SREBP-2可以通过调节转录机制来调节胆固醇合成[22]。HMGCR也存在于细胞的内质网内,是胆固醇合成的限速酶,能决定胆固醇合成的快慢与程度,是SREBP-2下游的重要调控因子。HMGCR抑制剂是一种被广泛使用的降胆固醇他汀类药物[23]。CYP51属于细胞色素P450家族,是胆固醇合成过程中催化羊毛甾醇转化成胆固醇的作用酶,参与胆固醇合成的最后一步[24]。
HepG2细胞作为人肝癌细胞株能够表达参与胆固醇代谢相关的酶和蛋白,极其适用于模拟人体正常肝脏细胞,是合适的胆固醇代谢模型细胞系。本实验以不同加工方式的铁核桃油为原料,诱导HepG2细胞构建胆固醇评价模型,检测胆固醇合成关键基因的表达,探索铁核桃油对胆固醇合成的功效及作用机理。
1 材料与方法
1.1 实验材料
铁核桃采自新疆维吾尔自治区的漾泡铁核桃大型商业种植园,于当年8—9月采摘,经过脱青皮和清洗处理后,立刻运送至实验室,在45 ℃下恒温干燥3 d,使核桃含水量降至6%~8%。铁核桃样品保存在-80 ℃的冷库中,核桃油采用密封性好的深色容器放置于-20 ℃中,直至样品检测。
1.2 实验试剂
HepG2细胞系、DMEM培养基(Gibco)、胎牛血清(Gibco)、青霉素-链霉素(Gibco)、PBS(Hyclone)、胰蛋白酶、二甲亚砜(DMSO)。
总胆固醇试剂盒、RNAeasyTM动物RNA抽提试剂盒(离心柱式)、反转录试剂盒Fast Quant RT Kit(gDNase)、iTaqTMSYBR©Green SuperMix。
1.3 实验仪器与设备
R510旋转蒸发器,t25均质机,CBE-5L亚临界流体萃取实验室成套设备,超临界CO2流体萃取装置,HFG 50S WN螺旋压榨机,Forma 310二氧化碳恒温培养箱,NanoDrop-one微量紫外分光光度计,T100 PCR扩增仪,CFX-Connect实时荧光定量PCR仪,GelDoxXR+凝胶成像仪。
1.4 脂质提取
由于铁核桃外壳坚硬,使用锤子和液压机破壳,后人工分离核桃仁。
低温压榨:称取核桃仁,使用HFG 50S WN螺旋压榨机在室温下进行压榨,选取的压榨孔径为6 mm,螺杆速度为20 r/min,压榨温度为(60±10) ℃,收集的油温度为(40±2) ℃。
焙烤压榨:称取核桃仁,放入烘箱中焙烤,根据不同焙烤时间和焙烤温度的比较,最终选择160 ℃焙烤15 min,焙烤后核桃仁放入干燥器中冷却,将冷却后的焙烤核桃仁按低温压榨工艺制油。
浸出:称取核桃仁并研磨成细粉,以正己烷为提取溶剂,核桃仁和溶剂按1∶5混合,然后使用均质机以7 500 r/min的速度均质5 min,再使用布氏漏斗过滤混合物。用相同体积的溶剂对残余物进行两次再萃取,并将三次萃取的滤液合并。在真空条件下,通过真空控制使用旋转蒸发器释放溶剂,直到没有溶剂蒸发。旋转蒸发后,用氮气去除可能残留的溶剂。
亚临界:称取核桃仁,核桃仁与丁烷的提取比例为1∶5,使用亚临界设备进行亚临界丁烷萃取,实验温度为40 ℃,压力为0.5 MPa,反应时间为2 h。
超临界:称取核桃仁,将核桃仁放入2 L的提取容器中,使用超临界萃取系统,在35 MPa真空压力下提取1 h,以99.999%纯度的CO2注入超临界萃取装置,流速为0.5 L/min,热交换器的温度设定为50 ℃,分离器的温度和压力分别为40 ℃和9 MPa。
收集的核桃毛油进行离心去除杂质,离心转速为5 000 r/min,时间20 min,离心后,得到澄清的核桃油。将核桃油放置于棕色样品瓶中,放置于4 ℃冰箱避光储存。
1.5 HepG2细胞培养
根据按照美国标准培养物收藏所(American Type Culture Collection,ATCC)的标准方法,取对数期生长状态良好的HepG2细胞,将0.5×106个细胞接种于6 cm的培养皿中,加入89% DMEM+10%FBS+1%青霉素-链霉素的培养基,置于37 ℃、5% CO2的细胞培养箱中培养。当细胞密度达到70%~80%时,准备给药,给药培养基为99% DMEM+1%青霉素-链霉素。
1.6 HepG2细胞毒性检测
根据Wolfe等[25]实验方法进行条件优化,采用亚甲基蓝染色法测定不同浓度的核桃油对HepG2细胞存活率的影响。取对数生长期的HepG2细胞,将细胞接种于96孔板中,置于37 ℃、5% CO2的细胞培养箱中培养24 h。将核桃油溶解于DMSO中,配制成不同浓度的核桃油-DMSO溶液。另外增设调零组(不含细胞和样品)、空白对照组(含有细胞但不含样品),和阳性对照组(含有细胞和千分之一的DMSO)。置于37 ℃、5% CO2的细胞培养箱中培养24 h后,加入亚甲基蓝染色液(98%HBSS+0.67%戊二醛+亚甲基蓝)。37 ℃孵育1 h后去除染色液,充分洗涤后加入洗脱液(49% PBS+50%乙醇+1%乙酸),摇床低速振荡20 min,使染色液充分溶解,酶标仪检测OD570 nm处各孔的吸光值。以DMEM培养液调零组调零,空白对照组作为对照,计算HepG2细胞活力,选取处理HepG2细胞的最佳核桃油-DMSO浓度。
1.7 总胆固醇的测定
将HepG2细胞处理后,细胞分为对照组和实验组。对照组添加DMSO,实验组添加最佳浓度的核桃油-DMSO溶液。培养48 h,加入150 μL RIPA裂解液使细胞完全破碎,根据TC的试剂盒使用方法进行检测。
1.8 q-PCR检测
采用RNA抽提试剂盒提取总RNA,检测RNA的纯度和完整性后,使用反转录试剂盒将RNA反转录合成第一链cDNA,以反转录合成的单链cDNA为模板,选取适当浓度,配制实时荧光定量PCR反应体系,置于PCR扩增仪进行扩增检测,其扩增反应条件为:95 ℃/2 min;95 ℃/5 s,60 ℃/30 s,(40个循环);72 ℃/5 min。反应结束后,根据绘制的标准曲线,选取斜率在2左右,CT值在20~30之间对应的浓度作为后续检测的cDNA反应浓度。使用GAPDH作为对照基因,每个样品重复三次,以2-ΔΔCt法计算目的基因的相对表达水平。引物序列详见表1。

表1 引物序列表
1.9 数据处理与分析
所有实验至少重复3次以上,核桃油组成特性的数据以mean±SD表示。采用SPSS 23.0软件进行数据分析,使用Tukey′s-b检验对所有参数进行评价,ANOVA实验的统计学差异在5%水平显著(P<0.05)。
2 结果
2.1 铁核桃油对HepG2细胞活力的影响
采用亚甲基蓝染色法测定细胞存活率,其检测原理是亚甲基蓝可以结合核酸,使活细胞的细胞核呈蓝色。本实验使用亚甲基蓝染色法评估核桃油对HepG2细胞活力的影响,以不加样品的细胞作为对照,以只加DMSO的细胞作为阳性对照,研究核桃油的细胞毒性,以确定最佳的核桃油细胞添加量。不同浓度核桃油添加量对细胞活力的影响如图2所示。当DMSO的添加量为0.50%时,细胞活力为83.32%(<90%),具有细胞毒性,而当DMSO添加量为0.10%时,细胞活力为105.31%,选择0.1%作为DMSO的细胞添加量。
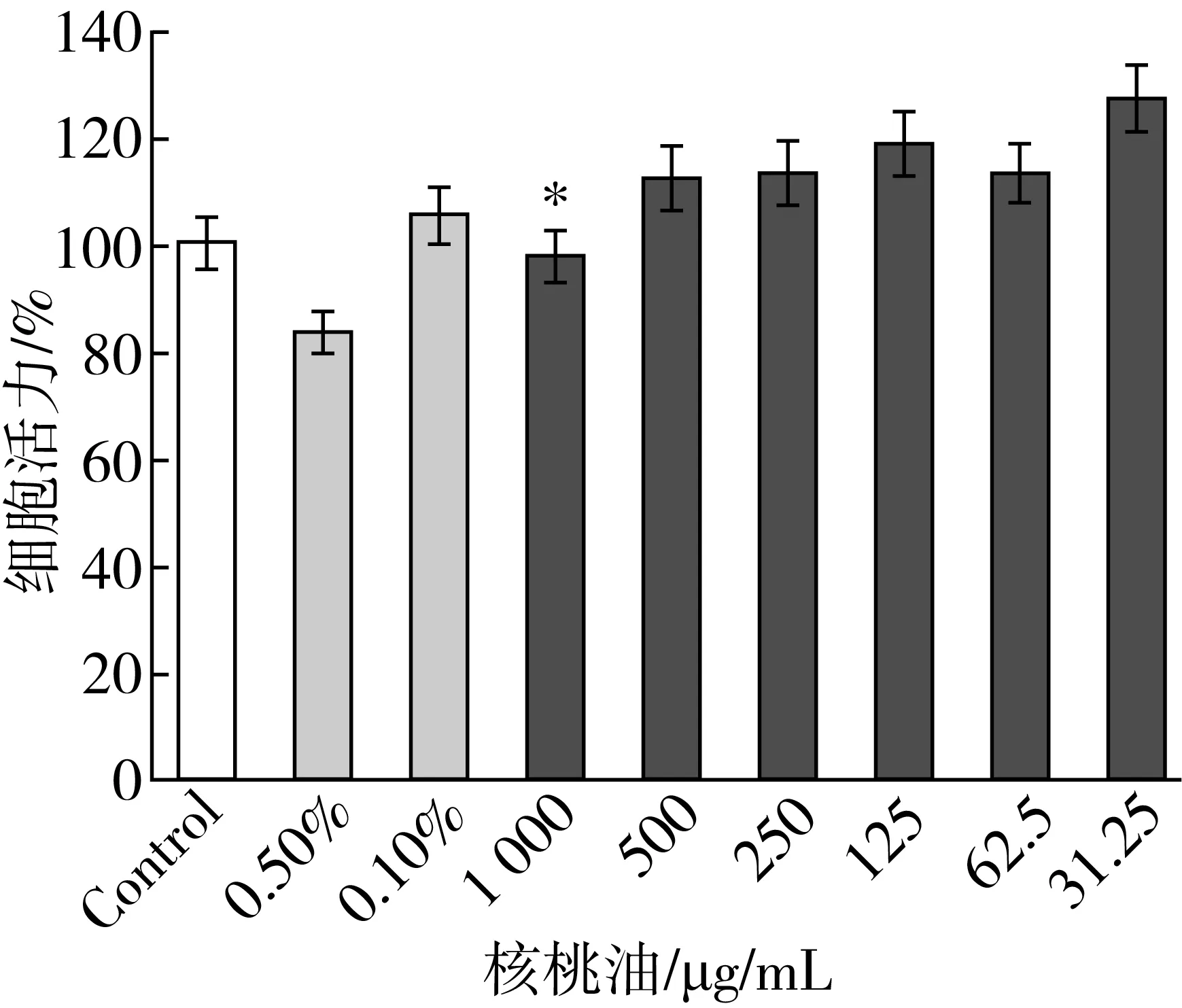
注:*表示P<0.05,余同。
通过比较不同终浓度的核桃油添加量发现,当核桃油添加量为1 000 μg/mL时,其细胞活力具有明显的抑制作用,显著低于其他添加浓度的细胞活力,而核桃油添加量为500 μg/mL时,细胞活力为112.74%,显著高于空白对照组及DMSO阳性对照组,同时继续减少核桃油的添加量对细胞活力的影响不大,因此,选择500 μg/mL作为核桃油的添加量。
2.2 铁核桃油对HepG2细胞TC含量的影响
图3显示了不同加工方式的铁核桃油对HepG2细胞TC的影响。从图3可以看出,与对照组相比,所有铁核桃油都能显著降低HepG2细胞的TC含量(P<0.05),其中低温压榨铁核桃油的TC降低极为显著,下降了52.36%,而其他加工方式的样品间无显著性差异(P>0.05),大约降低了35.79%~42.60%。
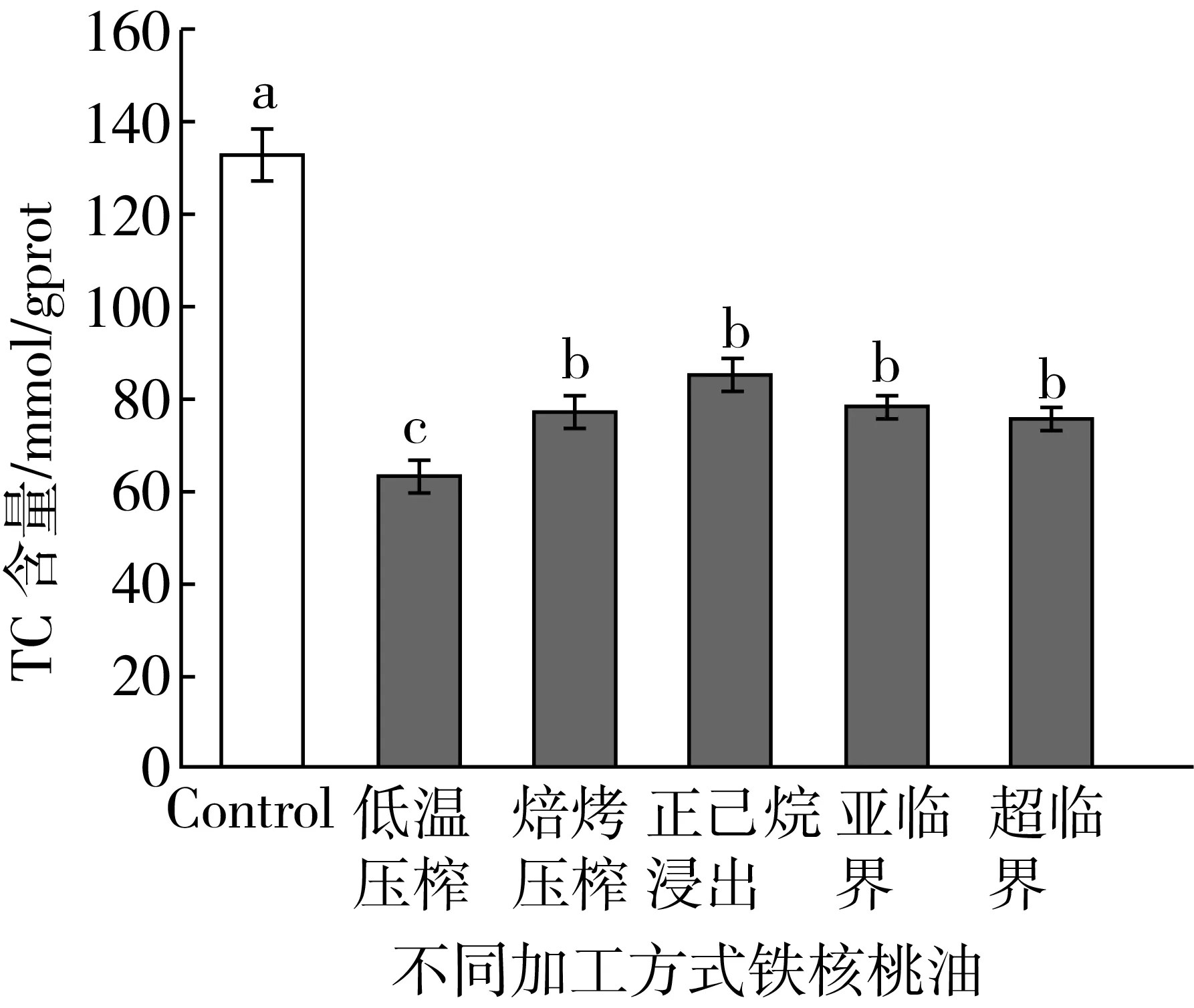
注:字母表示在5%显著水平的统计差异,余同。
2.3 铁核桃油对HepG2细胞胆固醇合成基因表达的影响
铁核桃油对HepG2细胞HMGCR表达的影响如图4所示。与对照组相比,只有低温压榨铁核桃油和亚临界铁核桃油能显著下调HepG2细胞中HMGCR mRNA的表达量(P<0.05),分别下调了37.67%和28.00%,而其他加工方式的铁核桃油与对照组相比,虽然绝对值降低,但无统计学差异(P>0.05)。
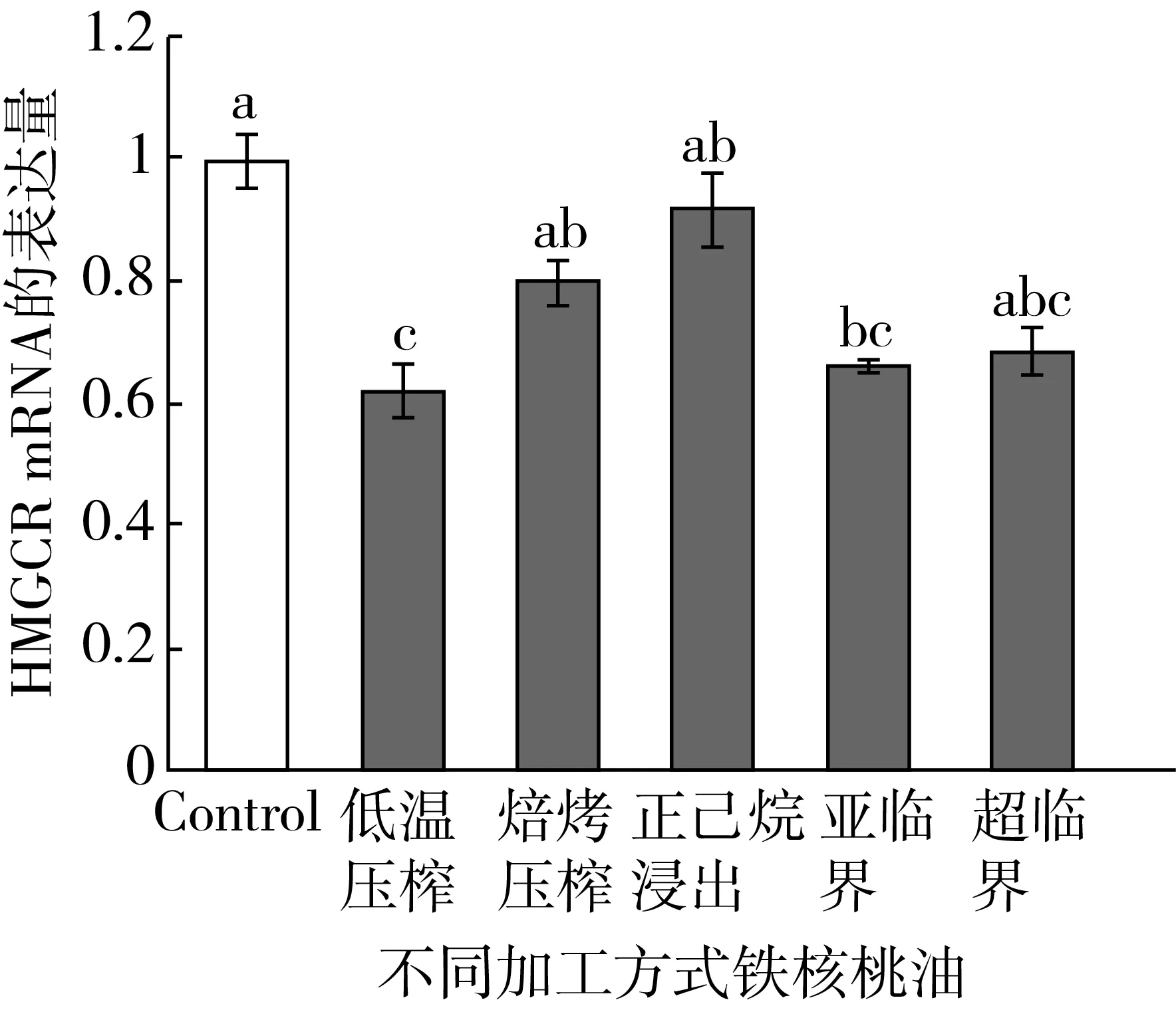
图4 铁核桃油对HepG2细胞HMGCR表达的影响
图5显示了铁核桃油对HepG2细胞SREBP-2表达的影响。与对照组相比,只有亚临界加工的铁核桃油样品能显著下调SREBP-2 mRNA的表达量,大约下调了50%,而其他加工方式的铁核桃油虽然从绝对值上略微下调了SREBP-2基因的表达,但无统计学差异(P>0.05)。

图5 铁核桃油对HepG2细胞SREBP-2表达的影响
图6显示了铁核桃油对CYP51基因表达的影响,不同加工方式的铁核桃油都能显著降低HepG2细胞中CYP51 mRNA的表达量(P<0.05),其中亚临界和正己烷浸出的铁核桃油对CYP51基因的调节作用最强,分别下调了30.67%和26.33%。
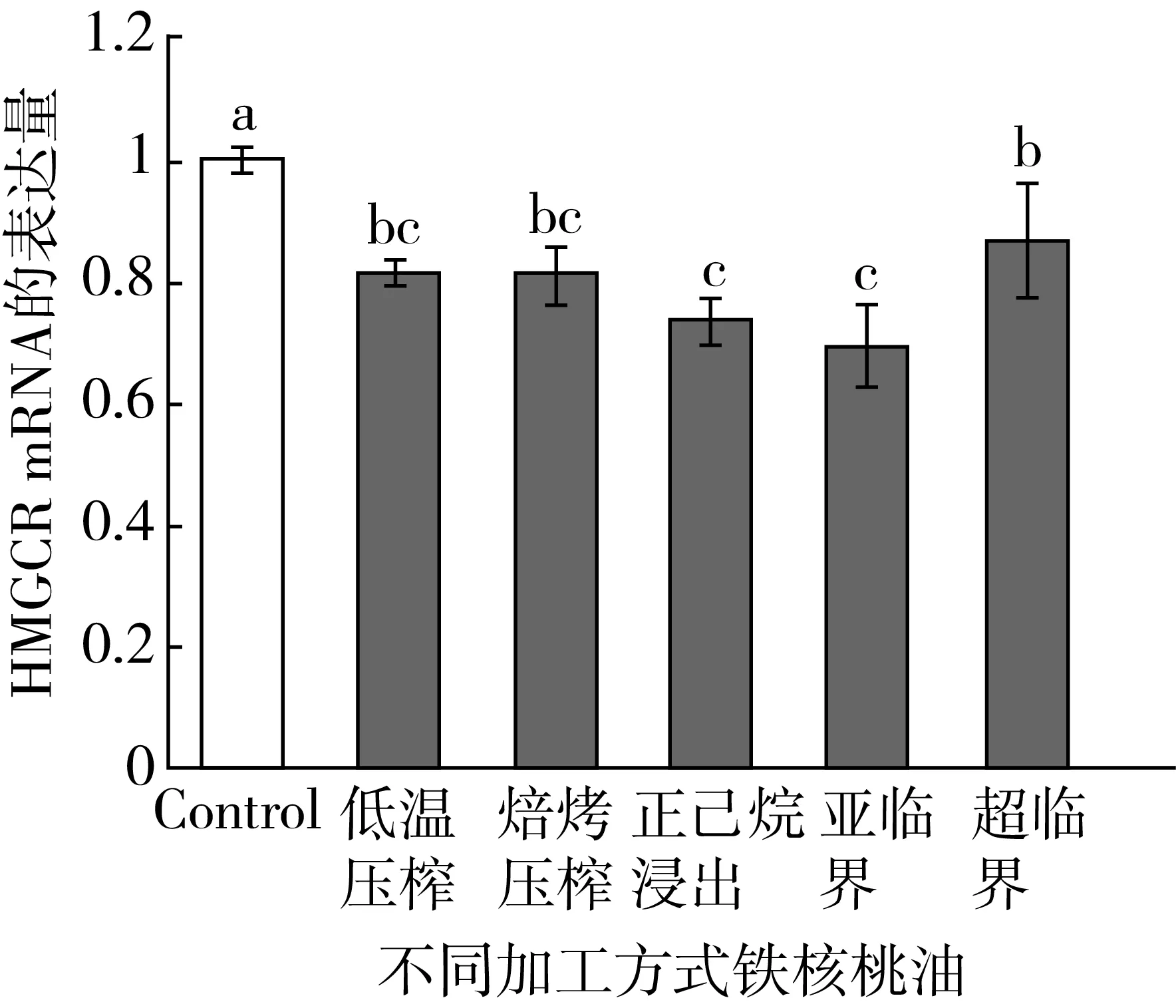
图6 核桃油对HepG2细胞CYP51表达的影响
3 讨论
虽然人体各个组织都可以合成胆固醇,但肝脏是胆固醇合成的主要场所[26]。HepG2细胞作为人肝癌细胞株能够表达参与胆固醇代谢相关的酶和蛋白,极其适用于模拟人体正常肝脏细胞,是合适的胆固醇代谢模型细胞系。细胞内胆固醇的合成主要分为五个步骤:3-羟基-3-甲基-戊二酸单酰辅酶A(3-Hydroxy-3-Methylglutaryl Coenzyme A,HMG-CoA)在HMG-CoA还原酶(3-Hydroxy-3-Methylglutaryl Coenzyme A Reductase,HMGCR)的催化下,生成二羟甲基戊酸;生成的二羟甲基戊酸在酶的催化作用下,异构化生成异戊烯醇焦磷酸酯;异戊烯醇焦磷酸酯在异构酶的作用下生成二甲丙基焦磷酸,之后经过一系列的酶促反应最终聚合生成鲨烯;鲨烯经酶的作用,环化生成羊毛甾醇;羊毛甾醇经氧化、脱羧、还原等反应生成胆固醇[27]。
铁核桃油诱导HepG2细胞后,下调HMGCR基因的表达,减少胆固醇合成过程中二羟甲基戊酸的含量;由于SREBP-2表达量的下调,从膜中释放的SREBP N端结构域减少,进入细胞核后,与基因结合减少;合成反应中生成的羊毛甾醇由于其催化酶CYP51表达量的减少,使其转化成胆固醇的含量也下降,基于HMGCR、SREBP-2和CYP51基因的调控,使胆固醇的合成减少,影响了胆固醇代谢,使TC含量降低,起到了降胆固醇的作用。
Zhang等[28]使用核桃油诱导THP-1巨噬细胞衍生泡沫细胞,也能降低细胞的TC含量,但该研究认为核桃油对胆固醇合成没有影响,会影响胆固醇的排泄,这与本实验结果并不一致,造成这种现象的原因可能是选择的细胞模型不一样,HepG2细胞作为肝癌细胞主要表达胆固醇在肝脏内合成和转化相关的基因,而THP-1巨噬细胞衍生泡沫细胞主要表征胆固醇逆转运和外排相关的表达。
根据对不同加工方式的铁核桃油组成特性的检测发现[29](实验数据见附录),不同加工方式的铁核桃油具有相似的脂肪酸组成和甘油三酯组成,以及差异较大的微量伴随物含量。因此推测铁核桃油中引起胆固醇合成功效差异的物质,可能是核桃油中的微量伴随物。
油脂中微量伴随物对胆固醇代谢的影响已有报道。程敏[30]发现,相比于精炼椰子油,含有丰富微量伴随物的初榨椰子油具有更好的降胆固醇功效,但是比较棕榈油发现,生育酚含量更少的精炼棕榈油比天然的巴西棕榈油具有更好的降TC和TG作用[31],精炼苋菜油与苋菜原油的研究也有相似的结果[32]。造成这种现象的可能原因是微量伴随物的含量不是越高越好,而是存在一定的量效关系。因此,优选铁核桃油的加工方式,会影响其降胆固醇的功效,同时,在铁核桃油的生产过程中,需要更加重视其微量伴随物的含量,这些微量成分对铁核桃油的功能特性影响极大。
4 结论
本研究以五种不同加工方式制备的铁核桃油为原料,检测了铁核桃油对HepG2细胞胆固醇合成代谢的影响和作用机制,证明了铁核桃油能通过调节胆固醇合成基因HMGCR,SREBP-2和CYP51基因的表达,减少HepG2细胞的胆固醇合成,起到降胆固醇的作用。结合不同加工方式铁核桃油的组成特性结果分析,推测铁核桃油中的微量伴随物是影响其胆固醇合成作用的主要物质。
