萌发绿豆中多酚类物质动态变化规律及其抗氧化活性的研究
2020-09-03肖金玲葛云飞康子悦娟全志刚王维浩刁静静曹龙奎
肖金玲 沈 蒙 葛云飞 康子悦 王 娟全志刚 王维浩,2 刁静静,2 曹龙奎,2
(黑龙江八一农垦大学食品学院1,大庆 163319) (黑龙江八一农垦大学国家杂粮工程技术研究中心2,大庆 163319)
绿豆(Mung bean),又称青小豆、菉豆、植豆等,是菜豆族豇豆属的一个植物栽培种[1],广泛分布于世界各个地区。据《本草纲目》记载,绿豆具有清热除湿、解毒、利水等功效,属医食同源作物,广泛应用于食品工业、酿造工业和医药工业等[2]。绿豆中不仅含有人体所必需的营养素,还含有许多生物活性成分,如单宁、香豆素、生物碱、皂甙和植物甾醇等[3],这些活性物质与绿豆的药理功能密切相关。萌芽可使种子中贮藏的次生代谢产物发生复杂的合成、代谢及转化反应[4],发芽时由于酶的作用,活性成分得到释放,更利于人体吸收[5]。由于酶的种类增加、活性增强,导致呼吸作用加强[6,7],异黄酮、总酚酸等含量增加[8,9]。
多酚类化合物具有抗氧化、抗肿瘤、预防或减少疾病的发生等功效。研究表明豆类植物是酚类的重要来源,酚类化合物可以保护体内生物大分子免受氧化的损伤,具有较强的抗氧化活性[10,11]。目前国内针对绿豆萌发前后多酚含量、种类、抗氧化能力及相关代谢通路等问题的比较报道较少,且不够全面。因此,对绿豆芽中多酚类化合物进行系统性分析意义重大。
本研究以自然萌发绿豆为基础,采用超声-微波协同萃取法提取绿豆多酚类化合物,结合植物广靶代谢组学定性定量分析萌发前后的绿豆多酚类物质代谢变化及差异性,并寻找相关代谢通路,并对萌发前后多酚含量及抗氧化能力加以分析,为拓宽绿豆中多酚类化合物的应用及开发绿豆芽市场等方面提供参考。
1 材料与方法
1.1 试剂与材料
1.1.1 实验材料
明绿豆、Folin试剂、没食子酸、石油醚分析纯级别、无水碳酸钠、总抗氧化试剂盒、1-二苯基-2-苦基肼自由基、甲醇和乙腈均为HPLC级别、甲酸。
1.1.2 仪器与设备
CW-2000A 超声-微波协同萃取/反应仪,FreeZone 2.5L 真空冷冻干燥机,MJ-10A 高速万能粉碎机,Specord 210 plus 紫外可见分光光度计,XCIEX AD 超高效液相色谱,Triple TOF 6600 高分辨质谱,Agilent 6490 Series 三重四极杆质谱,UPLC HSS T3色谱柱 (1.8 μm, 2.1 mm×100 mm),D24 UV 纯水仪,Heraeus Fresco17 离心机,TD5A-WS 台式离心机,HJ25-SCT-02型索氏提取器。
1.2 实验方法
1.2.1 样品的制备
1.2.1.1 原料预处理
绿豆→称取→粉碎→脱脂→脱脂绿豆粉→备用
绿豆→选取→去离子水清洗→0.4% KMnO4杀菌→去离子水清洗3次→萌发处理→预冷冻→冻干→粉碎→脱脂→脱脂绿豆芽粉→备用
1.2.1.2 样品多酚的提取
采用超声-微波(U-M)协同萃取样品多酚[12]。称取2 g样品放入150 mL容量瓶中,按照料液比1:20、乙醇溶液体积分数60%、U-M协同处理时间30 min、U-M协同处理温度45 ℃,提取2次,合并提取液离心,留取上清液备用。
1.2.1.3 多酚含量的检测
采用Folin-Ciocalteu[13]法,称取(10±0.01) mg没食子酸标准品,加水定容至100 mL容量瓶中,得0.1 mg/mL标准溶液。分别取0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL没食子酸标准溶液于100 mL容量瓶中,加入1 mL福林酚试剂,摇匀后加入2 mL质量分数为12%的 Na2CO3溶液,加水定容,摇匀。重复步骤,制作3组平行样。室温避光静置2 h,760 nm处测吸光度。以没食子酸含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
吸取1 mL样品于容量瓶中,加入1 mL福林酚试剂,摇匀加入2 mL 12%的Na2CO3溶液,加蒸馏水定容至100 mL,室温避光静置2 h,760 nm处测定吸光度。进行3次平行实验,根据标准曲线计算样品中总多酚含量,取平均值。
式中:M为总多酚含量/mg/g;A1为没食子酸浓度/μg/mL;V为定容后积/mL;N为稀释倍数;m为样品质量/g。
1.2.2 植物广靶代谢组学分析
1.2.2.1 代谢物提取[14,15]
将6 mL样品用N2吹干,加入300 μL溶剂进行复溶(甲醇水,体积比2∶1),样品在4 ℃条件下以13 000 r/min离心15 min。取上清液放入2 mL进样瓶,每个样品各取等体积混合成质控样品(Quality control,QC),QC样品以衡量系统的稳定性,进行UHPLC-MS分析。
1.2.2.2 0.1%甲酸的配制
精密吸取0.5 mL甲酸至500 mL容量瓶中,加蒸馏水稀释并定容至刻度,摇匀,即得。
1.2.2.3 超高效液相色谱条件
色谱柱为Waters Acquity UPLC,HSS T3 1.8 μm, 2.1 mm×100 mm,流动相A为0.1%甲酸水,B为乙腈。梯度洗脱条件为:0~10 min,2%~60%A;10~12 min,60%~98%A;12~13 min,98%A;13~13.1 min,98%~2%A;13.1~14 min,2%A;14~15 min,2%A;15 min,2%A。体积流量为0.4 mL/min,进样室温度15 ℃,柱温35 ℃,进样量2 μL。
1.2.2.4 质谱条件[16,17]
使用装备AJS-ESI离子源的Agilent 6490三重四极杆质谱仪,以多反应监测(MRM)模式进行质谱分析。参数为:毛细管电压+3 500 V/-3 000 V,气体(N2)温度 220 ℃,气体(N2)流量 16 L/min,鞘层气体(N2)温度 350 ℃,鞘层气体流量 12 L/min,雾化器 40 psi。
数据采集时按mass range进行分段,50~300、290~600、590~900、890~1 500,从而扩大二级谱图的采集率。每个方法每段采集4个重复。所采集获得的数据,分别使用BiotreeDB数据库及MAPS软件进行数据分析。将母离子与二级谱中的子离子组合成离子对建成MRM数据库。然后再在三重四极杆质谱仪上对所有样品进行MRM数据采集。
1.2.3 绿豆多酚体外抗氧化活性分析
1.2.3.1 DPPH自由基清除能力
取DPPH标准品10 mg,无水乙醇定容至250 mL容量瓶,备用。Ai:3 mL样品,3 mL DPPH标准溶液混匀;Aj:3 mL样品,3 mL无水乙醇混匀;A0:3 mL DPPH标准溶液,3 mL无水乙醇混匀;均静置70 min,510 nm处测吸光度值,按公式进行计算,取平均值。
式中:S为DPPH自由基清除率/%;Ai为样品吸光值;Aj为本底吸光值;A0为空白吸光值。
1.2.3.2 总抗氧化能力检测
采用总抗氧化能力(T-AOC)试剂盒测定。准确吸取待测样品0.5 mL放入样品管中,加入3.5 mL混合试剂(试剂一、试剂二、试剂三以体积比1∶2∶0.5 比例添加混合),对照管中只加入3.5 mL混合试剂,迅速放入37 ℃恒温水浴锅中,水浴30 min后取出,在样品管和对照管中分别加入试剂四0.2 mL,混匀后在对照各管中补加入待测样品0.5 mL,最后在样品管和对照管中分别加入0.2 mL试剂五,充分混匀后,室温放置10 min,于520 nm处测量各管吸光度值。按公式进行计算,取平均值。
式中:T为总抗氧化能力/U/mL;OD测量为样品管中待测样品吸光度值;OD对照为对照管中待测样品吸光度值;V反为反应液总体积/mL;V取为样品取样量/mL;A为样品测试前稀释倍数。
1.2.4 数据统计分析
实验数据分析采用Excel 2010,绘图用Origin,方差分析用SPSS。植物代谢组学数据分析[18,19]用MAPS软件,并对数据进行总峰面积进行归一化处理。使用MEV4.9.0软件绘制差异代谢物层次聚类分析热力图。
2 结果与分析
2.1 绘制标准曲线
多酚含量测定标准曲线线性回归方程为y=0.088 2x+0.005 7,R2=0.999 1,具有较好的线性关系。所得标准曲线如图1。
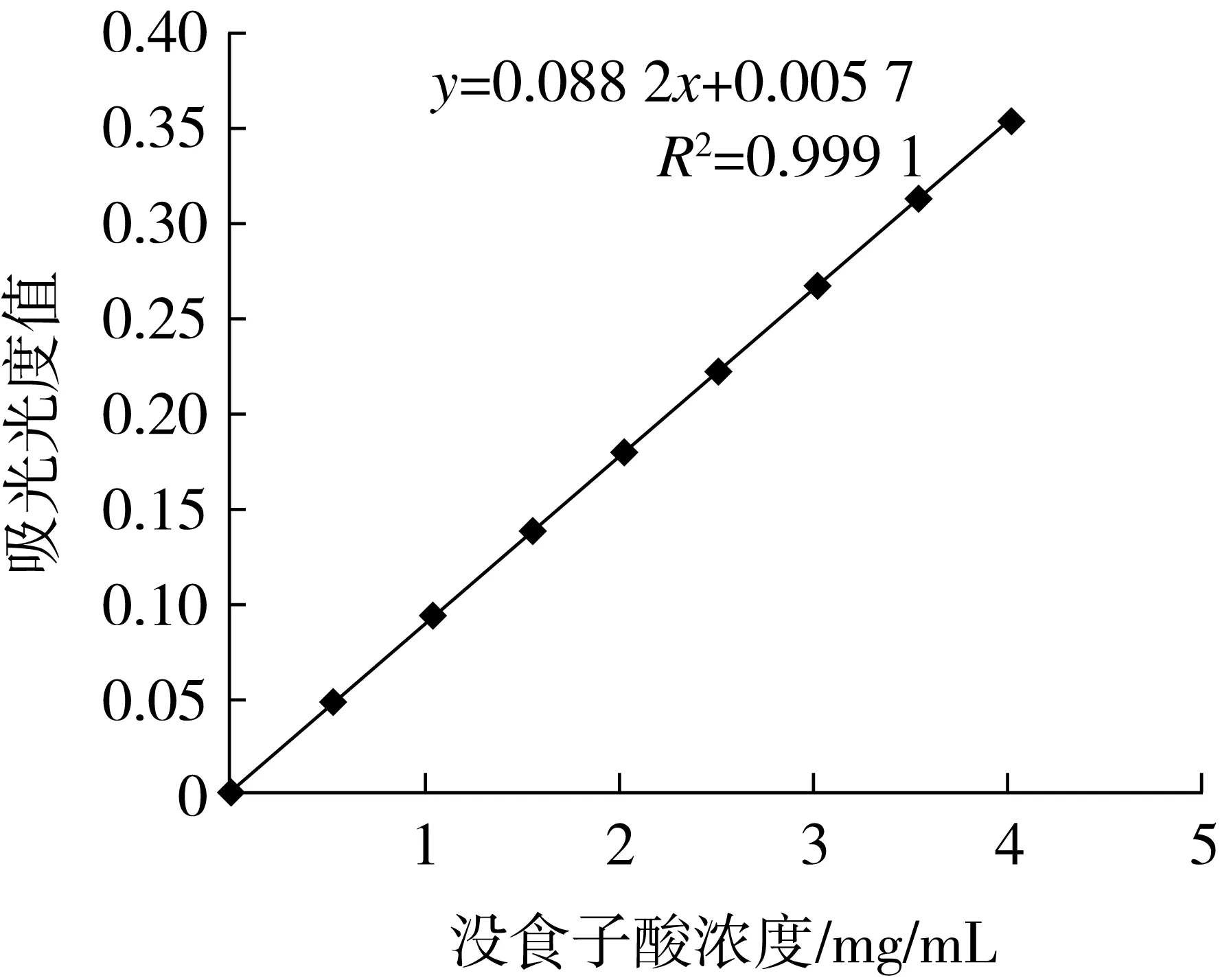
图1 多酚(以没食子酸当量计)标准曲线图
2.2 主成分分析图
图2为绿豆与绿豆芽主成分分析散点图。QC样本重合度较高,说明实验方法稳定性强、数据质量高。绿豆与绿豆芽得到了明显的区分,表明萌发前后绿豆中所含的化学成分差异显著,所建立方法可以良好表征萌发前后的成分差异。可以看出萌发前后被t [1]轴区分明显,ld位于负半轴,ly位于正半轴。

注:ld为绿豆多酚,ly为绿豆芽多酚。图2 PCA得分图
表1为萌发前后部分绿豆多酚类化合物的组成成分定性定量表,UHPLC-MS/MS分析样本中检测到超过40种相对较多的多酚类物质,根据其保留时间、文献数据准分子离子精确m/z和功能片段鉴定得出结果。其中萌发前响应最高的前10种多酚类物质为芹黄春、荭草苷、二氢槲皮素、3-羟基酪胺、表儿茶素、异樱花苷、香叶木苷、芦丁、香叶木素、(-)-表没食子儿茶素,萌发后响应最高的前10种多酚类物质为芹黄春、大豆酚内酯、香橙素、芦丁、2,4,5,7-四羟基异黄烷酮、香豆雌酚、异槲皮苷、柚皮素、黄豆苷元、荭草素。此结果与董银卯[20]在绿豆中筛选出的的12种酚酸及6种黄酮类成分相比更为系统和全面。检测到的酚类化合物大部分都涉及到各种常见疾病的研究,如癌症、抑菌、心肌损伤等[21-25]。
图3为绿豆与绿豆芽差异代谢物层次聚类分析热力图,将代谢物相对含量进行聚类,高低表达交互在一起,红色为高表达代谢物,绿色为低表达代谢物。其中根据颜色变化差异判断出各组分表达的显著性差异与表1结果相似,即调控极显著(P<0.01)的物质有根皮苷、黄豆苷、印度黄檀苷、柚皮苷、甘草甙、香叶木素、大豆酚内脂、2-羟基肉桂酸、樱黄素、二氢山柰酚、黄豆苷元、鹰嘴豆芽素A、黄豆黄素、山柰酚、(+-)-2,4,5,7,-四羟基异黄烷酮、香豆雌酚、新桔皮苷上调极显著;(-)-表儿茶素、表儿茶素下调极显著。调控显著(P<0.05)的物质有槲皮苷、异槲皮苷、染料木素、麦黄酮、二氢辣椒素酯、姜辣素对苯二酚、芥子酸、4-羟基肉桂酸、间羟基肉桂酸、松属素、间羟基肉桂酸、松属素上调显著;3-羟基酪胺、二氢槲皮素、荭草苷、香叶木素、丁子香酚下调显著。通过颜色深浅差异可知,绿豆中多酚经过萌发处理后作为绿豆芽多酚大部分组分均上调且明显,这表明萌发处理后,多酚含量变化显著。

表1 绿豆与绿豆芽中多酚类化合物组成成分

注:A为绿豆多酚, B为绿豆芽多酚。图3 差异代谢物层次聚类分析热力图
2.3 绿豆多酚含量与抗氧化活性的相关性分析
由图4可知绿豆多酚含量与清除DPPH自由基能力、总抗氧化能力在0.01水平上显著相关,相关系数分别为0.988 1和0.910 2。这与杜双奎等[26,27]的研究结果相近。其相关系数均大于0.75,证明绿豆多酚含量与DPPH自由基清除能力和总抗氧化能力之间具有良好的正相关性,可用多酚含量的变化来解释活性的变化情况。
2.4 绿豆及绿豆芽抗氧化能力的测定
绿豆多酚及绿豆芽多酚DPPH自由基清除能力及总抗氧化能力分别为87.94%、92.64%和28.52 U/mL、33.06 U/mL,萌发处理后多酚清除DPPH能力上升了5.07%。总抗氧化能力升高了4.54 U/mL。这与梁雅芹[28]研究的在萌发过程中绿豆酚类物质及抗氧化活性变化的结果相似。而抗氧化能力上升的原因是萌发过程中发生酶激活作用,大量种皮上的酚类化合物被溶出,提高了多酚的提取含量。由于绿豆中抗氧化成分比较多,除多酚物质外,还存在水溶性维生素E、维生素C等抗氧化成分,这些物质也会在萌发过程中被激发出来,进而被抗氧化试剂盒测出。

图4 绿豆多酚含量与清除DPPH自由基及总抗氧化能力的关系
表2是通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Gnomes,KEGG)注释分析得到差异代谢物参与的通路,涉及到20种代谢通路的差异代谢,其中芹黄春、黄豆苷、柚皮苷、金圣草黄、樱黄素、松属素及新桔皮苷只参与1种代谢通路,其他多酚组分均参与2种以上代谢通路,甲氧基肉桂酸参与的代谢通路高达9种,说明这些酚类物质存在于比较复杂的代谢通路中。
3 结论
本实验将植物广靶代谢组学方法应用于绿豆萌发前后多酚类化合物成分改变的研究,分析鉴定出绿豆中存在多酚类化合物46种,检测出萌发后提取液抗氧化能力增强,且多酚含量与抗氧化能力呈线性关系,并通过KEGG分析得到了20个代谢通路。在定性出的46种多酚类物质中表儿茶素[29,30]、芦丁[31,32]、咖啡酸[33]、黄豆黄素[34]、槲皮素[35,36]等研究较为广泛,但间香豆酸、柚皮苷、二氢刺芒柄花素、印度黄檀苷、荭草素等物质鲜有研究。萌发处理过程使绿豆中的部分高活性的多酚类物质被激活,使其含量显著增加,抗氧化能力进一步提升,说明萌发后部分多酚类物质含量增高,成为抗氧化能力增强的主导因素,该结果为后续绿豆萌发处理提供可行性参考,也为绿豆的开发利用以及功能性食品的开发提供参考。后续研究可对绿豆中多酚类化合物进行分离纯化,并进行定量分析,进一步分析萌发后哪种多酚类物质主导使抗氧化活性增强,通过抑制某些代谢通路进行体内体外实验,获得所需的效果。

表2 差异代谢物参与的代谢途径
