糖尿病合并严重肢体缺血动物模型的骨髓微血管改变:DCE-MRI及基于Ktrans图的纹理分析
2020-08-28杨柳查云飞陈翩翩柳柏玉闫玉辰王焰
杨柳,查云飞,陈翩翩,柳柏玉,闫玉辰,王焰
糖尿病(diabetes mellitus,DM)是一种以胰岛素抵抗和/或胰岛素分泌缺陷为基本病理改变所引起的以高血糖为主要临床特征的代谢异常综合征[1],长期糖、脂类物质代谢异常可导致血管闭塞。近年来DM合并外周动脉疾病(peripheral arterial disease,PAD)发生率明显升高[2],严重肢体缺血(critical limb ischemia,CLI)时肢体动脉闭塞导致血流不能满足静息时肢体代谢需要的状态,是PAD的最晚期阶段[3],是截肢的严重危险因素[4]。
近年来研究结果显示糖尿病骨病可能是一种慢性骨髓微血管并发症[5],Hu等[6]首次运用动态对比增强磁共振成像(DCE-MRI)对兔糖尿病模型的椎体骨髓进行定量分析,结果显示动态增强参数可以评价糖尿病早期骨髓微血管渗透性和血流灌注变化。影像组学(radiomics)采用高通量特征提取算法,通过对病灶的分割、特征数据提取、数据库的建立和个体化数据分析来逐步实现图像的定量分析[7]。纹理分析(texture analysis,TA)是对图像像素灰度值的局部特征、变化规律及其分布模式进行分析,最终对图像的性质、类别进行区分及归类[8]。近年来,纹理分析在骨健康、退行性病变、创伤以及肿瘤的诊断和鉴别诊断、疗效评估及预后预测等方面均显示出较大应用价值[9]。本研究旨在探讨基于DCE-MRI定量参数及容量转移常数的纹理分析技术在评估兔糖尿病合并严重肢体缺血模型骨髓改变中的应用价值。
材料与方法
1.兔糖尿病合并严重肢体缺血动物模型的建立
本实验经武汉大学人民医院伦理委员会审查通过,所有动物处置均遵循实验动物伦理原则。选取20只健康新西兰雄性大白兔,由武汉大学人民医院实验动物中心提供(单笼饲养,室温控制在25℃),空腹体重2.6~3.0 kg,平均(2.8±0.2) kg。所有实验动物在适应性饲养1周后进行造模,造模前均禁食、不禁水12 h,测量空腹血糖,血糖值均<6.0 mmol/L,平均(5.5±0.3) mmol/L。将四氧嘧啶(Sigma公司)与0.9%的生理盐水配制成浓度为5%的溶液,按照100 mg/kg的剂量快速经兔的耳缘静脉注入。48 h后,使用血糖仪(三诺安信血糖仪)测量兔外周血糖浓度,单次测量值≥14 mmol/L或两次测量值≥11 mmol/L即认定为兔糖尿病模型造模成功。继续喂养4周后,复测血糖,所有实验兔的血糖值符合糖尿病诊断标准。
将实验兔随机分为实验组10只和假手术组10只,两组间血糖值的差异无统计学意义(P>0.05)。实验组在糖尿病模型基础上建立肢体缺血模型,操作方法:经兔耳缘静脉注射3%戊巴比妥钠溶液进行麻醉,剂量1.3 mL/kg,在右后肢腹股沟韧带中点处切开皮肤,分离脂肪及筋膜层,暴露、游离股动脉,双线结扎后从中间剪断血管,术毕逐层缝合皮肤。假手术组仅切开股鞘,随即缝合皮肤。
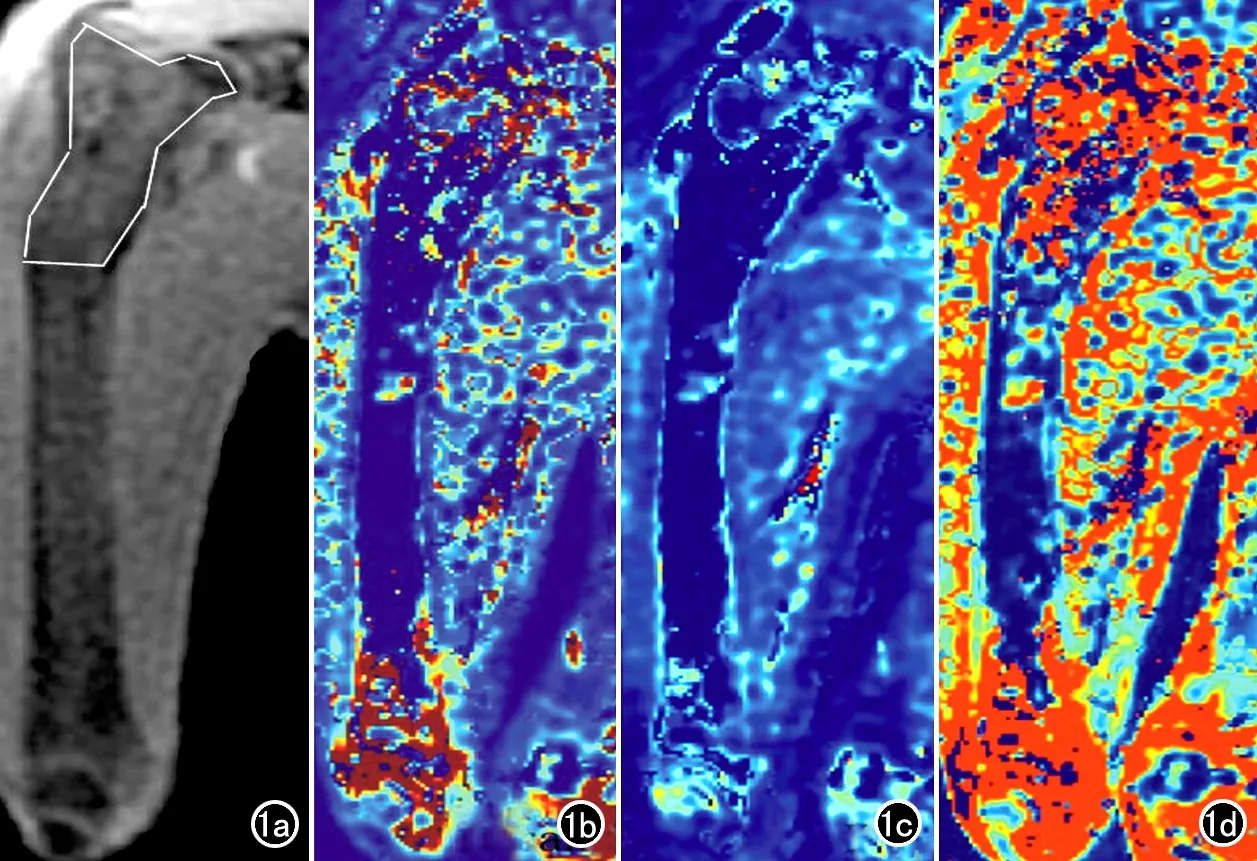
图1 实验组兔各序列图像。a)股骨冠状面LAVA序列MRI增强图像,白色线条区域为手动勾画的股骨上段ROI;b)Ktrans伪彩图;c)Kep伪彩图;d)Ve伪彩图。
2.影像设备及成像方法
在造模成功后的第1、5、10、15、20和25天对所有实验兔进行血糖检测、数字化X线摄影及MRI检查。
每次行MRI检查前测量实验兔的血糖值,并采用Shimadzu SonialVisionI G4数字化X线摄影系统进行检查,扫描参数:68 kV,160 mA,8.1 ms。检查前由一位具有5年以上工作经验的介入科医师经腹主动脉入路插入肝素浸泡的3F微导管,头端置于腹主动脉内,手动匀速(约2~3 mL/s)注射碘佛醇(320 mg I/mL)20 mL。
MRI检查使用GE Discovery MR750 Plus 3.0T超导MR机和8通道膝关节专用相控阵线圈,将兔麻醉后仰卧位、足先进固定于扫描床上,行右股骨MRI平扫和增强扫描。
冠状面FSE-T1WI参数:TR 300 ms,TE 13 ms,层厚3 mm,层间距0 mm,视野160 mm×160 mm,矩阵320×288;冠状面FSE-T2WI参数:TR 2500 ms,TE 120 ms,视野160 mm×160 mm,层厚3 mm,层间距0 mm,矩阵320×320。
DCE-MRI扫描:扫描序列为肝脏快速容积采集(liver acquisition volume acceleration,LAVA)及阵列空间敏感编码技术(array spatial sensitivity encoding technique,ASSET)。首先行多翻转角LAVA序列扫描(TR 3.5 ms,TE1.6 ms,层厚3.0 mm,视野20 cm×16 cm,矩阵192×192,翻转角为9°及12°),每个翻转角序列扫描一个时相(8 s);随后行冠状面LAVA序列动态增强扫描(TR 3.5 ms,TE 1.6 ms,层厚3.0 mm,视野20 cm×16 cm,矩阵192×192,翻转角10°),连续无间隔同层扫描420帧动态图像,总计扫描35个时相,总扫描时间为4 min 31 s。在基线扫描2个动态时相之后使用双筒高压注射器经兔耳缘静脉团注钆双胺,剂量为0.2 mmol/kg,注射流率1.0 mL/s,随后以相同流率注射0.9%生理盐水5 mL冲管。
3.DCE-MRI定量参数及纹理分析
采用GE Omni-Kinetics软件对DCE-MRI扫描数据进行后处理和分析。首先对35期动态增强图像进行3D非刚性运动校正,以降低呼吸运动伪影,然后导入两个翻转角(9°和12°)LAVA序列图像,用于T1-mapping的计算,再将校正后的35期增强图像导入。首先在兔左股动脉手动勾画兴趣区ROI,获得时间-浓度曲线,进而确定动脉输入函数(arterial input function,AIF);随后在兔右侧股骨上段内勾画ROI,注意避开骨皮质、骨岛及血管,采用merge功能将每个层面的ROI融合为三维容积兴趣区(VOI),利用药代动力学Extended Tofts Linear双室模型,得到右股骨上段骨髓的血容量转移常数(Ktrans)、速率常数(Kep)、对比剂血管外细胞外间隙(extravascular extracellular space,EES)的容积(Ve),重复测量3次,各参数取3次测量值的平均值作为最终结果(图1)。同时在于Ktrans图上提取ROI内3个类别的纹理特征共67个,包括灰度直方图(histogram)特征29个、灰度共生矩阵(the gray-level co-occurrence matrix,GLCM)特征28个和灰度游程矩(the gray run-length matrix,GRLM)特征10个。
4.组织病理学检查
在造模后第25天MRI检查完成后,采用空气栓塞法处死所有实验兔,取股骨上段,使用4%多聚甲醛溶液进行固定、脱钙1个月后,石蜡包埋,沿股骨纵轴方向切取4μm厚薄片,行HE染色以及免疫组化染色。免疫组化染色测量组织内微血管密度的方法:每张切片随机挑选至少3个视野(×200)进行拍照。拍照时尽量让组织充满整个视野,尽量保证每张照片的背景光一致。CD31表达于血管内皮细胞,以血管内皮细胞的胞质内出现棕黄色颗粒为阳性。先在低倍光镜下扫查整个切片,寻找3个血管高密度区,即“热点”;然后在 200 倍光镜下计数染色呈阳性的血管数,对于微血管的识别不需具备完整的管腔和红细胞,只要有明显的血管内皮细胞染色、并且能与相邻的血管、肿瘤细胞以及间质成分相分隔,就可视为一个独立的血管,分辨不清以及具有较厚肌层的血管不纳入计数;取3个相互不连续区域的测量结果的平均值作为微血管密度(microvessel density,MVD)值。
使用Nikon Eclipse CI光学显微镜,在高倍镜下(×400)选取3个独立的相同面积区域进行观察并拍片。应用Media Cybermetic ImagePro Plus 6软件对图像进行分析,测量HE染色切片中骨小梁结构参数,包括骨小梁数量和面积(图2)。

图2 股骨上段病理图。a)应用AOI工具标记骨小梁;b)使用颜色选取工具标记出所有骨小梁,即可进行骨小梁的计数和面积测量。 图3 实验组兔数字化X线摄影图像。a)结扎第1天,股动脉结扎处(箭)远端血管内无对比剂充盈;b)结扎第25天,股动脉闭塞处远端分支显影(箭),提示侧支循环建立。 图4 术后第25天兔股骨骨髓CD31免疫组化检查,显微镜下(×400)可见实验组骨髓内微血管较假手术组明显增多(箭)。a)实验组;b)假手术组。 图5 术后第25天兔股骨上段HE染色,显微镜下(×400)可见实验组骨小梁分布稀疏,骨小梁的数量和面积较假手术组明显减少。a)实验组;b)假手术组。
5.统计学分析
使用SPSS 21.0软件进行统计分析,先对各参数行正态性检验及方差齐性分析,符合正态分布的参数以均数±标准差表示,不符合正态分布的参数用中位数(上、下四分位数)表示。采用独立样本t检验(数据满足正态分布和方差齐性检验)或者Mann-WhitneyU检验(数据不符合正态分布或方差齐性)比较同一时间点各组间DCE-MRI参数值的差异;对不同时间点的Ktrans值的比较采用重复测量方差分析,如球形检验结果为P>0.05,采用多变量方差分析方法(MANOVA)进行检验分析。
采用独立样本t检验或者Mann-WhitneyU检验筛选实验组和假手术组间差异有统计学意义的纹理参数特征。采用Pearson相关分析评价骨髓微血管渗透性参数、MVD及组间差异有统计学意义的纹理参数(MeanValue、MPP、sumAverage)与骨小梁数量和面积的相关性、以P<0.05为差异具有统计学意义。
结 果
1.实验动物管理的基本情况
实验过程中实验组及假手术组兔因麻醉、健康状况差各死亡4只,每组余6只实验动物。
2.数字化X线摄影检查
在每个时间点,实验组中股动脉造影显示股动脉结扎处均未再通,术后25天可见结扎股动脉的远端有侧支循环形成(图3)。
3.组织病理学
造模第25天,CD31免疫组化检查显示实验组中股骨上段骨髓的MVD较假手术组明显增高(图4);HE染色显示实验组的股骨上段骨小梁数量(Tb-N)和面积(Tb-Ar)较假手术组明显变少(图5),差异均有统计学意义(P<0.05)。
4.DCE-MRI定量参数分析
各时间点实验组和假手术组的DCE-MRI定量参数值和组间比较结果及组间差异有统计学意义的纹理参数值见表1。两组间各时间点的Ktrans值的差异均有统计学意义(P<0.05)。实验组造模成功后第1天的Ktrans值降低,之后呈升高趋势,第25天时Ktrans值仍低于假手术组(图6)。两组间仅于第5天时Kep值的差异有统计学意义(P<0.05)。而各时间点Ve值的组间差异均无统计学意义(P>0.05)。

图6 各时间点实验组和假手术组中实验兔股骨骨髓Ktrans值的变化趋势图。 图7 实验组术后第25天兔股骨上段骨髓的Ktrans值与病理检查指标间的相关性分析散点图。a)Ktrans值与MVD呈正相关关系;b)Ktrans值与Tb-N呈负相关关系;c)Ktrans值与Tb-Ar呈负相关关系。
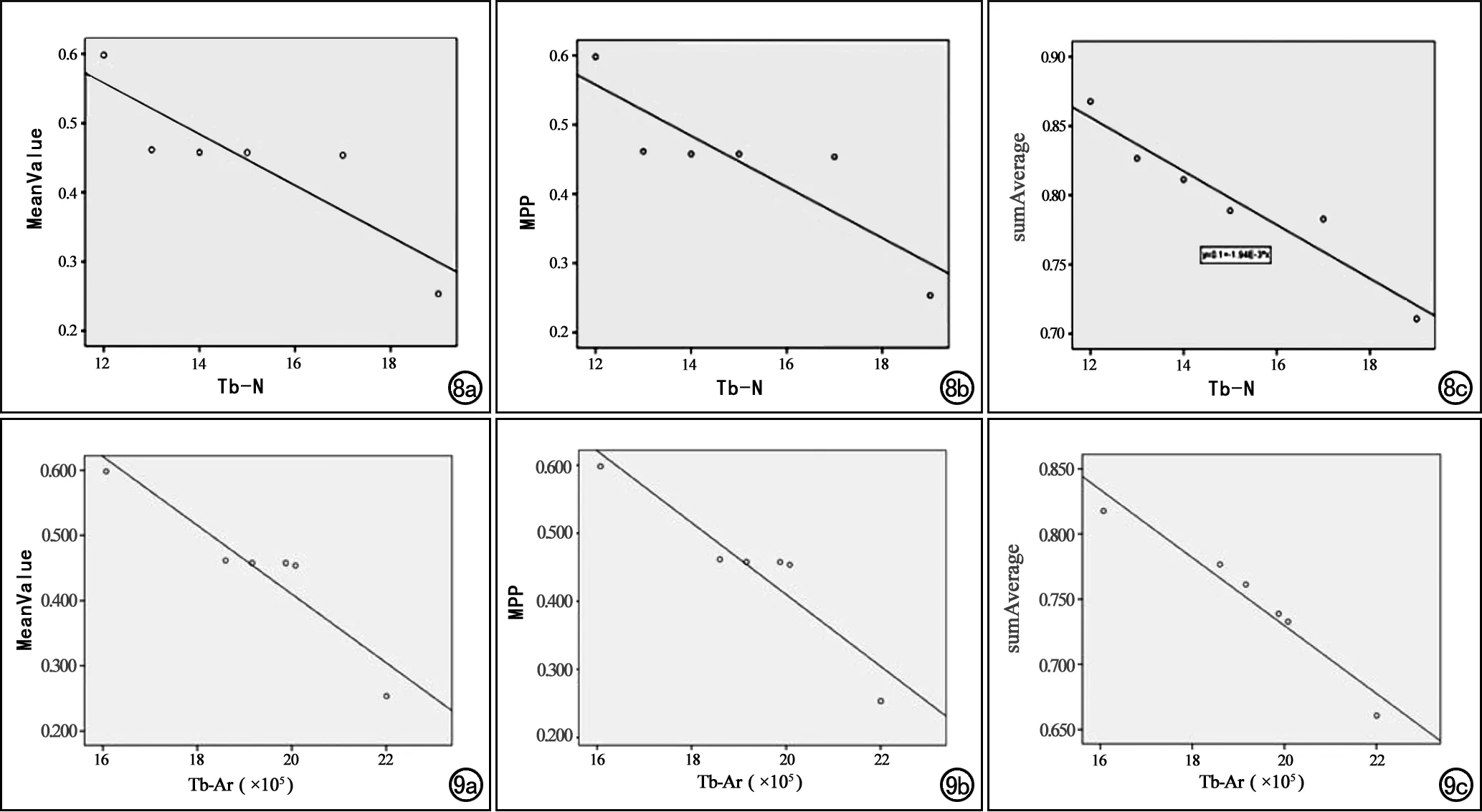
图8 术后第25天实验组股骨上段的Tb-N与基于Ktrans图的组间差异有统计学意义的3项纹理参数的相关性分析散点图,显示3项纹理参数与Tb-N均呈负相关关系。a)MeanValue;b)MPP;c)sumAverage。图9 术后第25天实验组股骨上段的Tb-Ar与基于Ktrans图的组间差异有统计学意义的3项纹理参数的相关性分析散点图,显示3项纹理参数与Tb-Ar均呈负相关关系。a)MeanValue;b)MPP;c)sumAverage。
相关性分析结果显示(图7):实验组的股骨上段骨髓Ktrans与MVD呈显著正相关(r=0.827,P<0.05),而Kep、Ve与MVD之间均无显著相关关系(r=0.067,P>0.05;r=0.139,P>0.05);Ktrans与Tb-N、Tb-Ar均呈显著负相关(r=-0.891,P<0.05;r=-0.922,P<0.05)。假手术组的股骨上段骨髓Ktrans与MVD呈显著正相关(r=0.895,P<0.05);Ktrans与Tb-N、Tb-Ar呈显著负相关(r=-0.877,P<0.05;r=-0.814,P<0.05)。
6.基于DCE-MRI Ktrans图的纹理分析
实验组与假手术组之间在各时间点差异均有统计学意义的纹理参数有3个,分别为像素信号平均值(MeanValue)、正像素平均值(mean value of positive pixels,MPP)和平均值总和(sumAverage),各时间点的参数值及组间比较结果见表1。相关性分析结果显示(图8~9),3个纹理参数均与Tb-N呈负相关(r=-0.891,P=0.0017;r=-0.891,P=0.0017;r=-0.963,P=0.002),与Tb-Ar呈负相关(r=-0.922,P<0.05;r=-0.922,P<0.05;r=-0.972,P<0.05)。

表1 实验组、假手术组各时间点定量参数及有意义纹理参数的比较结果
讨 论
本研究首次采用基于DCE-MRI的微血管渗透性参数Ktrans来评价糖尿病合并严重肢体缺血兔模型早期骨髓的变化情况,实验组造模成功后第1天Ktrans值明显降低,之后呈升高趋势,但Ktrans值始终低于假手术组;实验组和假手术组各时间点之间Ktrans值的差异均有统计学意义;Kep值仅在术后第5天的组间差异存在显著性意义;而各时间点Ve值的组间差异均无统计学意义。Ktrans值与骨髓MVD及Tb-N、Tb-Ar均具有高度相关性(P<0.05)。造模后第25天,实验组中MeanValue、MPP和sumAverage三项纹理参数与Tb-N、Tb-Ar均呈显著负相关关系(P<0.05)。
Ktrans值代表单位时间内对比剂从血管进入细胞外间隙的数目,其值受到单位体积内的血流量、毛细血管的渗透性及表面积等因素的影响[10]。在本研究中,由于结扎股动脉,会造成骨髓血流灌注急剧降低,故第1天股骨上段Ktrans值明显降低;随着时间推移,结扎股动脉的远端侧支循环形成,Ktrans值亦呈升高趋势,CD31免疫组化结果也显示第25天时实验组中兔骨髓MVD较假手术组明显增多,可能系实验组中骨髓内大量新生血管形成所致。这种改变可能与缺氧诱导因子-1(hypoxia inducible factor 1,HIF-1)密切相关,由于结扎了股动脉造成股骨骨髓缺、缺氧,在缺氧状态下血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达是由HIF-1诱导的,VEGF促进新生血管形成[11]。HIF-1靶基因的基质金属蛋白酶(matrix metallo proteinases,MMPs)通过调节基质代谢间接促进血管新生,MMPs降解细胞外基质,使内皮细胞和基底膜间的连接变松弛,有利于内皮细胞的迁移、增殖和分化[12]。
Kep为对比剂从血管外-细胞外间隙(EES)反流回血管的速率,在两组间的差异仅在术后第5天时有统计学意义(P<0.05),而在其它各时间点时均无统计学意义。其原因可能在于后期新生血管丰富且结构异常、血管内皮细胞发育不完善及血管通透性强导致对比剂回流增加,组间差异不显著。
Ve主要反映在EES中对比剂浓度整个组织中所占百分比,Ve可反映组织内炎症或坏死的程度[13]。本研究中各时间点Ve值的组间均无统计学意义,可能由于本实验研究中实验周期较短,分析的是糖尿病合并严重肢体缺血后的早期改变,此时骨髓组织尚未出现明显坏死。
Teraa等[14]首次报道严重肢体缺血患者骨髓MVD降低,与是否合并有糖尿病无关。在我们的研究中,实验组中兔骨髓MVD呈代偿性增高,这可能是因为我们研究的是疾病早期模型,而Teraa等的研究中实验对象为长期稳定模型;此外,在第25天时,实验组的肢体骨髓灌注仍然低于假手术组,表明尽管MVD有所增高,但实验组的血流灌注仍难以恢复至正常水平。
纹理分析通过将纹理的空间结构差异转化为特征灰度值的差异,可以量化不被肉眼识别的变化所产生的图像异质性[15]。本研究首次开展对糖尿病合并严重肢体缺血的骨髓微结构的纹理分析,结果显示实验组和假手术组之间在各时间点测量值的差异均有统计学意义的纹理参数有3个,为MeanValue、MPP和sumAverage。MeanValue代表ROI中所有像素点的信号强度的平均值,MPP反映了图像上正像素的平均信号强度。本研究中这两个参数的测量值相同,可能是由于本实验中分析的是糖尿病合并严重肢体缺血的早期变化,暂未出现负像素(如坏死区),故实验模型中骨髓ROI全部像素点的测量值均为正值,无负值,故MeanValue和MPP数值相同,且均与Tb-Ar、Tb-N呈高度相关关系。我们推测,实验组兔在结扎股动脉后,股骨上段血流灌注显著降低,尽管后来有侧支循坏的建立,但骨髓组织仍处于缺血、缺氧的状态,骨髓营养供应不足,继而引起骨小梁数量和面积减少。sumAverage用于测量行或列方向上图像灰度的相似度,此纹理参数鲜见报道,在本实验模型中,可能由于肢体动脉闭塞致血流不能满足代谢需要,骨的微结构紊乱,骨小梁结构和形态发生改变,骨小梁稀疏且厚薄不一,导致图像行列的灰度值差异较大。Ktrans与Tb-N和Tb-Ar也呈高度相关,也验证了我们提出的假说:骨髓微血管灌注及渗透性影响到骨小梁微结构,最终导致了骨髓纹理参数值出现变化。
本研究的局限性:第一,本研究中实验样本量较小,糖尿病合并严重肢体缺血股骨骨髓微结构及微血管通透性的变化机制仍需大样本研究予以证实;第二,实验中建立的动物模型与临床上糖尿病合并肢体严重缺血患者的自然病程之间存在差异;第三,纹理分析技术目前仍存在着一些问题,例如影像采集模式及分割阈值等都会影响所提取特征的测量结果,部分纹理特征也存在着重复性差的局限性,此外,在图像分割过程中手动分割图像会导致观察者间的差异。
总之,DCE-MRI定量参数可以评价糖尿病合并严重肢体缺血早期骨髓微血管灌注及渗透性的改变;基于MRI Ktrans值的纹理分析对评价糖尿病合并严重肢体缺血的骨髓微结构改变是可行的。
