注射用罗替戈汀微球延缓MPTP致神经元损伤作用探讨
2020-08-26朱晓音赵昕昱田付港
付 洁,朱晓音,赵昕昱,田付港,于 昕
(烟台大学药学院,烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005)
帕金森病(Parkinson's disease,PD)为第二大中枢神经系统退行性疾病[1].近50年来,左旋多巴(Levodopa,L-DOPA)补充多巴胺(Dopamine,DA)缺乏仍是缓解PD运动症状的主要措施[2],但在研究及临床使用中发现,在服用L-DOPA的后期,由于其较短的半衰期而形成的脉冲式DA能刺激,导致PD患者晚期出现严重的运动并发症[3]. 基于此,OLANOW等提出通过改进多巴胺能药物的给药方式或给予长半衰期的多巴胺能药物来提供持续性的多巴胺受体刺激(continuous dopaminergic stimulation, CDS)[4].研究发现,CDS和平稳的血药浓度可预防和减少运动并发症和晨僵现象[5-6]. 因此,提供和/或恢复CDS已经成为治疗PD的重要研究目标.
罗替戈汀是一种非麦角类多巴胺受体激动剂,临床试验结果表明其具有抗PD的活性[7]. 山东绿叶制药有限公司研制的注射用罗替戈汀缓释微球(Rotigotine Extended-release Microspheres for Injection,RoMS)是以乙交酯丙交酯共聚物(PLGA)为辅料制成的长效缓释微球,一次肌肉注射(intramuscular,i.m.)给药可持续平稳释药7 d[8],从而对多巴胺神经元产生持续性的生理刺激.
基于以上研究,本实验采用1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3, 6-tetrahydropyridine,MPTP)诱导小鼠PD模型,以RoMS为实验用药,探讨CDS给药方式对神经元损伤的延缓作用[9-10].
1 实验材料
1.1 实验动物
雄 性 SPF 级 C57BL/6 小 鼠 (80 只, 6~8 周龄, 质量 18~20 g,华阜康生物科技公司,动物许可证号:SCXK(京)2014-0004).小鼠饲养在山东绿叶实验动物中心SPF 级屏障饲养环境,室温保持20~26 ℃,垫料每周更换1次,自由饮水和自由采食,12 h 光照,12 h 黑暗.
1.2 药品与试剂
MPTP(批号:SLBS6630)(Sigma);GTVision TMIII型免疫组化检测试剂盒(含DAB)(上海基因科技股份有限公司);Actin抗体(小鼠单抗)、GAPDH抗体(小鼠单抗)、NF-κB抗体、nNOS抗体、COX-2抗体、Cyt-C抗体(CST);BCA浓度测定试剂盒(增强型)、酶标山羊抗兔IgG、山羊抗鼠IgG(碧云天生物技术公司).
1.3 仪器
酶标仪(美国伯腾仪器有限公司);小鼠转棒测试仪(Panlab 公司);SuperTst高通量悬尾实验分析系统、SuperFst强迫游泳实验分析系统(上海欣软信息科技有限公司);全自动化学发光成像凝胶成像系统(北京赛智创业科技有限公司);OLYMPUS IX73倒置荧光显微镜(北京奥林巴斯有限公司);冰冻切片机(中国赛默飞世尔科技有限公司);Vectra3定量病理成像分析系统(上海珀金埃尔默企业管理有限公司).
2 实验方法
2.1 MPTP诱导小鼠PD 模型的建立及分组
根据文献报道的剂量和方法,结合预试验结果,除对照组以外的小鼠连续腹腔注射(intraperitoneal, ip)MPTP(25 mg/kg) 7 d. 对照组小鼠给予等体积的羧甲基纤维素钠(1% CMC-Na). 筛选完造模成功的小鼠后进行为期14 d的给药,每组14只.
PD模型的建立、具体分组与给药见图1.
2.2 检测指标
2.2.1 行为学实验 在实验前一周对小鼠进行训练,在第一次给药后第5、7、12、14天进行行为学转棒、悬尾及强迫性游泳实验,每个实验间隔20 min以上.
2.2.2 Western blot 方法检测小鼠黑质nNOS,Cyt-C蛋白表达 每组随机取3只小鼠,用生理盐水进行心脏灌注,取脑,采用BCA法提取小鼠黑质区蛋白,以50 μg为上样量进行Western blot实验,结果采用image J软件分析,用目标条带与内参蛋白条带光密度值比值表示.
2.2.3 免疫组化方法检测小鼠黑质TH表达 对各组小鼠的脑组织用梯度蔗糖(10%,20%,30%)进行脱水固定,随后对中脑黑质行冠状冰冻切片(20 μm),按照免疫组化步骤进行染色,采用Vectra3定量病理成像分析系统拍摄图片,ImagePro Plus软件分析TH阳性神经元数量.
2.3 统计分析
3 实验结果
3.1 RoMs对MPTP诱导PD模型小鼠行为学的影响
如表1—3数据所示,在4个观察时间点内,模型组的转棒、悬尾及游泳时间始终与正常组保持显著性差异(P<0.05);另外,3个给药组小鼠的运动时间在不同的时间点始终高于模型组,表明小鼠行为能力在给药期间得到了持续改善,其中,各给药组的悬尾时间和游泳时间均表现出统计学差异(P<0.05),而在转棒时间的观察上,只有联合用药组始终具有显著性差异(P<0.05).
在给药结束后第14天的观察中,L-DOPA组的疗效出现下降趋势,运动时间明显低于RoMS及联合用药组(P<0.05). 以上结果说明随着疾病进一步发展,L-DOPA的脉冲式刺激可能使神经元受损严重,诱导了运动并发症的发生,而RoMS及联合用药则显示出对损伤神经元的保护作用. 其中,联合给药组行为学改善作用表现更优,说明联合用药既可协同增效,又可以降低L-DOPA的用药剂量,延缓或减少运动并发症的发生.

表1 给药期不同时间点小鼠转棒实验数据

表2 给药期不同时间点小鼠悬尾实验数据
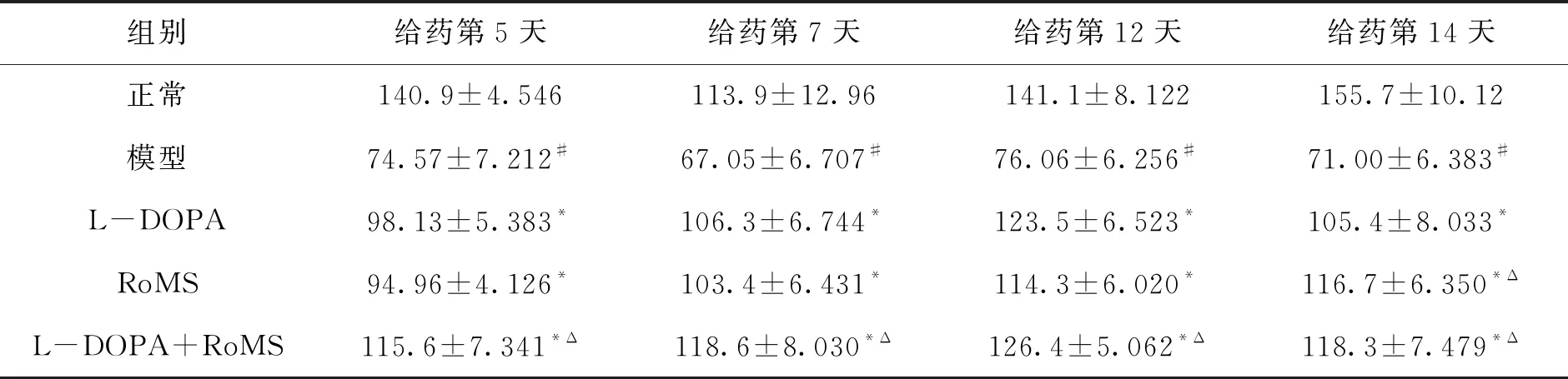
表3 给药期不同时间点小鼠游泳实验数据
3.2 RoMs对 MPTP诱导PD模型小鼠氧化应激相关蛋白表达的影响
如图2所示,与模型组相比,3个给药组nNOS和Cyt-C蛋白含量均显著下降(P<0.01);与L-DOPA组相比,RoMS组与联合给药组nNOS和Cyt-C蛋白含量均下降,其中,联合用药组优势更为明显(P<0.05),说明RoMS辅助低剂量L-DOPA给药抗氧化应激减轻神经元损伤作用更强.
3.3 RoMs对 MPTP诱导PD模型小鼠黑质酪氨酸羟化酶(TH)表达量的影响
如图3所示,与空白组相比,模型组的TH阳性神经元数目显著减少(P<0.01),与模型组相比,3个给药组神经元数目均明显增多(P<0.01).而与L-DOPA组相比,RoMS组与联合用药组的阳性神经元数目更多,说明CDS治疗方式对神经元具有一定的保护作用.进一步统计结果表明,联合用药组神经保护作用优于RoMS组,与行为学实验结果吻合.
4 讨 论
研究显示,L-DOPA的脉冲式刺激造成的运动障碍给PD患者的治疗带来了很大困扰. 此外,相较于平稳的CDS给药,脉冲式刺激更能诱发L型谷氨酸能作用,导致神经元进入氧化应激状态[11]. 基于以上理论,本文在行为学,组织学和细胞学水平探讨缓释制剂RoMS对DA神经元的保护作用.
MPTP是一种亲脂性神经毒素,可顺利通过血脑屏障进入小鼠脑中,转化为1-甲基-4-苯基吡啶离子(MPP+),随后被摄入多巴胺能神经元线粒体,导致线粒体膜电位的缺失、活性氧的形成以及氧化应激状态等,最终导致细胞死亡.采用MPTP诱导的动物模型,其病理变化基本与PD患者的病理变化相似,因此,被作为PD动物模型之一.
转棒实验、悬尾实验和强迫游泳实验可用来评价肌肉僵直以及运动障碍情况[12]. 实验结果显示,在连续用药14 d后,L-DOPA组3个行为学实验的运动时间均明显低于RoMS及联合用药组,说明CDS给药方式可能通过减轻神经元损伤而发挥更好的症状改善作用. 值得一提的是,RoMS联用低剂量L-DOPA,可产生协同增效的作用.
研究表明,脉冲式的DA能刺激可使L型谷氨酸大量增加,nNOS表达量增高,并产生大量的活性氧(ROS),导致神经元进入氧化应激状态,使线粒体功能受损,释放出大量的Cyt-C,损伤DA神经元,参与包括帕金森症在内的几种人类疾病的发病机制[13]. 本实验结果显示,与L-DOPA组相比,RoMS和联合给药组nNOS和Cyt-C蛋白含量明显降低,说明CDS给药具有抗氧化应激减轻神经元损伤作用.
TH是DA合成的限速酶,可间接反映DA神经元的数量[13]. 本实验结果显示,RoMS组与联合用药组TH阳性神经元数目比L-DOPA组更多,表现出明显的神经保护作用.
5 结 论
本研究结果表明,RoMS具有抗氧化应激,减轻神经元损伤,改善运动障碍的作用.且RoMS联用低剂量L-DOPA,可同时发挥协同增效和神经保护作用.
