直接PCR法在猕猴桃溃疡病检测中的建立
2020-08-25李智念羊炼刘露
李智念 羊炼 刘露


摘 要:通过优化PCR反应体系和反应程序,本文建立了使用猕猴桃枝条为样品,直接检测猕猴桃溃疡病PSA病原菌的方法。该方法跳过了病原菌培养和DNA提取步骤,大大缩短了检测时长,利用微型PCR仪系统,使针对猕猴桃溃疡病的简单、低成本、快速现场检测成为可能。
关键词:猕猴桃溃疡病;检测方法;直接PCR
中图分类号:S436.634文献标识码:A文章编号:1003-5168(2020)20-0139-03
Abstract: By optimizing the PCR reaction system and reaction program, a method for directly detecting the pathogenic bacteria of kiwi fruit ulcer PSA by using kiwi twigs as a sample was established in this paper. The method skips the steps of pathogen culture and DNA extraction, greatly shortens the detection time, and utilizes a micro-PCR system, which makes simple, low-cost and fast on-site detection for kiwi fruit ulcer possible.
Keywords: kiwi fruit ulcer;detection method;direct PCR
近年來,我国猕猴桃种植面积不断增加,细菌性溃疡病快速蔓延[1-2]。在没有特效防治药品的现状下,加强外引苗木的检疫、及早清除园中感染植株是防范溃疡病,避免果园全军覆没的重要手段。植株感病的早期虽然不表现出相应性状,但已经具备传播扩散致病菌的能力,要及早发现已染病植株并不容易。
PCR检测能够高效准确地鉴定出PSA病原菌,但现有的方法一般要首先采样培养病原菌,然后提取培养出的菌落DNA,再进行PCR检测。这样的流程需要专业人员操作,很难应用到猕猴桃园的常规检测。面对基层猕猴桃园主的自主快速检测方法,目前国内还少有报道。本研究通过优化普通PCR的反应体系与程序,跳过病原物培养和DNA提取过程,直接以猕猴桃枝条为样本进行PCR反应;整合现有仪器设备,避开了常规PCR试验对高速离心机、成像系统或荧光定量系统的依赖,建立了一套简单、可靠、准确、快速、低成本的检测方法,旨在为发展出一种基层猕猴桃园主用得起、用得上的猕猴挑溃疡病早期检测技术,为我国猕猴桃栽培的健康发展提供帮助。
1 材料与方法
1.1 供试菌种
从明显发生溃疡病的猕猴桃枝条中分离保存的PSA病原菌。
1.2 猕猴桃枝条
分别以明显发生溃疡病的猕猴桃枝条(见图1)、未见病征的猕猴桃枝条(见图2)和已确认未感染PSA病原菌的猕猴桃枝条(见图3)为样品。
1.3 PCR引物
通过文献分析选取P3F/P5R(5′-GGTTTCGGACACCGCAGGTTCTACCGAG-3′,5′-CTTCCTGATCCCCGTTACCCATCGAC-3′)[3]用于PCR检测,由上海生工进行合成。
1.4 猕猴桃枝条组织取样量的确定
直接PCR检测反应对样品用量由一定要求,样品量太少,会导致底物含量过低,无法完成检测;样品量太多会污染PCR反应体系,导致目标片段的扩增无法顺利完成[4-9]。为确定取样量的范围,本试验以ddH2O为阴性对照,以稀释后的猕猴桃PSA菌液为阳性对照,通过取不同质量的健康枝条样品与PSA菌液混合进行PCR检测来确定样品取样量的上限,通过从感病枝条中取不同重量样品进行PCR检测来确定样品取样量的下限。
PCR反应体系为:2×Taq PCR Master Mix10ul,上下游引物各0.5 μL,DNA模板10 μL。反应条件为:预变性95 ℃ 3 min; 95℃变性10 s,58 ℃退火30 s;72 ℃延伸20 s,38个循环;72 ℃延伸5 min;20 ℃保存。用2%琼脂糖凝胶电泳法检测,核算染料为低毒的GelRed染料。
1.5 检测系统的轻简化验证
常规PCR结果判读一般是,通过凝胶成像系统底部的紫外灯管,激发镶嵌了核酸染料的DNA片段发出荧光,再通过顶部的相机镜头拍摄下条带的照片,传输至计算机,呈现结果。为了适应基层低成本轻简化的操作需求,人们可以尝试使用紫外手电筒代替成像系统来激发条带,直接目测判读的方式来解读PCR结果。
2 结果与分析
2.1 取样量对PCR反应的影响
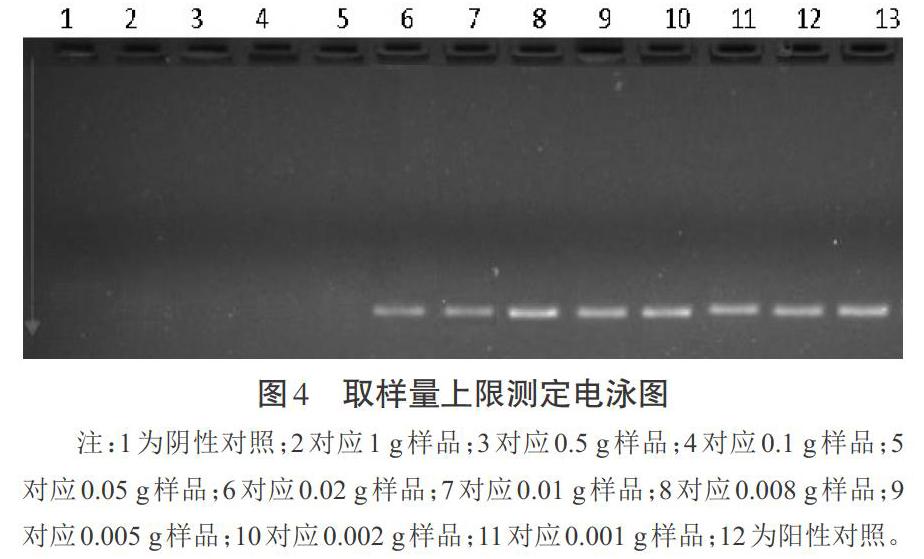
分别取1、0.5、0.1、0.05、0.02、0.01、0.008、0.005、0.002、0.001 g确定未感染猕猴桃PSA菌的健康枝条,将其分别加入500 μL含有PSA菌的ddH2O中捣碎,取10 μL捣碎后的样品混合液作为反应底物,进行PCR反应;以ddH2O为阴性对照,以稀释后的猕猴桃PSA菌液为阳性对照。如图4所示,PCR结果表明,阳性对照扩增出目标条带,而阴性对照未出带,与预期相符,即反应体系正常工作;样品质量在0.001~0.020 g的反应都扩增出条带,并且以0.008 g样品所对应的条带亮度最高,而0.05~1.00 g样品质量对应的反应都未见条带。这表明在本检测体系条件下,最适的取样量为0.008 g左右,样品量高于0.02 g则很可能会打乱反应体系,导致检测PCR扩增无法进行。
分别取1、0.5、0.1、0.05、0.02、0.01、0.008、0.005、0.002、0.001 g确定明显感染猕猴桃PSA菌的枝条,将其分别加入500 μL的ddH2O中捣碎,取10 μL捣碎后的样品混合液作为反应底物,进行PCR反应;以ddH2O为阴性对照,以稀释后的猕猴桃PSA菌液为阳性对照。如图5所示,PCR结果表明,阳性对照扩增出目标条带,而阴性对照未出带,与预期相符,即反应体系正常工作;样品量在0.008~0.020 g的反应都扩增出条带,并且以0.008 g样品所对应的条带亮度最高,而0.05~1.00 g样品质量和0.000 1~0.0050 g样品质量对应的反应都未见条带。这表明在本检测体系条件下,取样量低于0.005 g会导致模板量过低,无法检测出已感病材料。
通過对不同取样量的检测结果分析可知,在21 μL反应体系下,取0.008~0.050 g的猕猴桃枝条组织,加入ddH2O(可用怡宝纯净水代替)中捣碎,取10 μL混合液作为PCR反应的底物,能完成猕猴桃PSA病原菌的直接PCR检测。
2.2 轻简化系统的可行性验证
为适应基层果园无专业分子生物学实验室、无专业分子检测人员的应用场景,将实验室已经验证的方法进行了设备和试剂进行轻简化尝试。
试剂准备阶段:将500 μL怡宝纯净水装入1.5 mL EP管中;将引物与PCR反应MIX制成预混液,并分装入PCR反应管中冷冻保存;将2%琼脂糖凝胶制作完成后,用自封袋密封保存;将10 mL的50倍TAE母液装入塑料试管保存。
模拟使用阶段:分别取检测范围内的健康枝条样品、染病枝条样品,加入预装500 μL纯净水的EP管中,小研磨辊磨碎,取10 μL加入预装有反应液的PCR管中,上微型PCR仪器,以预定程序反应。将预装的TAE母液倒入新开的怡宝纯净水中,摇匀制成电泳缓冲液体。将完成反应的PCR产物上样到预制的琼脂糖凝胶中,在微型电泳仪上进行电泳反应。电泳完成后用紫外手电筒照射,进行目视判定,染病枝条样品出现明显的亮条带,而健康枝条样品并未出现条带,如图6所示。
3 结论
随着对猕猴桃溃疡病菌(丁香假单胞菌猕猴桃变种Pseudomonas syrimgae PV.actinidiae,PSA)[10-13]研究的深入,基于普通PCR的检测方法已经被逐渐建立和完善,如已报道的KN-RCR[14]、RG-PCR[15]等技术;也有基于定量PCR技术的检测方法被报道。这些技术的建立,帮助专业人员准确地区分出PSA和其他相似菌株,可以对无病征、未发病的果园进行早期检测。但是,这些检测需要在专业的分子实验室进行,需要具有相应分子生物学专业技能的人员操作,耗时较长,检测成本较高。基层果园主难以应用PCR技术开展自主检测,在日常果园管护中早发现、早处理还不现实。本研究通过实验室验证,建立了一套应用普通PCR检试剂、傻瓜化检测的方法,无须专业背景即可在说明指导下完成操作,结果准确。该方法所需仪器极为轻简,相对于建立整套分子实验室,成本低廉。本研究建立的猕猴桃溃疡病快速检测方法,降低了检测操作难度、检测成本,缩短了检测时间,应用前景广阔。
参考文献:
[1]高小宁,赵志博,黄其玲,等.猕猴桃细菌性溃疡病研究进展[J].果树学报,2012(2):262-268.
[2]李黎,钟彩虹,李大卫,等.猕猴桃细菌性溃疡病的研究进展[J].华中农业大学学报,2013(5):124-133.
[3]Gallelli A,Talocci S,Pilotti M,et al.Realtime and qualitative PCR for detecting Pseudomonas syrimgae pv.actinidiae isolates causing recent outbreake of kiwifruit cacterial canker[J].Plant Pathology,2013(2):264-276.
[4]庞冰,王艳梅,郝建平,等.谷子种子DNA快速提取新方法[J].山西农业科学,2018(5):680-682.
[5]张晋强,薛翼鹏,李晓云,等.血液直接PCR方法在猪嗜血支原体检测中的应用[J].中国兽医学报,2015(8):1244-1247.
[6]罗天宽,张小玲,朱世杨,等.应用水稻叶片直接PCR扩增的方法[J].分子植物育种,2015(11):2590-2592.
[7]陆绍红,陈睿,楼涤,等.直接PCR法检测血液中伊氏锥虫感染[J].寄生虫与医学昆虫学报,2006(4):204-207.
[8]闵现华,韩跃武,刘箐,等.种传番茄溃疡病菌直接PCR和免疫捕捉PCR检测方法之比较[J].植物检疫,2010(4):12-16.
[9]邢珍娟,董立明,刘娜,等.应用直接PCR技术快速筛查转基因玉米方法研究[J].玉米科学,2017(1):29-33.
[10]Abelleira A,Lopez M M,Penalver J,et al.First report of bacterial canker of kiwifruit caused by Pseudomonas syrimgae pv.actinidiae in Spain[J].Plant Diswase,2011(12):1583.
[11]Evereti K R,Taylor R K,Romberg M K,et al.First report of bacterial canker of kiwifruit caused by Pseudomonas syrimgae pv.actinidiae in New Zealand[J].Australasian Plant Disease Notes,2011(1):67-71.
[12]Vanneste J L,Poliakoff F,Audusseau C,et al.First report of bacterial canker of kiwifruit caused by Pseudomonas syrimgae pv.actinidiae in France[J].Plant Disease,2011(95):1311.
[13]赵利娜,胡家勇,叶振风,等.猕猴桃溃疡病病原菌的分子鉴定和致病力测定[J].华中农业大学学报,2012(5):604-608.
[14]Koh Y J,Nou I S.DNA Markers for identification of Pseudomonas syrimgae pv.actinidiae[J].Molecules & Cells,2002(2):309-314.
[15]Reesgeorge J,Vanneste J L,Cornish D A,et al.Detection of Pseudomonas syringae pv.actinidiae uesing polymerase chain reactiin(PCR) primers based on the 16S-23SrDNA inertanscribed spacer region[J].Plant Pathology,2010(3):453-464.
