新型结核病疫苗菌株(B/R菌株)对T细胞免疫记忆的建立及保护效应的研究
2020-08-25董江涛吴江东柳小玲赵海军张万江
邵 萌,吴 芳,张 杰,董江涛,吴江东,柳小玲,章 乐,赵海军,张万江
结核病(TB)是世界范围内单一致病菌导致死亡率最高的慢性传染性疾病,约有1/4的人口感染了结核分枝杆菌(M.tuberculosis)。2019年全球结核病报告显示,2018年结核病死亡人数较2017年降低了150万,但仍有1 000万新发病例,且各国的发病率差别很大,从每年每10万人不足5例到超过500例,全球平均水平约为130例,其中负担最重的为青壮年人群,所占比例高达89%[1]。目前预防结核病唯一广泛使用的疫苗是1921年问世的卡介苗(以下简称BCG),研究证明,BCG的保护期只有10至15年,这可能解释了TB的发病人群主要是青壮年[2],且随着BCG不断的传代及接种后时间的延长,其保护作用逐渐减弱[3],也与BCG RD1和RD2区域编码的重要抗原缺失有关[4],加上结核病的诊断和耐药结核病治疗面临的挑战,迫切需要一种比BCG更有效的疫苗预防结核病。
本课题组前期利用原生质体技术及电穿孔技术,以BCG和结核分枝杆菌国际标准无毒株H37Ra菌株(以下简称H37Ra菌株)为亲本,构建及选育的新型结核病疫苗菌株B/R菌株[5](以下简称B/R菌株)在使用的安全性、毒性、定植能力及传代稳定性方面表现出较好的候选结核病疫苗的潜能。疫苗接种的终极目标是能够诱导机体产生有效且长久的免疫保护力,这种保护依赖于稳定的免疫记忆的建立及维持[6]。因此,研究免疫记忆特征将对新型结核病疫苗的设计和评价具有重要意义。
本研究将以B/R菌株为研究对象,比较研究BCG、H37Ra和B/R菌株分别免疫小鼠后,对T细胞免疫记忆建立的影响,探讨B/R菌株作为结核病疫苗菌株的短期免疫保护效果,为B/R菌株作为新型结核病疫苗提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 菌种 BCG和H37Ra菌株由中国食品药品检定研究院提供,B/R菌株由本研究室构建,-80℃保存。
1.1.2 实验动物 6~8周龄,健康雌性C57BL/6小鼠,购自新疆医科大学实验动物研究中心。所有研究按国家实验动物学会的指导进行,实验方案通过石河子大学动物实验伦理委员会的批准。
1.1.3 主要试剂 Mouse IFN-γELISA Kit,Mouse IL-2 ELISA Kit购自杭州联科生物公司,小鼠脾脏淋巴分离液购自天津灏洋公司,Anti-Mouse CD4PE-Cy5、Anti-Human/Mouse CD44FITC、Anti-Mouse CD62L PE、Anti-Mouse CD8a PE-Cy5购自eBioscience公司,7 H11干粉和OADC购自BD Phar mingen公司。
1.2 方 法
1.2.1 菌株培养和菌悬液制备 取出并解冻保存的BCG、H37Ra菌株及B/R菌株,在生物安全柜中将各菌株分别接种至新鲜制备的无菌改良罗氏固体培养基上,于37℃恒温培养中培养3周后,取适量菌株至细菌研磨管中研磨、稀释、比浊仪检测细菌浓度,最后将细菌浓度调整为1×107cf u/mL。
1.2.2 实验动物分组及免疫 将64只小鼠随机分为4组即PBS组、BCG组、H37Ra组和B/R组,其中36只用于免疫记忆水平的检测(每组9只),另外28只用于比较各菌株的短期保护效应(每组7只)。各取0.1 mL菌悬液(含菌量为1.0×106cf u/mL),用背部皮下注射方式无菌免疫相应各组小鼠,免疫1次[7-8],PBS组注射等体积的PBS。
1.2.3 ELISA检测血清中IL-2和IFN-γ的水平分别在免疫小鼠后8周、12周和16周,每组取3只小鼠,眼球取血,将收取的小鼠外周血静置30 min后低温3 500 r/min离心10 min,收集血清,分装-80℃保存。最后将所有时间点的各组血清,依据IL-2和IFN-γ的ELSA试剂盒说明书进行操作,用酶标仪在波长450 n m处检测OD值。
1.2.4 流式细胞术检测免疫记忆性淋巴细胞的分型及水平 在小鼠免疫后8周、12周和16周,小鼠眼球取血后,于无菌条件下提取各组小鼠的脾细胞,用移液器混匀并将脾细胞转移至离心管中,补充PBS至8 mL,混匀,4℃1 500 r/min离心10 min,弃上清;加3 mL PBS混匀,并将其缓慢加入另一盛有5 mL小鼠淋巴分离液的玻璃试管中,低速离心机,1 000 r/min,离心30 min;吸出淋巴细胞层,加PBS至8 mL,4℃1 500 r/min离心5 min,弃上清,2次;1 mL PBS重悬脾淋巴细胞,台盼蓝染色观察活细胞率98%,进行细胞计数并调整细胞浓度为1×107个,取100μL至各组离心管中,加入CD4/CD8a PE-Cy5、CD44FITC、CD62LPE荧光标记抗体(eBioscience,USA),4℃避光孵育30 min;加1 mL PBS离心5 min,弃上清,2次;最后加300μL PBS重悬细胞准备上机检测,同时设置空白管,单标管。
结果分析时先以淋巴细胞设P1门,再分别以CD4+、CD8+细胞设P2门,以 CD62L,CD44的表达为分选标记检测TCM(CD62Lhi,CD44hi)及TEM(CD62Llo,CD44hi)的水平。
1.2.5 苏木素伊红染色(HE染色)及CFU计数评价免疫保护效果 小鼠免疫后8周,用减毒牛结核分枝杆菌BCG(5×106cf u/只)通过腹腔注射方式感染小鼠,攻击后4周,每组取7只小鼠,其中3只小鼠肺脏做组织病理学分析,即取肺脏观察整体病理变化,并保存在4%多聚甲醛溶液中固定72 h后进行组织石蜡包埋、切片、烤片,用于HE染色。组织的病理损伤程度通过单盲法由病理医生进行观察分析。每组其余4只做脏器菌落数计算,即无菌条件下取脾脏和肺脏分别置于研钵中充分研磨,加入含0.05%Tween80的无菌PBS(PBS-T)做倍比稀释,振荡器混匀,取3个稀释度的菌液100μL分别涂布于含10%OADC的7 H11培养基上,37℃恒温倒置培养4周后计算各组脾和肺脏的cf u,结果以Log10cf u比较分析。
1.2.6 统计分析 用Graph Pad Pris m 7.0软件进行数据分析,用SPSS20.0软件进行统计分析,采用单因素方差分析(ANOVA)的方法进行多组间比较,使用Tukey检验进行事后两两比较,P<0.05为差异有统计学意义。
2 结 果
2.1 免疫后不同时间点小鼠血清中IL-2、IFN-γ水平 ELISA检测结果显示,免疫小鼠8、12、16周,PBS对照组小鼠血清中的IL-2(F=3.183,P<0.05)、IFN-γ(F=12.27,P<0.05)水平均显著低于实验组。免疫小鼠8周,B/R菌株组小鼠血清中IL-2(q=4.709,P<0.05))、IFN-γ(q=5.477,P<0.05)水平均高于BCG组,与H37Ra组比较,差异无统计学意义。免疫小鼠12周,B/R菌株组小鼠血清中IL-2、IFN-γ水平与BCG组和H37 Ra组比较,差异无统计学意义。免疫小鼠16周,B/R菌株组小鼠血清IFN-γ水平高于BCG组(q=4.243,P<0.05),与H37Ra组比较,差异无统计学意义;B/R菌株组小鼠血清IL-2水平与BCG组和H37Ra组比较,差异无统计学意义。免疫小鼠8、12、16周,随时间延长,B/R菌株组,小鼠血清IFN-γ呈下降趋势,但血清IL-2一直维持较高水平(表1,表2)。

表1 免疫后不同时间点各组小鼠血清中IL-2(pg/mL)的表达水平Tab.1 Levels of IL-2(pg/mL)in seru m of mice at different times after immunization

表2 免疫后不同时间点各组小鼠血清中IFN-γ(pg/mL)的表达水平Tab.2 Levels of IFN-γ(pg/mL)in serum of mice at different times after immunization
2.2 免疫后,T细胞免疫记忆的时相性变化 流式细胞术检测结果显示,免疫小鼠8、12、16周,对于CD4+T细胞,PBS组的TCM和TEM的数量均最低,这与我们预期结果相一致。随免疫时间的延长,B/R菌株组的TCM,在12周时低于BCG组(q=5.25,P<0.05)和 H37Ra组(q=6.132,P<0.05),但其TCM在16周时维持与BCG相当的水平;TEM的数量在8,12周时与BCG组无统计学差异,但在16周时显著高于BCG组(q=31.5,P<0.05)(图1)。免疫小鼠8、12、16周,对于CD8+T细胞,与PBS组相比较,除12周时B/R菌株组的TCM有所降低外,B/R菌株组均产生了高于PBS组的TCM(F=16.86,P<0.05)和TEM(F=27.93,P<0.05)。随免疫时间的延长,B/R组的TCM维持与BCG相当的水平;TEM的数量在8周时与BCG组和H37Ra组无统计学差异,但在12周时显著高于BCG组(q=15.5,P<0.05)和 H37Ra组(q=12.97,P<0.05),且较早期水平更高。16周时,B/R菌株组的TEM,数量仍高于BCG组(q=16.08,P<0.05)和 H37Ra组(q=20.7,P<0.05)(图2)。
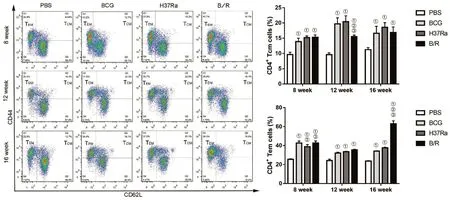
图1 免疫后不同时间点各组小鼠脾细胞中CD4+记忆性T细胞亚群的变化Fig.1 Changes of CD4+TM subsets in mouse spleen cells of each group at different times after immunization
2.3 各菌株免疫小鼠后短期保护效果的评价BCG攻击后4周,各组肺脏大体上未观察到明显病理变化。肺脏HE染色结果显示,PBS组的肺组织病理学改变最严重,镜下可见病变累及面积较大,肺泡结构损伤严重并融合成片,上皮样细胞、炎性细胞浸润较多,肺内出血,肺泡炎。与PBS组比,H37Ra组小鼠的病理变化相似,但肺泡结构损伤不严重,肺内出血有所减少,肺泡间隔增厚,炎性细胞浸润仍然较多。值得注意的是,与H37 Ra组比,B/R菌株组的病理损伤程度明显减轻,肺泡结构正常,红细胞及炎性细胞渗出减少,大部分肺泡腔清晰,并与在接种了BCG的小鼠中观察的结果相似(图3)。CFU结果显示,PBS组脾和肺组织中的菌落数最高。B/R菌株组中脾(q=11.64,P<0.05)和肺(q=17.0,P<0.05)的载菌量比PBS组显著降低,与BCG组结果相似(图4,图5)。
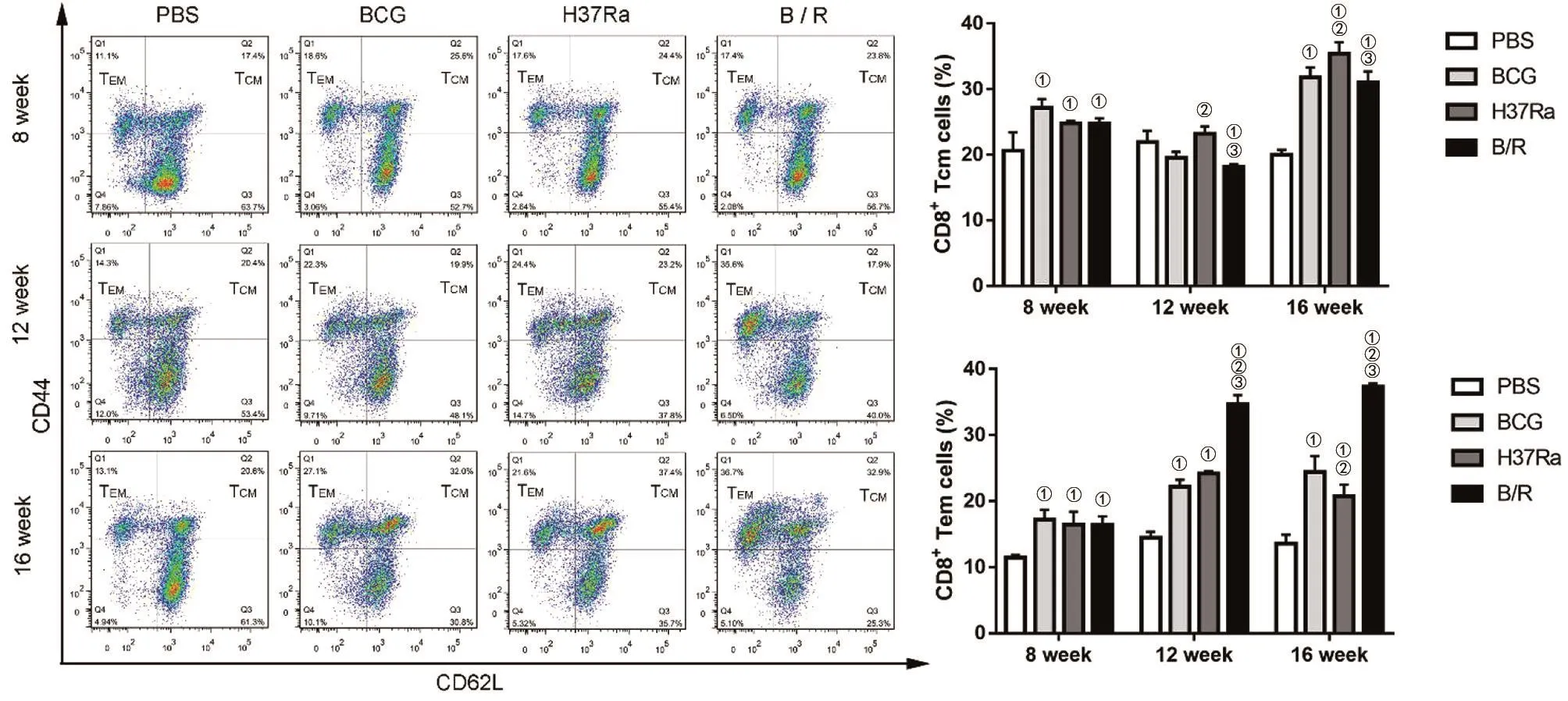
图2 免疫后不同时间点各组小鼠脾细胞中CD8+记忆性T细胞亚群的变化Fig.2 Changes of CD8+TM subsets in mouse spleen cells of each group at different times after immunization
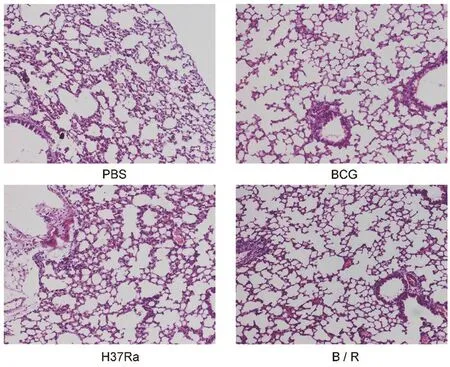
图3 各组小鼠肺组织苏木素伊红染色(HE染色)结果Fig.3 Results of hematoxylin and eosin staining(HE)in lung tissue,(100×)
3 讨 论
机体在抗M.tuberculosis感染过程中,免疫细胞释放的多种特异性细胞因子可启动杀菌机制,IL-2和IFN-γ是其中的代表因子。研究发现IL-2可激活体内的CD4+T细胞并与维持机体长期的生存率相关[9]。在我们的研究结果中,小鼠免疫后的8至16周,B/R菌株组血清中的IL-2显著高于PBS组,与BCG组相当,并可稳定保持较高水平,此外,这与记忆性T淋巴细胞维持较高水平的结果相一致,提示IL-2可能有助于机体记忆细胞的维持。虽然目前还不清楚IL-2水平的增加是否与疫苗更高的保护效力相关,但IL-2水平的升高已被证明与CD8+记忆性T细胞的生成有关[10]。相关研究发现记忆性T细胞(TM)存在异质性,TCM可分泌较高水平的IL-2,TEM分泌IFN-γ的能力相对较强[11]。IFN-γ有助于单核细胞和粒细胞的募集,并激活巨噬细胞的抗菌活性,防止TM的耗竭[12]。本结果中,随时间延长,各疫苗组血清中IFN-γ的水平整体有减弱迹象,但与PBS组比,疫苗组血清中IFN-γ的水平是显著升高的,说明各疫苗组均可刺激小鼠机体释放免疫保护因子。其中,16周时,B/R菌株血清IFN-γ的水平高于BCG组,这与16周时B/R菌株组产生TEM水平高于BCG组TEM水平的结果相一致。
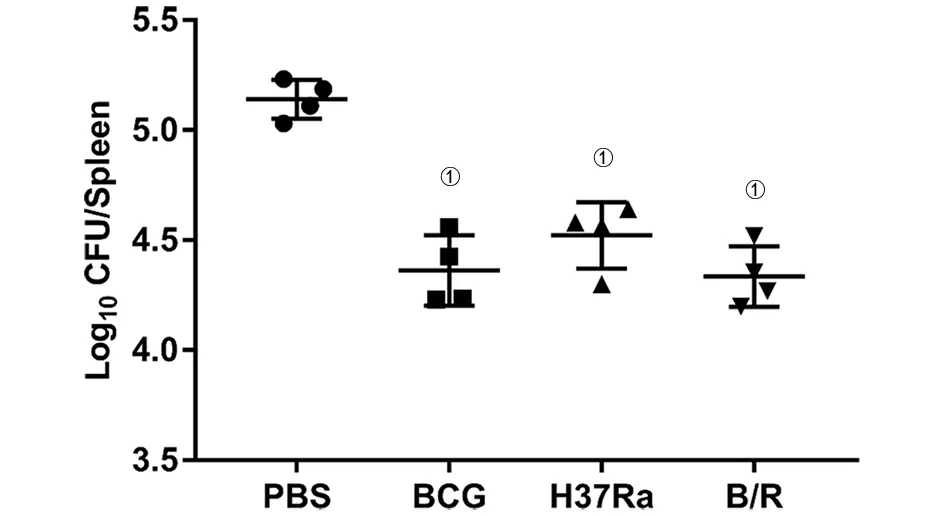
图4 各组小鼠脾组织中的菌落数(CFU)Fig.4 CFUin spleen tissue of mice in each group
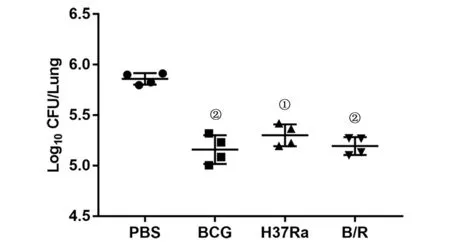
图5 各组小鼠肺脏组织中的菌落数(CFU)Fig.5 Colony count(CFU)in lung tissue of mice in each group
对于慢性感染性疾病,机体的免疫记忆主要由记忆性T淋巴细胞负责,免疫记忆细胞具有干细胞样自我更新的能力,可长期存在,从而保护机体免受相同病原的入侵[13-14]。本研究中,我们用流式细胞术比较不同疫苗免疫小鼠后,在不同时间点对记忆性T细胞反应的影响。我们的检测结果显示,CD4+和CD8+的记忆细胞分群有所不同,这与Stephen Abolins等人的研究结果一致[15]。免疫后8、12、16周,除12周时CD8+TCM有所降低外,B/R菌株组诱导产生的CD4+、CD8+T细胞中TCM及TEM数均显著高于PBS组。说明给小鼠接种B/R菌株后能刺激机体产生较高水平的免疫记忆。研究证明,当抗原重复暴露时,TCM的增殖能力强于TEM,并可迅速分化为效应T细胞和TEM,介导长期的免疫保护[16]。从结果中我们注意到,12周时B/R菌株组的CD4+、CD8+TCM的水平较其他疫苗组有所下降,而此时的TEM却相对其他疫苗组有所升高,我们考虑这种现象与B/R菌株组刺激脾脏中TCM分化成较多的TEM有关。此外,12周时B/R菌株组CD8+TCM低于正常水平,到了16周时又恢复到较高水平,而CD8+TEM的比例却相对较高,可能是此时机体对CD8+TCM的调节尚未稳定。CD4+Th1细胞在抗结核病中起核心作用,并可影响CD8+记忆细胞的分化[17-18]。目前,CD8+T记忆细胞在抗慢性感染性疾病中的作用也日益突显,它可阻止体内潜伏M.tubercul osis的再激活[19],对再次入侵的病原可快速启动免疫应答,通过分泌穿孔素、颗粒酶等直接杀死胞内寄生的M.tubercul osis[20],也可启动凋亡相关信号通路,介导靶细胞凋亡[21]。一个惊喜的发现是,无论是CD4+T细胞还是CD8+T细胞,与BCG和H37Ra组比,随免疫时间延长,B/R菌株组均可维持更高水平的TEM,差异有统计学意义,尤其是以CD8+TEM细胞表现更为明显,提示B/R菌株在免疫记忆特征方面,随免疫后时间的推移,较其亲本BCG和H37Ra菌株可能更具有一定的优势。造成这种差异的原因:一方面与菌株来源的种类有关,另一方面考虑与不同菌株含有的抗原丰富度有关。B/R菌株含有双亲菌株高频率重组的基因,可能表达种类多样的抗原。研究表明,抗原表达的丰富度和持续时间决定了小鼠和人类T细胞的功能[22]。另有研究发现,记忆性T细胞来源于效应T细胞[23],而抗原刺激会通过影响影响T细胞的代谢水平进而影响效应记忆T细胞的命运[24-25]。因此,我们猜想B/R菌株能够刺激小鼠机体产生更多的TEM可能与其本身是由原生质体融合形成的融合细胞的结构有关,具体机制以及对其蛋白组学的检测分析也将是我们进一步探究的方向。
B/R菌株免疫小鼠后刺激机体建立的免疫记忆是否能真正起到抗M.tuberculosis感染的效果我们还不确定,因此,我们初步探究了用BCG攻击各组小鼠后各菌株的短期保护效果。通过观察脏器的病理改变及计算菌落数是评价疫苗保护效果的客观指标[26]。本实验中,B/R菌株组的肺组织病理损伤程度以及脾肺器菌落数较PBS组显著降低,与BCG组比无差异,结合CD4+、CD8+记忆细胞及血清中IL-2和IFN-γ的检测结果,提示B/R菌株对机体的免疫保护性可能与免疫记忆的建立有关,其短期免疫保护效果与BCG相当。由于生物安全设备的限制,我们选择BCG感染小鼠来研究免疫保护效果,存在一定的局限性,可能缺乏说服力,但用来评价结核病疫苗诱导的免疫记忆是可行的[27]。
综上所述,我们的研究揭示,B/R菌株继承了亲代BCG和H37Ra菌株的优势,即免疫小鼠后可建立较高水平的免疫记忆,以TEM为主,其免疫记忆水平可维持近数月,同时具有较好的短期免疫保护效果,为B/R菌株作为较好的候选结核病疫苗提供了理论依据。36(8):611-617.DOI:10.3969/j.issn.1002-2694.2020.00.101
