香椿组织培养外植体的选择和消毒
2020-08-23袁应菊
袁应菊


摘 要:以太和香椿优良母株为材料,研究太和香椿在进行组织培养时,不同外植体取材部位、不同消毒方法对其离体组织培养的影响。结果表明:在进行香椿的离体培养时,幼嫩茎段是优良部位;采用70%~75%的酒精浸泡30~40s后,再用0.1%的HgCl2消毒8分钟,对外植体的消毒效果最好。
关键词:香椿;组织培养;外植体;消毒方法
中图分类号 S644.4 文献标识码 A文章编号 1007-7731(2020)15-0019-03
Abstract: Taking the excellent mother plant of Taihe Toona as the material,to study the effects of different explants and different disinfection methods on tissue culture of Taihe Toona.The results showed that the young and tender stem was the best part in vitro culture of Toona sinensis. After 30~40s soaking in 70%~75% alcohol, the explants were sterilized with 0.1% HgCl2 for 8 minutes, and the effect of explants disinfection was the best.
Key words: Toona sinensis; Tissue culture; Explant; Disinfection method
香椿(Toona.sinensis Roem)楝科、香椿属植物,为中国原产树种,又被称作红香椿、香椿头、椿甜树等,是1种多年生落叶乔木[1]。因其香椿头含有多种营养物质,且口感香鲜脆嫩、食用方便,一直深受广大消费者的喜爱。安徽省太和县香椿的栽培历史悠久,栽培品种多,有着“贡椿之乡”的美称。2014—2016年对当地香椿进行了良种选育工作,在进行良种无性繁育的过程中发现,为了保持其母本特性,现在普遍采用根蘖、扦插等无性繁殖方法,此种方法育苗数量有限,苗木生长良莠不齐,扩繁速度慢,育苗效率低,在有限资源条件下会严重影响出苗量和育苗的质量。通过组织培养的方式进行香椿扩繁,育苗时不受时间和季节的限制,可在快速获得无菌苗木的同时保持母本的优良性状,大大提高繁殖系数和育苗效率。本试验对香椿离体培养时外植体的取材部位及消毒方法进行了研究,以期找出适宜的消毒方法,为香椿良种的组培快繁提供依据。
1 材料與方法
1.1 植物材料 试验选取太和香椿优良母株的顶芽、幼嫩茎段、中部茎段、嫩叶,来源于安徽省太和县大新镇董庙村,安徽泰和香椿产业园有限公司香椿示范园内。取材时间3月中旬至5月上旬,选择健康、长势良好的母株采集带顶芽、幼嫩茎段、中部茎段、嫩叶的上部枝条,放入保鲜盒中带回实验室,备用。
1.2 试验方法 试验材料按以下程序进行处理:流水下冲洗,洗去表面杂物—用洗洁精浸泡,同时搅动5~10min—自来水冲洗50~60min—在无菌条件下用70%~75%酒精表面消毒30~40s—用无菌水清洗5~6次—用配制好的消毒液消毒—用无菌水反复清洗5~6次—放入无菌容器中备用,消毒后切去植物体材料与药液接触的伤口部分,再分切接种于准备好的无菌培养基上[2-3]。
基本培养基为经过试验改良的MS培养基,6-苄氨基嘌呤(6-BA)、萘乙酸(NAA)、1400强度琼脂粉6.0g和蔗糖30g,pH5.8~6.2,即改良的Ms+6BA(0.3~0.8)+NAA(0.1~0.2)的培养基,培养室温度(25±2)℃,空气相对湿度60%~70%,光照时间为前7d每天10h,之后每天14h,光照度强度2000~2500lux[4]。统计3~20d内不同培养外植体的污染率、存活率、枯死率等。
2 结果与分析
2.1 不同消毒方法对香椿外植体消毒效果的影响 采用不同的消毒方法,会使香椿外植体在消毒时达到不同的消毒效果,为了找到相对有效的消毒方法,增加无菌苗的获得数量,用不同种类、不同浓度的消毒剂对香椿进行外植体消毒处理。将香椿的幼嫩茎段作为外植体,采用HgCl2、次氯酸钠、84消毒液4种不同的方式进行消毒,然后将处理好的外植体接种于改良Ms+6BA(0.3~0.8)+NAA(0.1~0.2)的培养基上,每瓶接种1个点,1个月后统计获得的无菌外植体个数,结果如表1所示。由表1可见,采用0.1%的HgCl2消毒得到的香椿外植体的污染率最低为13%,按污染率从低到高的顺序依次为0.1%的HgCl2<10%次氯酸钠<6%次氯酸钠<(8~10)%84消毒液。
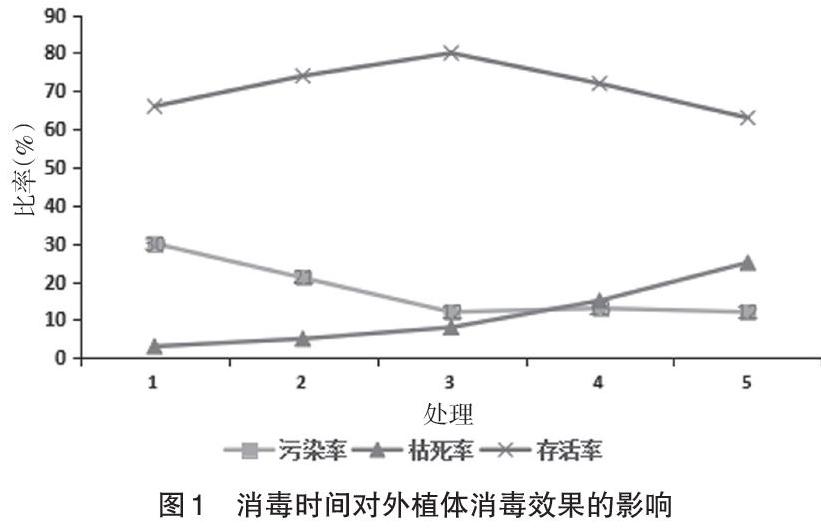
2.2 消毒时间对外植体的影响 外植体在0.1%的HgCl2消毒剂中消毒的时间分别为4、6、8、12、14min,标注为1、2、3、4、5 5个处理,结果见图1。由图1可知,在进行外植体消毒处理时,污染率会随着消毒时间的延长而下降,在6~8min之间,外植体的污染率成急剧下降,等到处理8min时会达到峰值,之后趋于缓和。采用0.1%的HgCl2进行消毒时,在消毒8min时香椿的外植体存活率达到峰值80%,此时污染率和枯死率都较低,之后呈现下降趋势。说明消毒时间达到8min可以杀死绝大多数污染病菌,但是,随着消毒时间的延长,枯死率表现呈直线上升,从而导致存活率下降。原因可能是在灭菌时,外植体受到汞离子的毒害而死亡。因此,外植体消毒时在考虑降低污染率的同时也要控制好消毒时间。
2.3 不同外植体对污染率的影响 先将香椿外植体不同部位进行预处理,接着在0.1 %的HgCl2消毒剂中消毒8min,后用无菌水冲洗,再把各部位(顶芽、幼嫩茎段、中部茎段、嫩叶)分别接入改良Ms+6BA(0.3~0.8)+NAA(0.1~0.2)的培养基中,观察污染,枯死和存活情况,结果见表2。从表2可以看出,外植体顶芽的存活率最高,其次为幼嫩茎段、嫩叶,中部茎段最差,存活率为66%。
2.4 不同外植体部位对不定芽诱导的影响 根据表3,在进行香椿组培时,诱导不定芽能力最强的部位是顶芽和幼嫩茎段,其次是中部茎段;诱导愈伤组织能力最强的是嫩叶,但叶片诱导的愈伤组织没有诱导出不定芽。
3 结论与讨论
外植体带菌情况会直接影响到组培效果的好坏,是否能够有效获得无菌材料是木本植物组织培养中的困难之一[3]。因此,在进行植物组织培养时,选取的外植体材料接种前必须消毒,让材料完全不带菌,这是决定接种成功的关键因素。研究表明,香椿组培时选择幼嫩茎段作为外植体,在无菌条件下,采用70%~75%酒精浸泡30~40s,然后用0.1%的HgCl2消毒,效果最好,获得的无菌苗数量也最多。因为70%~75%酒精具有双重作用,既可以浸润,又具有较强的杀菌作用,但却不能彻底灭菌,需要配合其他消毒剂使用。0.1%的HgCl2中的Hg2+因为其能够与带负电荷的蛋白质相互结合,从而使细菌蛋白发生变性、酶失活而有较好的灭菌作用。在处理外植体时,采用不同的消毒时间进行消毒,效果有明显的差异。同种消毒剂使用时,随着消毒时间的延长,污染率降低,枯死率会升高。本试验的结果表明,0.1%的HgCl2处理最佳時间为8min。自然条件下的顶芽、幼嫩茎段、中部茎段和嫩叶均可作为外植体,但以幼嫩茎段为最好,其主要原因是幼嫩茎段带菌量少,且生长速度快,易于再分化;顶芽生长也快,但是香椿顶芽叶片较多,不利于消毒;其它部位外植体比较老,细胞的再分化程度低。除此之外植物激素的分布梯度不同也会影响组培效果[5-6],当植物体内的某些激素以一定状态的相对浓度存在时,植物体内源激素分布就不均匀,最终导致基因表达的不一致,因此在香椿组培外植体选择实验中幼嫩茎段是最好的外植体。
参考文献
[1]梁明勤,郭群鹏,陈世昌,等.菜用香椿组培快繁技术研究[J].园艺与种苗,2016(03):58-61.
[2]冯金玲,陈辉,杨志坚,等.锥栗组织培养外植体消毒和选择[J].福建林学院学报,2006(01):22-25.
[3]吉训志,秦晓威,胡丽松,等.木本植物组织培养[J].热带农业科学,2019,39(04):33-40.
[4]冯金玲,陈辉,陈世品,等.锥栗成熟胚离体培养初报[J].经济林研究,2004(03):29-31.
[5]常莉,薛建平.生长素极性运输研究进展[J].生物学杂志,2008,25(06):9-13.
[6]高鷃铭,肖祥希,王志洁,等.香椿组培增殖和生根培养基筛选[J].福建林业科技,2018,45(02):64-67+90.
(责编:王慧晴)
