Neuritin原核表达载体构建及高表达菌株筛选
2020-08-19孟平平李媛媛高蕊张攀王娜黄瑾
孟平平,李媛媛,高蕊,张攀,王娜,黄瑾
(石河子大学医学院生化教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002)
Neuritin(CPG-15,可塑性相关候选基因15)作为神经营养因子,在神经系统发育过程中发挥作用,其能通过促进神经突起生长[1-2]、神经元突触传递[3]和调节突触可塑性[4-6],抑制神经元的凋亡[7]。本课题组前期研究结果证实,重组Neuritin蛋白能够促进鸡胚背根神经节(DRG)和PC12细胞突起生长[8],诱导骨髓间充质干细胞分化为类神经细胞,并促进其迁移[9]。进一步的动物实验研究证实,局部给予重组Neuritin蛋白,不仅明显促进外周神经(坐骨神经)损伤后的再生修复[10],而且能够促进中枢神经(脊髓)损伤的功能恢复[11]。因而,研制、开发neuritin基因工程类药物具有广阔的临床应用前景。
本课题组前期已获得具有活性的重组Neuritin蛋白[12],由于纯化需要,以上重组Neuritin蛋白均带有His标签,不符合重组蛋白药物的标准,因此寻找合适的方法去除重组蛋白中的标签,至关重要。
本研究旨在利用基因工程技术构建带有酶切位点的neuritin重组大肠杆菌pET32a-neuritin表达系统,并筛选出高表达的菌株;为后期酶切去除His标签,获得无标签的重组 Neuritin 蛋白奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒
大肠杆菌 DH5α:分子克隆的受体菌,购自 Invitrogen 公司;大肠杆菌 BL21 (DE3):分子克隆的表达菌,新疆农垦科学院畜牧所甘尚权老师惠赠;pET32a质粒:分子克隆载体,新疆农垦科学院畜牧所甘尚权老师惠赠;pcDNA3.1-neuritin质粒:由本室保存。
1.1.2 仪器与试剂
电泳仪、电转膜仪均购自 BIO- RAD 公司;限制性内切酶 NcoI、XholI、TaqDNA 聚合酶、T4连接酶购自Promega公司;质粒提取试剂盒、DNA Ladder购自天根公司;胶回收试剂盒、IPTG购自TakaRa 公司;酵母提取物和胰蛋白胨购自 Oxide 公司;PVDF膜购自Solarbio公司;Neuritin 多克隆抗体为本实验室制备,山羊抗鼠 IgG- HRP 购自中衫金桥公司;化学发光试剂盒购置 Millipore 公司;蛋白分子量 Marker 购自 Thermo 公司;其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 引物设计与合成
根据 NCBI 数据库中序列号为 NM_016588.2 的neuritinORF(无信号肽、无 GPI)序列设计特异性引物。在pET32a载体自身His标签和肠激酶序列之后克隆插入neuritin基因,限制性内切酶分别为 NcoI、XholI。以本实验室保存质粒pcDNA3.1-neuritin为模板,PCR扩增neuritin基因。上游引物:CATGCCATGGCTGACGACGAC GACAAGGCGGGCAAGTGCGATGCGGTC;下游引物:CACCTCGAGTTCAGTTGCCGCTGCCGCAGAG。循环参数为:95 ℃预变性 5 min,94 ℃变性 30 s、65 ℃退火 30 s、72 ℃延伸 45 s 进行 35 个循环,72 ℃延伸 10 min。待反应完毕后,1.5%琼脂糖凝胶电泳鉴定 PCR 产物。
1.2.2 重组蛋白的诱导表达
第一天晚上随机挑取阳性转化子摇菌,无菌牙签接种至 5 mL 含有 100 μg·mL-1氨苄青霉素的 LB试管中,放置摇床,260 r·min-1,37 ℃培养过夜。次日早上按 1∶100 比例扩大培养,转至 20 mL 培养基。37 ℃,260 r·min-1,培养约3 h,使其 OD 值大于 0.6(未诱导取 2 mL 作对照)。加入诱导剂 IPTG 使其终浓度为0.1 mmol·L-1,37 ℃诱导8 h。收菌后4 ℃,12 000 r·min-1离心 10 min,弃尽上清,用 50 μL 10 mmol·L-1PBS 重悬菌体,再加入等体积的 2× loading buffer,100 ℃煮沸 7 min;待其降至室温后,4 ℃,12 000 r·min-1,离心10 min,收集菌体,通过SDS-PAGE和Western blot鉴定Neuritin蛋白。
1.2.3 高表达菌株的筛选
挑选50个阳性转化子,IPTG诱导8 h,收菌后超声破菌,收集上清,SDS-PAGE鉴定蛋白表达量,通过 ImageJ 软件对蛋白条带进行灰度扫描,筛选出高表达的菌株,并保菌。
1.2.4 Neuritin 蛋白的 SDS-PAGE及Western Blot鉴定
收集菌体上清,加入上样缓冲液,煮沸8 min,进行SDS-PAGE(15%)电泳。电泳结束后考马斯亮蓝染色、脱色后,ImageLab 拍照,并运用ImageJ软件对蛋白条带进行灰度扫描。Western blot检测蛋白,SDS-PAGE电泳结束后,采用蛋白半干转膜仪将蛋白从凝胶转移至PVDF膜上。封闭2 h后进行抗体孵育,一抗为Neuritin抗体(实验室制备)1∶500比例稀释,室温孵育 2 h,用 1×TBST 洗膜,5 min×1次,15 min×3次。二抗为辣根过氧化物酶标记的山羊抗鼠IgG,1∶5000 比例稀释,室温孵育 2 h,用 1×TBST洗膜,5 min×1 次,15 min×3 次。用 ECL 发光试剂盒检测蛋白印迹条带,并曝光显影。
2 结果
2.1 pET32a-neuritin重组质粒构建策略
在pET32a载体自身His标签和肠激酶序列之后克隆插入neuritin基因,限制性内切酶分别为 NcoI、XholI。
2.2 目的基因neuritin的PCR产物鉴定
PCR扩增neuritin产物经琼脂糖凝胶电泳检测,结果显示在约300 bp处出现特异性条带。与预期结果一致(图2)。
2.3 pET32a-neuritin重组质粒菌落PCR鉴定
将neuritin的PCR产物和pET32a质粒的酶切产物进行连接并转化DH5α感受态后,对阳性转化子进行PCR鉴定。结果显示在 300 bp 处出现特异性条带(图3)。
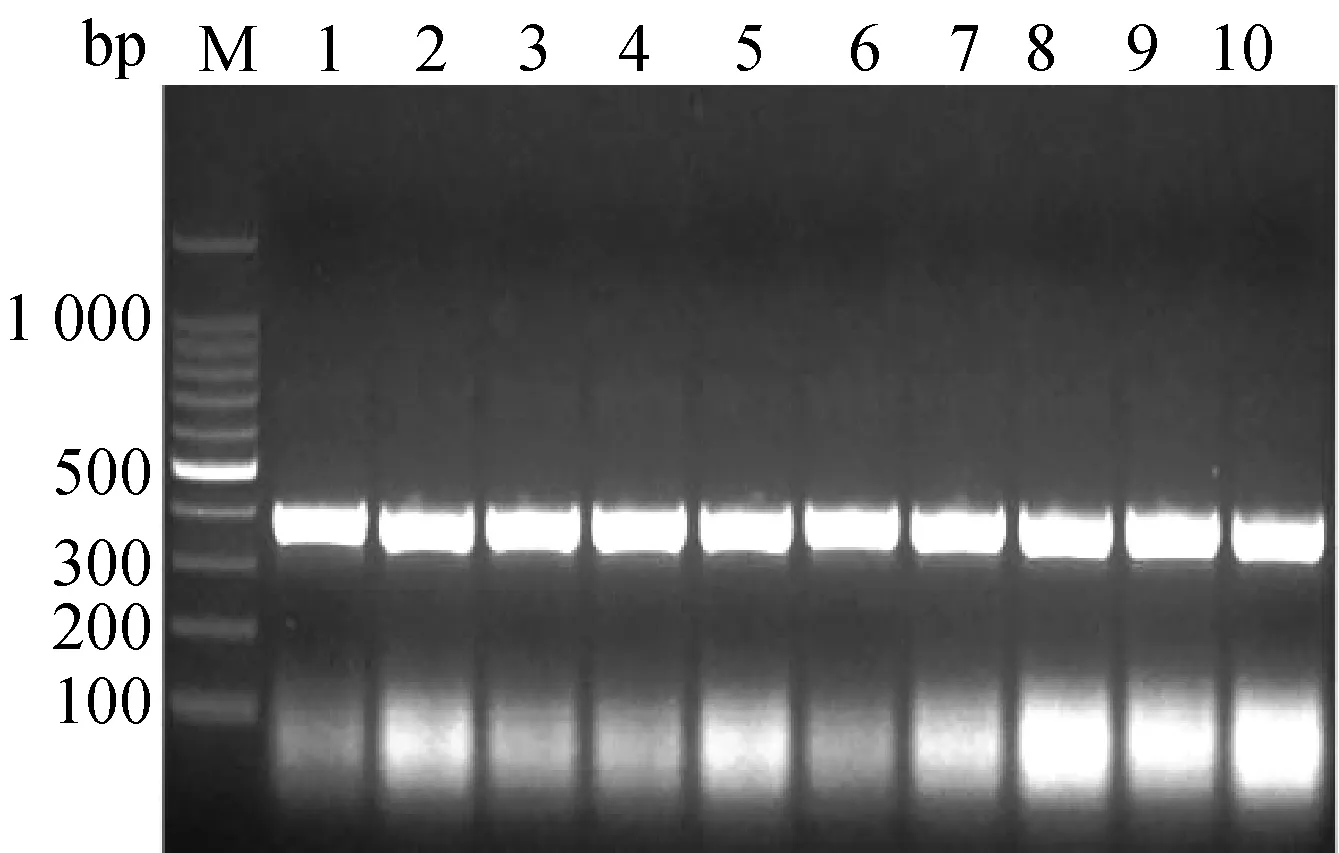
M:DNA Marker;Lane1-10:含重组质粒的阳性转化子。图3 重组质粒pET32a-neuritin菌落PCR鉴定
2.4 pET32a-neuritin重组质粒双酶切鉴定
将菌落PCR鉴定阳性的转化子提取质粒,并用NcoI、XholI 酶切重组质粒,经琼脂糖凝胶电泳检测可见约300 bp片段和5 000 bp片段,与预期结果一致(图4)。结果表明neuritin基因已成功插入到pET32a载体中。

M:DNA Marker;Lane1:pET32a-neuritin;Lane2-3: NcoI/XholI双酶切pET32a-neuritin。图4 重组质粒pET32a-neuritin双酶切鉴定
2.5 重组质粒pET32a-neuritin测序鉴定
将菌落PCR和双酶切鉴定阳性的重组质粒,转化至 BL21 感受态中,挑取阳性转化子摇菌后,送北京华大公司测序鉴定,测序结果显示插入的目的基因片段264 bp,与 GeneBank 中人源neuritin序列完全一致(图5),表明重组质粒构建成功。

图5 重组质粒pET32a-neuritin测序结果
2.6 重组Neuritin蛋白的诱导表达及鉴定
阳性转化子经IPTG 诱导表达蛋白后,SDS-PAGE 鉴定显示,重组质粒 pET32a-neuritin在 25kDa左右出现目的条带(图6A),与理论值相符。Western blot 鉴定结果显示在 25kDa左右出现目的条带(图6B),证明诱导表达获得的蛋白为 Neuritin 重组蛋白。

A:M:Protein Marker;Lane1-3:pET32a未诱导、 诱导、诱导;Lane4-6:pET32a-neuritin未诱导、诱导、诱导 B:Lane1-2:pET32a未诱导、诱导; Lane3-4:pET32a-neuritin 未诱导、诱导。图6 重组质粒pET32a-neuritin的诱导表达鉴定
2.7 高表达菌株的筛选
将测序正确的pET32a-neuritin重组质粒转化至 BL21 感受态后。共挑取 50 个阳性转化子用IPTG 诱导 8 h,收菌后利用超声破菌,收集上清,SDS-PAGE鉴定蛋白表达量(图7A)。经对蛋白表达条带的灰度值扫描(图7B),6号 lane 的总灰度值最大,即目的蛋白表达量最高,从而筛选出高表达菌株为 6号 Lane 对应的 6号单克隆。

A:M:Protein Marker;Lane1-7:不同单克隆的蛋白表达量; B:1-7:不同单克隆的蛋白表达量灰度值扫描结果。图7 SDS-PAGE鉴定高表达菌株
3 讨论
本研究旨在获得带有肠激酶序列的高表达的原核表达系统 pET32a-neuritin,为后期酶切去除重组蛋白His标签奠定基础,同时,本研究考虑到后期蛋白纯化的高效和便捷,在neuritin的5’端引入pET32a 载体自身His标签。其次,利用肠激酶可特异性识别并水解多肽序列的特点,在neuritin与His之间引入pET32a载体自身的肠激酶序列,便于后期切除His标签。
重组蛋白的生产对于生物技术和生物医学至关重要。为了利于研究,这些蛋白质通常需要大量表达和纯化。重组蛋白的纯化通常使用的标签包括多组氨酸(His),谷胱甘肽S -转移酶,麦芽糖结合蛋白和硫氧还蛋白[13]。其中,His标签在纯化重组蛋白中是应用最广泛的方法[14]。本研究在neuritin的5’端引入pET32a 载体自身His标签,目的是利用His 与 Ni 2+ 间的配位亲和作用,使得后期重组蛋白得到有效纯化[15],初步获得高纯度重组蛋白。由于His标签仅含有6个氨基酸,研究者们认为其不会显著干扰大多数蛋白质的功能和结构[16-17]。然而越来越多的研究表明His可能会影响蛋白的结构和功能。Mohanty等人的研究证明了改变His标签的长度和位置对膜蛋白的表达产生影响[18]。His标签可能影响蛋白质的低聚状态和功能[19]。此外,添加His标签可以改变蛋白质动力学,可能影响蛋白质活性或功能[20]。因此,本研究在利用His标签提高重组蛋白的纯化效率后,引入肠激酶将该标签去除。
肠激酶是由小肠粘膜上皮细胞所分泌出的一种丝氨酸蛋白酶,其主要功能是激活胰蛋白酶原,使之成为有活性的胰蛋白酶,从而引起下游的蛋白酶级联反应[21]。由于肠激酶的轻链具有非常独特的底物选择能力,它可特异性识别并水解多肽序列DDDDK (Asp-Asp-Asp-Asp-Lys) 的羧基端肽键,不会在 DDDDK 序列下游蛋白 N-端留下多余氨基酸残基,从而获得无标签的重组蛋白。因此,肠激酶也成为酶切含有标签的重组蛋白的首选生物工具酶[22]。同时,该酶能在较宽的pH范围(4.5~9.5)、较宽的温度范围(4 ℃~45 ℃)及在多种变性剂和去污剂存在的条件下保持活性[23],因此肠激酶是一种理想的用于处理融合蛋白的工具酶,广泛的应用于生物技术领域[24]。
综上所述,本研究成功构建了带有肠激酶序列的原核表达系统 pET32a-neuritin,并筛选出高表达Neuritin蛋白的菌株。为后期获得无标签的重组Neuritin 蛋白奠定基础。
