离子液体辅助双水相系统提取茶渣中茶多酚工艺优化
2020-08-17龚新怀李明春2辛梅华2赵晓杰赵升云
龚新怀,2,李明春2,辛梅华2,赵晓杰,吕 橄,徐 婕,赵升云
(1.武夷学院生态与资源工程学院,福建省生态产业绿色技术重点实验室,福建武夷山 354300;2.华侨大学材料科学与工程学院,环境友好功能材料教育部工程研究中心,福建厦门 361021)
目前全球每年茶叶消耗量超过450万吨[1]。在茶叶种植、生产、加工及消费环节中会产生大量的茶渣剩余物,单中国每年可产生500万吨以上的茶渣剩余物,其主要含有纤维素、木质素、半纤维素及茶多酚等活性组分[2]。茶多酚作为一种天然抗氧剂,具有抗癌症、抗衰老及预防冠心病等作用,在保健品、化妆品、塑料工业及疾病治疗等领域具有广泛应用前景[3-6]。目前主要通过溶剂回流浸提茶叶来获取茶多酚,但该工艺存在溶剂用量大、提取温度偏高及后续需进一步纯化操作等问题[7]。
双水相系统(ATPS)是由两种不相容的亲水组分溶于水中,形成宏观上可见的液液分相系统,被视为一种功能强大的非色谱过程,具有工艺简单、成本低、易放大操作及条件温和等优势,适用于蛋白质、核酸及抗体等生物活性分子的萃取、纯化[8-10]。目标组分与ATPS中上下两相通过电荷力、氢键及疏水作用等方式形成的亲和力大小不同,进而在ATPS上下两相发生选择性分配,实现萃取、纯化[11]。徐方祥等[12]采用微波辅助乙醇-磷酸氢二钾双水相体系提取绿茶中茶多酚。陈钢等[13]采用超声耦合乙醇-硫酸铵组成的双水相体系提取茶多酚,并对工艺进行了响应面优化。林维晟等[14]采用微波辅助乙醇-磷酸氢二钾双水相的方法对碎铜茶中茶多酚进行提取。
此外,为促进目标组分在ATPS对应相中的富集,研究者主要通过改变相组成物质分子量和浓度来调节上下相的性质,调控其与目标组分的亲和力,调控手段较单一、作用效果有限。离子液体(ionic liquid,IL)是一类由体积较大的有机阳离子和有机或无机阴离子组合成的,在100 ℃以下为液体的盐[15],具有低挥发、无毒性等优势,可通过不同结构和电荷性质的阴阳离子组合,来溶解许多不同极性大小和特点的组分[16]。研究表明[17-18],将IL作为一种调节助剂添加到ATPS中,可调节上下相的物化性质,提高其对目标组分的萃取能力和适用范围。Joao等[19]将咪唑基离子液体添加于聚乙二醇/磷酸钾双水相体系,用于提取抗氧化剂丁香酚和没食子酸丙酯,发现离子液体添加可以提高双水相体系的萃取效率。Almeida等[18]将离子液体添加于聚乙烯醇/硫酸钠双水相体系中,用于3种抗氧化组分没食子酸、香草酸及丁香酸的萃取。发现离子液体[C4mim]Cl或[C4mim][CH3CO2]的添加显著提高了双水相体系对没食子酸的萃取能力,并可实现对3种组分良好的萃取分离。
因此将离子液体添加到传统双水相体系中,有助于茶多酚的提取、纯化过程,但这方面研究尚未见报道。本研究采用离子液体(ionic liquids,IL)辅助乙醇/硫酸铵ATPS来提取茶渣中茶多酚,系统考察了不同结构ILs对乙醇/硫酸铵ATPS分相行为及其对茶多酚浸提能力等的影响。
1 材料与方法
1.1 材料与仪器
茶渣,绿碎茶加工下脚料 湖北随州神农茶叶有限公司,用前晾干,并在105 ℃下鼓风干燥12 h,机械研磨,用标准分样筛取用粒径<300 μm的茶粉备用;硫酸铵、无水乙醇、七水合硫酸亚铁、酒石酸钾钠、磷酸氢二钠、磷酸二氢钾 AR,国药试剂;没食子酸、1,1-二苯基-2-苦基肼及抗坏血酸 上海源叶生物科技有限公司,HPLC含量≥98%;1-丁基-3-甲基咪唑四氟硼酸盐([C4mim]BF4)、溴化1-丁基-3-甲基咪唑([C4mim]Br)、1-丁基-3-甲基咪唑硝酸盐([C4mim]NO3)、1-丁基-3-甲基咪唑六氟磷酸盐([C4mim]PF6)、氯化1-丁基-3-甲基咪唑([C4mim]Cl)、1-丁基-1-甲基哌啶氯化物([C4mpip]Cl)、1-丁基-1-甲基吡咯烷酰氯([C4mpyr]Cl)、氯化1-己基-3-甲基咪唑([C6mim]Cl)及氯化1-辛基-3-甲基咪唑([C8mim]Cl) 上海程捷化学有限公司,质量分数>98%。
1000Y型多功能粉碎机 永康市伯欧五金制品有限公司;S10H型超声波清洗机 厦门致微仪器有限公司;SC-04型低速离心机 安徽中科中佳科学仪器有限公司;ΜV-1100型紫外可见分光光度计 上海美谱达仪器有限公司;1260型高效液相色谱仪 美国Agilent。
1.2 实验方法
1.2.1 IL辅助ATPS提取茶渣中茶多酚 吸取一定量乙醇溶液,加入预定质量的硫酸铵及IL,超声(功率为270 W)辅助溶解15 min后,再取出静置分相10 min,然后读取、记录上下相的体积,即得到IL辅助的乙醇/硫酸铵ATPS。另取一只干净、干燥的塑料离心管,加入预定质量的茶渣,然后加入前述配制好的IL辅助乙醇/硫酸铵ATPS,超声水浴提取至预定时间后,转入离心机中在4000 r/min下离心10 min,茶多酚富集于上层乙醇相清液中,待测定其浓度。平行操作2份,取平均值。
1.2.2 IL的选择
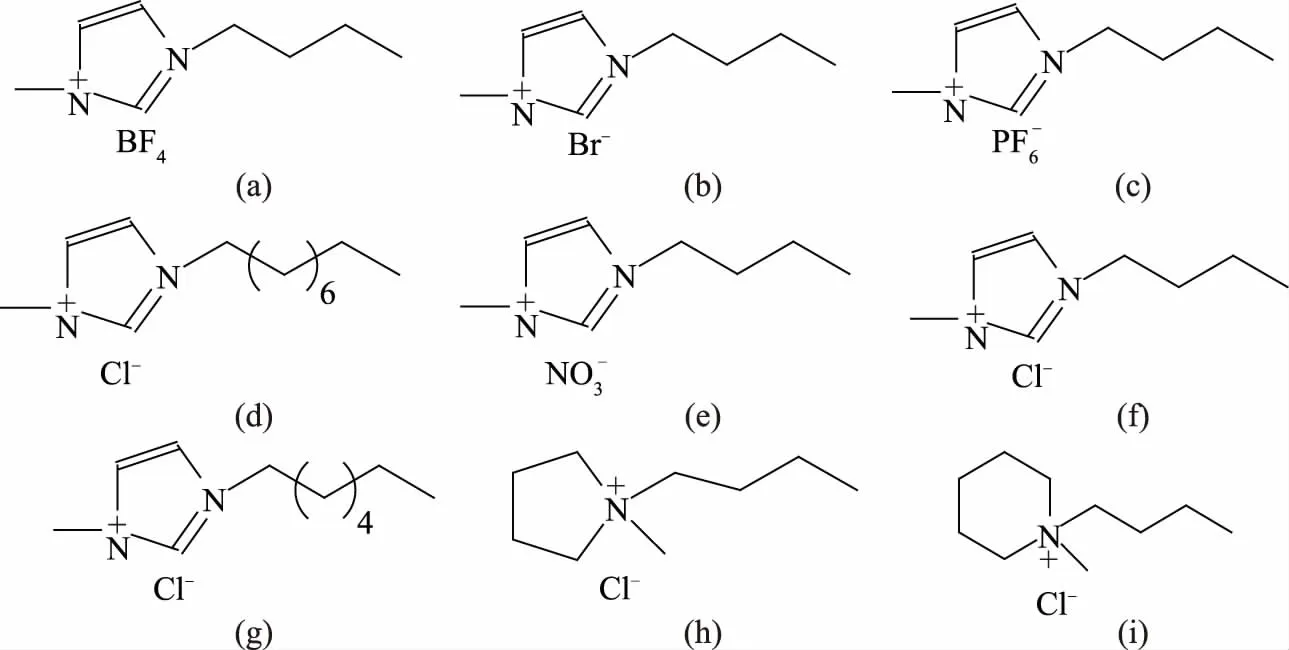
图1 不同IL的化学结构式Fig.1 Chemical structures of ILs注:(a)[C4mim]BF4;(b)[C4mim]Br;(c)[C4mim]PF6;(d)[C8mim]Cl;(e)[C4mim]NO3;(f)[C4mim]Cl;(g)[C6mim]Cl;(h)[C4mpyr]Cl;(i)[C4mpip]Cl。
1.2.2.1 不同结构IL筛选 通过IL中不同阴阳离子结构的选用与组合,得到不同亲疏水性的IL,可调控双水相体系的分相行为及其对活性组分的萃取分离能力,实现对各种物化性质不同的目标组分进行提取或纯化。为考察不同结构组成IL对乙醇/硫酸铵ATPS的分相行为及其对茶多酚得率影响,试验选用了9种不同化学结构IL,分别为1-丁基-3-甲基咪唑四氟硼酸盐([C4mim]BF4)、溴化1-丁基-3-甲基咪唑([C4mim]Br)、1-丁基-3-甲基咪唑硝酸盐([C4mim]NO3)、1-丁基-3-甲基咪唑六氟磷酸盐([C4mim]PF6)、氯化1-丁基-3-甲基咪唑([C4mim]Cl)、1-丁基-1-甲基哌啶氯化物([C4mpip]Cl)、1-丁基-1-甲基吡咯烷酰氯([C4mpyr]Cl)、氯化1-己基-3-甲基咪唑([C6mim]Cl)及氯化1-辛基-3-甲基咪唑([C8mim]Cl),其化学结构如图1所示。
1.2.2.2 不同IL辅助乙醇/硫酸铵ATPS的分相能力 a.乙醇/硫酸铵相图绘制(即对照组):参照卢艳敏[20]的方法,采用浊点滴定法绘制ATPS相图。配制质量分数为40%的硫酸铵溶液,量取25.00 g于刻度容器内,置于25 ℃的恒温水浴锅中。缓慢滴加无水乙醇,至其恰好出现浑浊时停止滴加,记录此时乙醇加入量,计算硫酸铵质量分数和乙醇体积分数;滴加少量去离子水使体系澄清,记录水加入质量,再继续滴加无水乙醇至浊点刚好出现。如此反复操作和计算,得到一系列不同组成的浊点。
b.不同IL辅助乙醇/硫酸铵相图绘制:按a法准备质量分数为40%的硫酸铵溶液、无水乙醇及水,并分别在其中加入1.25 g的[C4mim]Cl,得到含[C4mim]Cl质量分数为5%的硫酸铵溶液、无水乙醇及水。其余按a法操作,即得到含[C4mim]Cl质量分数为5%的浊点曲线。同法可绘制含其他不同化学结构IL的浊点曲线。
c. 不同IL添加量辅助乙醇/硫酸铵相图绘制:按b法绘制含[C4mim]Cl质量分数分别为0、5%、10%及15%的乙醇/硫酸铵浊点曲线。
1.2.2.3 不同IL辅助乙醇/硫酸铵ATPS体系对茶多酚得率和抗氧化性的影响 固定乙醇体积分数50%,硫酸铵质量分数40%,茶渣与IL辅助乙醇/硫酸铵ATPS的料液比为1∶35 g/mL(简写成1∶35),IL添加质量分数为5%条件下,考察不同结构IL添加对茶多酚得率及对抗氧化性的影响,其中抗氧化性测试是利用茶多酚提取液对1×10-4mol·L-1的1,1-二苯基-2-苦基肼(DPPH)的半抑制浓度为指标,并以无水乙醇替代试液作为初始对照值。
1.2.2.4 [C4mim]Cl用量对茶多酚得率和抗氧化性的影响 固定乙醇体积分数50%,硫酸铵质量分数40%,料液比1∶35,考察[C4mim]Cl添加量对茶多酚得率和抗氧化性的影响,其中抗氧化性测试同1.2.2.3。
1.2.3 [C4mim]Cl辅助乙醇/硫酸铵ATPS提取茶多酚工艺的单因素实验
1.2.3.1 乙醇体积分数对提取茶多酚工艺的影响 固定[C4mim]Cl添加质量分数为10%,硫酸铵质量分数为25%,料液比1∶35,温度45 ℃,提取时间10 min,超声功率540 W,乙醇体积分数为30%、40%、50%、60%和70%时,考察乙醇体积分数对茶多酚得率的影响。
1.2.3.2 硫酸铵质量分数对提取茶多酚工艺的影响 固定[C4mim]Cl添加质量分数为10%,料液比为1∶35,温度45 ℃,提取时间10 min,超声功率540 W,乙醇体积分数为60%,硫酸铵质量分数为15%、20%、25%、30%、35%及40%时,考察硫酸铵质量分数对茶多酚得率的影响。
1.2.3.3 料液比对提取茶多酚工艺的影响 固定[C4mim]Cl添加质量分数为10%,硫酸铵质量分数为30%,提取温度45 ℃,提取时间10 min,超声功率540 W,乙醇体积分数为60%,料液比为1∶25、1∶35、1∶45、1∶55及1∶65 (g/mL)时,考察料液比对茶多酚得率的影响。
1.2.3.4 提取温度对提取茶多酚工艺的影响 固定[C4mim]Cl添加质量分数为10%,硫酸铵质量分数为30%,料液比为1∶35,提取时间10 min,超声功率540 W,乙醇体积分数为60%,温度为35、40、45、50及55 ℃时,考察提取温度对茶多酚得率的影响。
1.2.3.5 提取时间对提取茶多酚工艺的影响 固定[C4mim]Cl添加质量分数为10%,硫酸铵质量分数为30%,料液比为1∶35,提取温度为50 ℃,超声功率540 W,乙醇体积分数为60%,提取时间为5、10、15、20及25 min时,考察提取时间对茶多酚得率的影响。
1.2.3.6 超声功率对提取茶多酚工艺的影响 固定[C4mim]Cl添加质量分数为10%,硫酸铵质量分数为30%,料液比为1∶35,提取温度为50 ℃,提取时间10 min,乙醇体积分数为60%,超声功率为360、450、540、630及720 W时,考察超声功率对茶多酚得率的影响。
1.2.4 [C4mim]Cl辅助乙醇/硫酸铵ATPS提取茶多酚工艺的正交试验 基于单因素实验结果,以茶多酚得率为指标,采用正交试验法对乙醇体积分数、硫酸铵质量分数、料液比及超声功率四个影响因素进行优化,正交优化因素及水平如表1所示,固定[C4mim]Cl添加质量分数为10%。

表1 正交优化因素选择Table 1 Factor design of orthogonal experiment
1.2.5 不同体系对茶多酚得率及组成的影响
1.2.5.1 不同体系对茶多酚得率的影响 实验比较0.10 g·mL-1的[C4mim]Cl辅助C2H5OH/(NH4)2SO4ATPS与其他提取体系如水、50%乙醇溶液、PEG6000/Na3C6H5O7ATPS、C2H5OH/Na2HPO4ATPS、C2H5OH/(NH4)2SO4ATPS、PEG6000/Na3C6H5O7/[C4mim]Cl ATPS对茶多酚得率的差别,其中乙醇体积分数50%,PEG6000质量分数50%及盐质量分数25%,超声温度45 ℃、超声时间10 min、超声功率540 W、料液比1∶35。茶多酚得率测定见1.2.6。
1.2.5.2 茶多酚提取液组成分析 参照国标GB/T 8313-2008[21]方法,采用HPLC测定茶渣多酚提取液的组成。色谱条件:色谱柱C18柱(粒径5 μm,250 mm×4.6 mm);将10 mL乙酸转入1000 mL容量瓶,用纯净水定容后,过0.45 μm滤膜,得流动相A;将800 mL乙腈、10 mL乙酸转入1000 mL容量瓶中,用纯净水定容后,过0.45 μm滤膜,得流动相B。梯度条件:0 min(5%B)→21 min(85%B)→32 min(100%B)→37 min(0%B)→42 min(0%B)。检测波长278 nm,流动相流速1 mL·min-1。
定性及定量分析方法:参照文献[22],定性及定量分析组分峰:儿茶素(保留时间5.36 min)、表儿茶素(保留时间7.41 min)、没食子儿茶素(保留时间4.37 min)、表儿茶素表没食子酸酯(保留时间8.98 min)及表没食子儿茶素表没食子酸酯(保留时间7.12 min)。用HPLC仪器自带分析软件对组分峰面积进行积分,根据其峰面积算出对应组分含量。
1.2.6 提取液中茶多酚得率和抗氧化性的测定
1.2.6.1 提取液中茶多酚浓度测定 采用没食子酸标准曲线法,按国标GB/T 8313-2002[23]测定上相清液中茶多酚的浓度,标准曲线方程为y=0.09245x+0.02482,R2=0.9993。用移液枪移取上层清液1.00 mL于25.00 mL比色管中,加去离子水4.00 mL,酒石酸亚铁溶液5.00 mL,充分混匀后,加入pH=7.5的缓冲液至刻度线,定容。然后用1.00 cm比色皿在波长540 nm下测定吸光度,以试剂空白为参比。
1.2.6.2 提取液中茶多酚得率计算 按下式计算茶多酚得率。
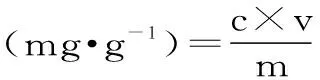
式中:c为ATPS上层清液中茶多酚的浓度,mg·mL-1;v为ATPS上层清液的体积,mL;m为称取的茶渣质量,g。
1.2.6.3 茶多酚提取液抗氧化性测定 参照李晓静等[24]的方法,配制1×10-4mol·L-1的1,1-二苯基-2-苦基肼(DPPH)溶液后,分别取5.00 mL茶多酚提取液和DPPH溶液,于暗处混匀并静置30 min,然后将混合液在紫外分光光度仪上于517 nm测定吸光度,以无水乙醇替代试液作为初始对照值。使DPPH溶液吸光度值下降一半时对应的茶多酚浓度,即为茶多酚提取液对DPPH自由基的半抑制浓度,记录为C50%(DPPH),用作茶多酚的抗氧化性指标。
1.3 数据处理
根据实验测试过程的数据记录,及仪器测试数据导出后,将其录入到Origin软件中,用Origin软件绘制曲线及图形。
2 结果与分析
2.1 IL在乙醇/硫酸铵ATPS体系中的选择
2.1.1 IL辅助乙醇/硫酸铵ATPS的分相行为 IL辅助乙醇/硫酸铵ATPS的相图如图2所示,其中温度为298 K。由于实验数据较多,以及部分试剂采购量较少,量不足以完成相图绘制,因此只做了6种不同IL辅助乙醇/硫酸铵双水相系统的相图。图2中浊点线上方为两相区域,下方为单相区域。两相区域越大,表示双水相体系中上下两相之间的分相能力越强[18]。由图2a可知,不同IL的加入,明显增大了两相区域面积,其中以[C4mim]Cl的辅助分相能力最好。由图2b可知,随[C4mim]Cl用量增加,乙醇与硫酸铵双水相体系的两相区域面积越大。由此可知IL加入提高了乙醇/硫酸铵ATPS的分相能力。这是由于[C4mim]Cl是由有机阳离子和无机阴离子组成,比乙醇具有更高的亲水性,可与更多的水分子发生水合作用,导致乙醇分子更容易被驱离成相,提高体系的分相能力[25]。
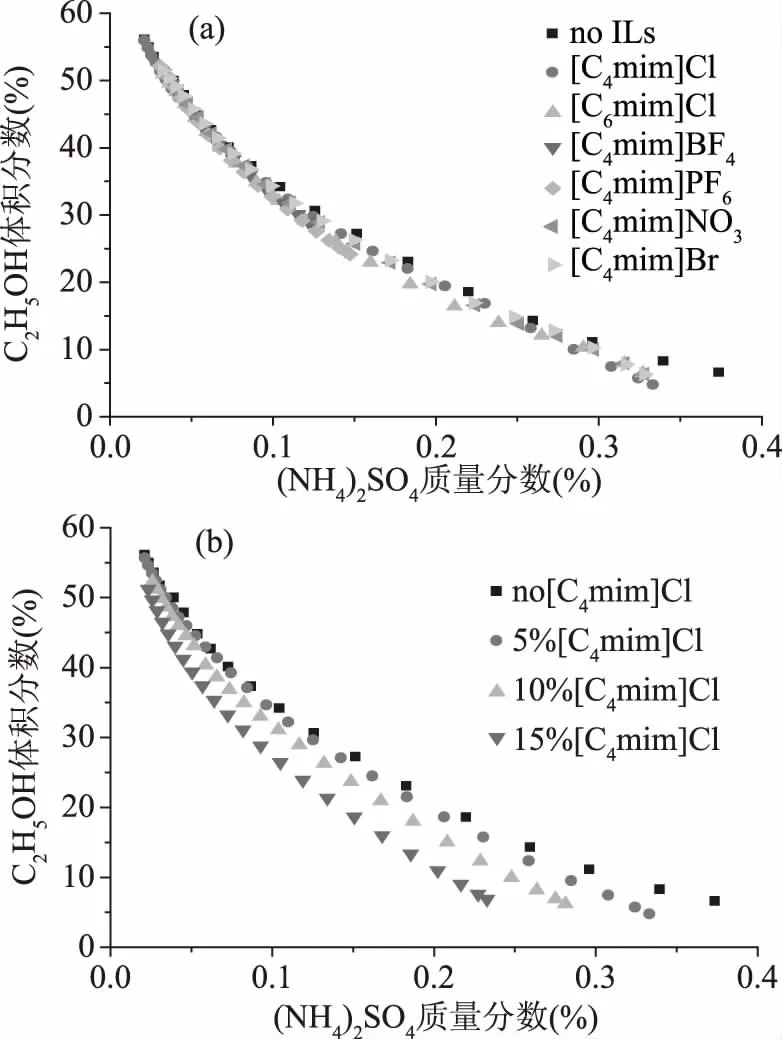
图2 IL辅助乙醇/硫酸铵ATPS的相图Fig.2 Phase diagrams of C2H5OH/(NH4)2SO4 ATPS added with ILs注:(a)不同类型ILs;(b)不同添加量[C4mim]Cl。
2.1.2 IL化学结构对茶多酚得率和抗氧化性的影响
2.1.2.1 IL化学结构对茶多酚得率的影响 不同化学结构IL辅助乙醇/硫酸铵ATPS对茶多酚得率及其抗氧化性的影响见图3和图4。由图3可知,未添加IL的ATPS对茶渣(tea waste,TW)中茶多酚得率仅为42.11±0.55 mg·g-1,IL的添加不同程度提高了茶多酚得率。这是由于在乙醇/硫酸铵ATPS中,上相为乙醇富集相,下相为盐富集相,茶多酚倾向分布在更加疏水和低电荷的乙醇富集相中。ATPS对目标组分能够实现有效萃取、富集,主要是两相中组分与目标组分各种作用力的平衡结果,这种作用驱动力包括疏水作用、氢键、静电作用以及π-π键共轭作用等,能够强化这种驱动力的手段就能够促进目标组分在对应相中的富集[17]。如IL中阳离子结构可与茶多酚形成氢键,咪唑环上π电子可以和茶多酚的π电子发生π-π共轭作用,促进茶多酚在乙醇相中的富集[18]。此外,IL中阴离子基团可以接受茶多酚中的质子等[26],有利于茶多酚组分的溶出及被乙醇相富集,提高茶多酚得率[17]。
对于IL中阳离子结构而言(如图3a所示),咪唑环阳离子相比于哌啶型和吡咯型IL,具有更高的茶多酚得率,这主要是由于咪唑环属于芳香环,具有π电子可以和茶多酚发生π-π电子共轭作用,此外咪唑环上含有两个N原子,与茶多酚组分形成的氢键作用更大[18]。咪唑环上的侧链越长,其疏水性增加,对中性的茶多酚分子具有更高的亲和性[25]。对于吡咯环和哌啶环两个非芳香性的环,六元环的哌啶环具有更高的疏水性,从而对中性茶多酚分子具有更高的亲和性。但由于[C4mim]Cl性价比最高,因此后续选择[C4mim]Cl。此外从图3b可知,固定阳离子结构为[C4mim],IL中不同阴离子结构对茶多酚得率影响大小顺序为:Br>BF4>Cl>NO3>PF6。且IL中阳离子结构变化对茶多酚得率的影响要大于阴离子结构变化的影响。
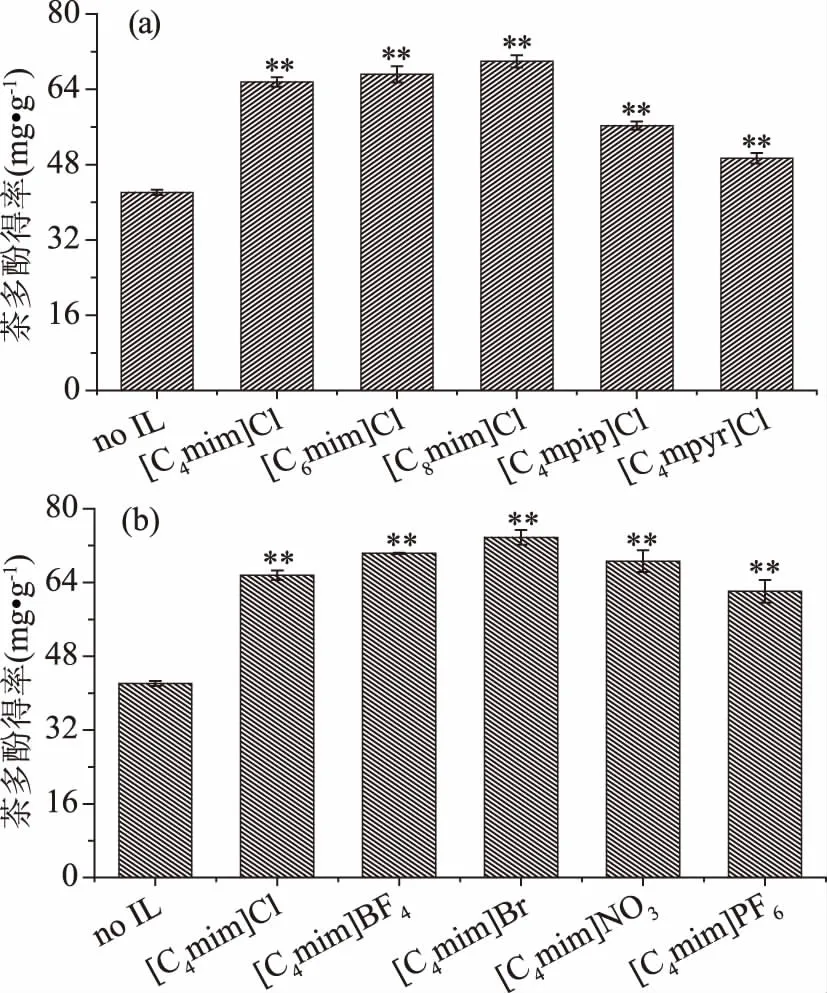
图3 IL化学结构对茶多酚得率的影响Fig.3 Effects of ILs chemical structureson the extraction yields of polyphenols注:(a)IL中不同阳离子结构的影响;(b)IL中不同阴离子结构的影响;图4同。以no IL数据为对照组,与之相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01),未标注表示差异不显著;图4、表5同。
2.1.2.2 IL化学结构对茶多酚抗氧化性的影响 不同化学结构的IL添加对茶多酚提取物的抗氧化活性影响如图4所示。未添加IL时,乙醇/硫酸铵双水相体系提取的茶多酚对DPPH自由基作用30 min时的半抑制浓度仅为1.43 μg·mL-1,表明茶多酚具有高效的抑制自由基能力,具有良好的抗氧化、抗老化作用。IL辅助后的茶多酚提取物对DPPH自由基的半抑制浓度虽有微弱升高,但都呈现为很低的浓度值(<2.00 μg·mL-1),说明试验选用的IL对茶多酚的抗氧化活性几乎没有抑制作用。
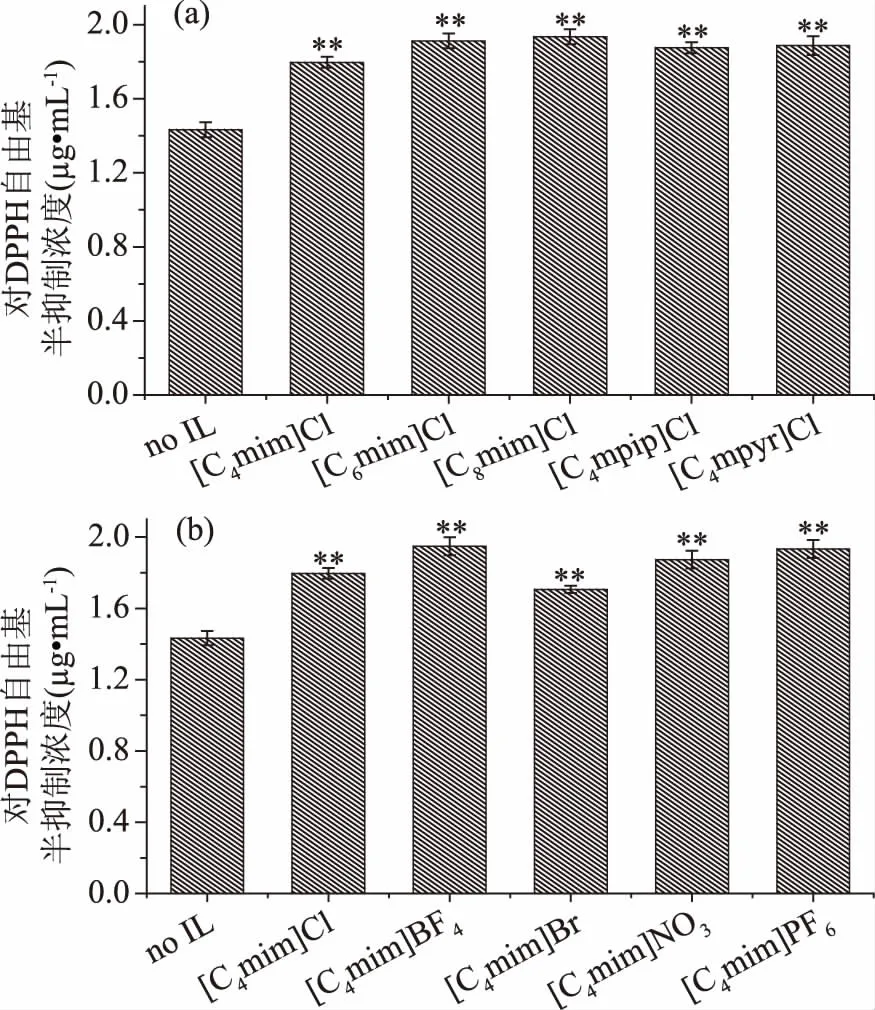
图4 IL化学结构对多酚提取液抗氧化性的影响Fig.4 Effects of ILs chemical structureson the antioxidant properties of the extraction
IL的加入虽然可以改变给定相的理化性质,调节其对目标组分的萃取或纯化能力,但由于IL通常成本较高,因此少量添加比较合适。综合考虑IL添加成本及辅助作用(如表2所示),其中价格/性能比值由25 g售价/茶多酚得率来简单估算,比值越小越好。由表2数据可知,[C4mim]Cl辅助的比值最小,因此后续试验选择[C4mim]Cl为添加辅助剂。
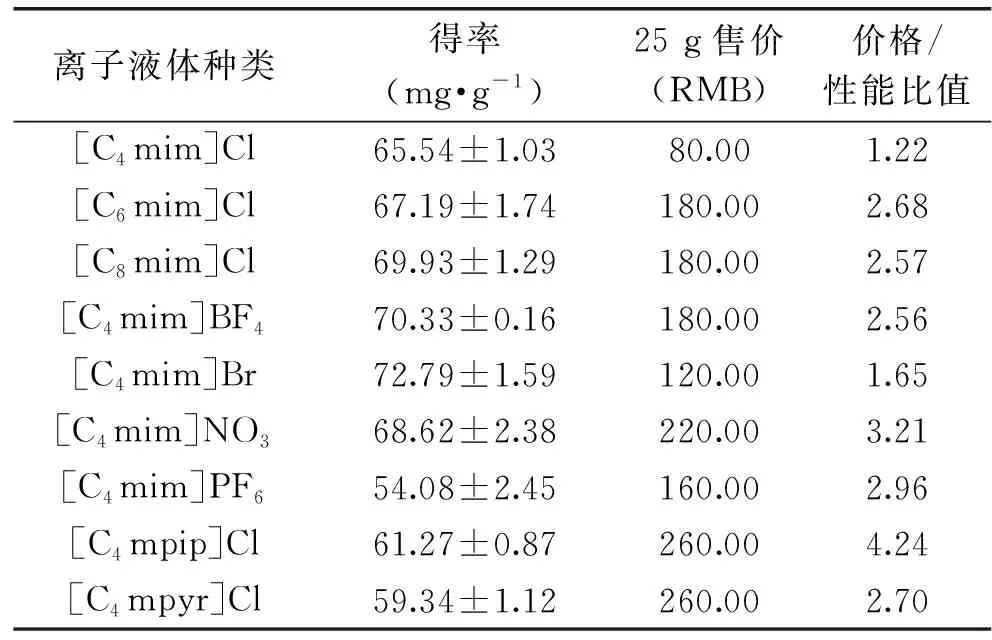
表2 不同离子液体性价比的比较Table 2 Comparison of cost and performance of ILs
2.1.3 [C4mim]Cl用量对茶多酚得率和抗氧化性的影响 [C4mim]Cl添加量对茶多酚得率和抗氧化性的影响结果如图5所示。由图5可知,随[C4mim]Cl用量增加,茶多酚得率逐渐提高,在[C4mim]Cl添加质量分数为10%时,茶多酚得率为75.52±0.75 mg·g-1,比未添加ILs时提高了79.34%。[C4mim]Cl添加并未影响茶多酚提取液的抗氧化性,提取液对DPPH自由基半抑制浓度保持在很低的浓度值范围(<2.00 μg·mL-1)。茶多酚在酸性环境中具有很好的稳定性,在乙醇/硫酸铵ATPS中,硫酸铵的存在使体系能够维持弱酸性环境,保证了茶多酚提取液的活性。
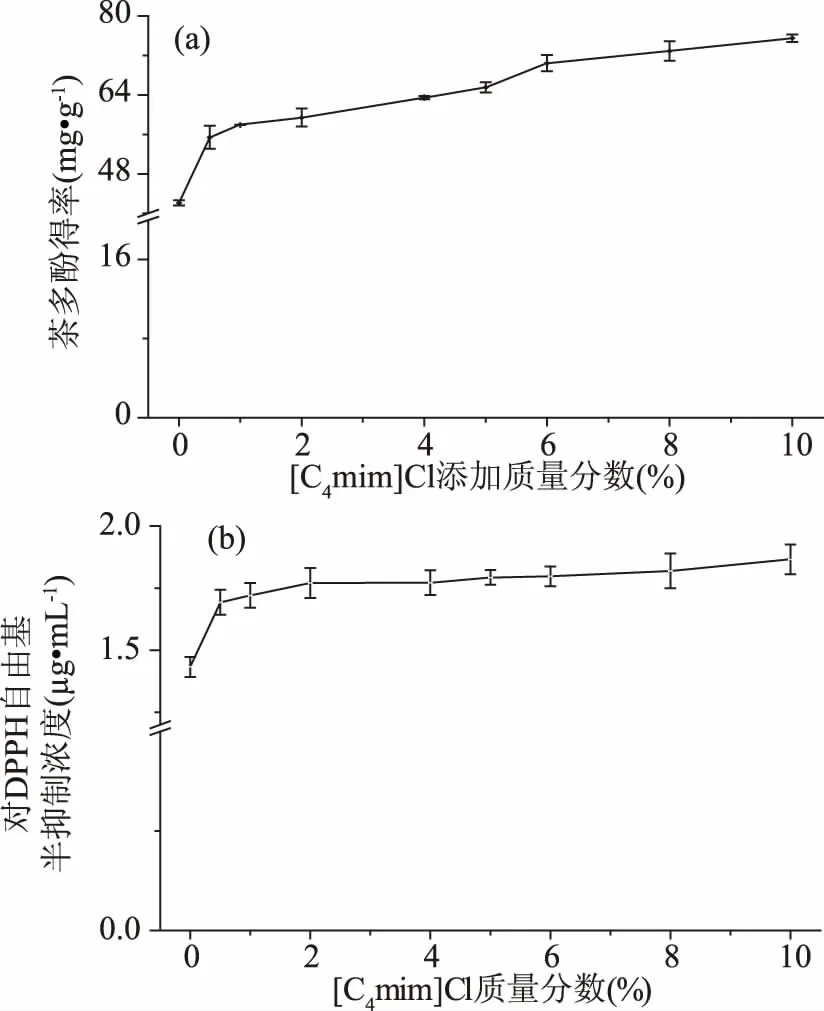
图5 [C4mim]Cl添加量对体系提取茶多酚的影响Fig.5 Effects of [C4mim]Cl contenton the extraction properties of polyphenol注:(a)茶多酚得率;(b)茶多酚提取液的抗氧化性。
2.2 [C4mim]Cl辅助乙醇/硫酸铵ATPS提取茶多酚工艺的单因素实验
2.2.1 乙醇体积分数对提取茶多酚工艺的影响 随乙醇体积分数增加,体系对茶多酚得率先增后减,在乙醇体积分数为60%时达到最大(如图6a所示)。乙醇用量增加,可与更多茶多酚组分发生作用,有助于茶多酚浸提,但用量过多会导致其他组分如蛋白质、多糖等沉淀,吸附部分茶多酚[27],降低其茶多酚得率。
2.2.2 硫酸铵质量分数对提取茶多酚工艺的影响 硫酸铵用量增加,其盐析作用增强,使更多乙醇分子聚集而为醇相,对茶多酚提取能力提高。但盐过多会吸附水而使乙醇相体积变小,对茶多酚得率下降[28]。因此硫酸铵最佳添加质量分数为30%(如图6b所示)。
2.2.3 料液比对提取茶多酚工艺的影响 随ATPS用量增加,茶多酚得率先增大后减小,在料液比为1∶35时最大(图6c)。这是由于体系用量增大,其对茶粉的渗透作用更充分,使内部的茶多酚被浸提出来;但溶剂用量过多,会导致部分多糖、蛋白质沉析,会吸附部分茶多酚使多酚得率下降。
2.2.4 提取温度对提取茶多酚工艺的影响 提取温度增加,溶剂分子活动能力增强,有利于体系对茶粉中茶多酚组分的浸提作用,茶多酚得率提高(如图6d)。但温度提高也会使茶多酚的稳定性下降[29]。因此综合考虑,[C4mim]Cl辅助乙醇/硫酸铵双水相体系提取茶多酚的适宜温度为50 ℃。
2.2.5 提取时间对提取茶多酚工艺的影响 随体系提取茶渣时间的延长,茶多酚得率先快速增加,然后变缓慢并趋于平衡(如图6e所示)。浸提时间延长,可使体系对茶粉中茶多酚发生更充分的浸提,当浸提时间延长到10 min以后,双水相体系对茶多酚的浸提作用基本达到极限,因此表现为茶多酚得率趋于平衡。因此提取适宜时间为10 min。
2.2.6 超声功率对提取茶多酚工艺的影响 随超声功率增加,茶多酚得率先增加后减小,在超声功率为540 W时得率最高。这是由于超声功率增强,体系对茶粉的振荡作用加强,有利于其对茶多酚的浸提作用。但超声功率过强,可能会使茶粉中部分多糖、蛋白质等沉析出来,反而降低了茶多酚得率。
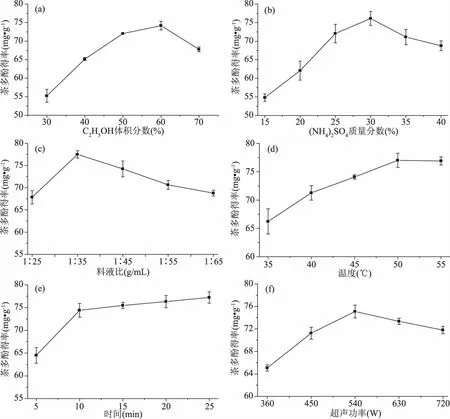
图6 不同因素对[C4mim]Cl辅助乙醇/硫酸铵ATPS提取茶多酚工艺的影响Fig.6 Effects of single factors on extraction of polyphenol by C2H5OH/(NH4)2SO4 ATPS added with[C4mim]Cl注:(a)乙醇体积分数的影响;(b)硫酸铵质量分数的影响;(c)料液比的影响;(d)提取温度的影响;(e)提取时间的影响;(f)超声功率的影响。
2.3 茶多酚提取工艺的正交试验优化
基于2.2实验结果,以茶多酚得率为指标,用正交试验法对乙醇体积分数、硫酸铵质量分数、料液比及超声功率四个因素进行优化,结果如表3及表4所示。从表4可知,对茶多酚得率影响大小顺序依次是乙醇体积分数>硫酸铵质量分数>料液比>超声功率,最佳因素组合为A2B2C3D2,即乙醇体积分数60%、硫酸铵质量分数30%、料液比1∶40和超声功率540 W,此条件下,平行结果分别为87.54、83.78、84.98及85.33 mg·g-1,平均值85.31±1.25 mg·g-1。
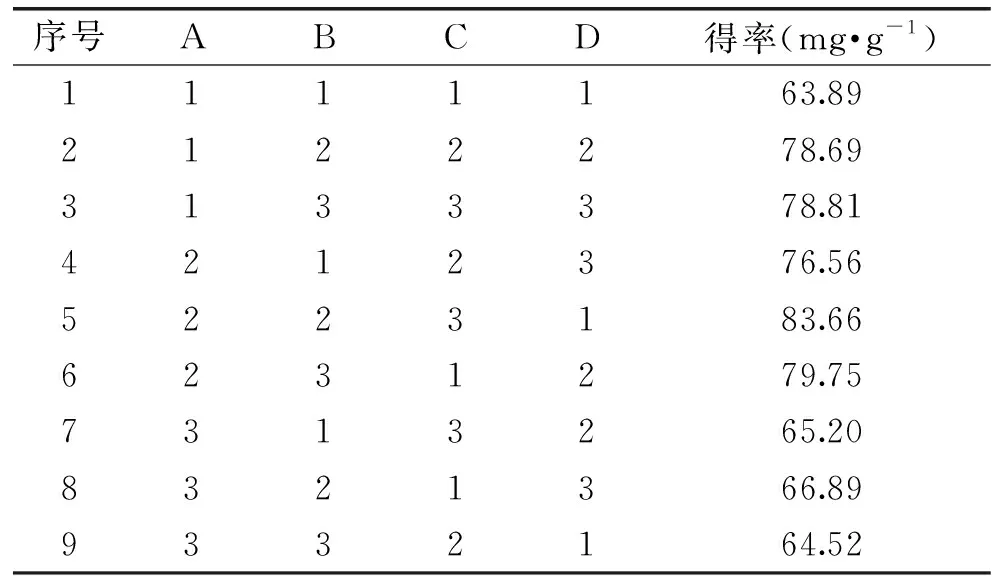
表3 正交试验结果Table 3 Results of orthogonal experiment
2.4 不同体系提取茶多酚得率比较
实验比较了质量分数为10%的[C4mim]Cl辅助乙醇/硫酸铵ATPS与其他提取体系,结果如表5所示。其中乙醇体积分数50%,PEG6000质量分数50%及盐质量分数25%,超声温度45 ℃、超声时间10 min、超声功率540 W、料液比1∶35。从表5可知,水浸提茶多酚得率仅为31.37±0.09 mg·g-1,有机溶剂乙醇的加入使茶多酚得率提高至39.61±1.41 mg·g-1,当乙醇溶液与无机盐组成ATPS后,茶多酚得率提高至42.11±0.55 mg·g-1,表明ATPS是一种具有较高效率的茶多酚提取方法。而离子液体[C4mim]Cl的加入,极显著提升了ATPS对茶多酚的得率(P<0.01),在[C4mim]Cl辅助乙醇/磷酸氢二钠及聚乙二醇2000/柠檬酸钠ATPS中,同样可看到IL添加对ATPS体系提取茶多酚得率有明显改善作用。表明IL辅助双水相体系提取茶多酚方法具有明显优势。

表4 正交试验结果分析Table 4 Analysis results of orthogonal experiment

表5 不同体系提取茶渣多酚提取液中儿茶素成分含量比较Table 5 Comparison in yields of polyphenol extracted by different methods
2.5 茶多酚提取液组成分析
[C4mim]Cl辅助乙醇/硫酸铵ATPS与其他体系提取茶渣多酚提取液的HPLC谱图如图7所示,其中[C4mim]Cl质量分数10%,乙醇体积分数50%。由于组分Na2HPO4、Na3C6H5O7存在使体系呈碱性,会使茶多酚变性,丧失活性,而组分(NH4)2SO4存在可使体系呈弱酸性,对茶多酚活性无损伤。因此仅研究了水、50%乙醇溶液、乙醇/硫酸铵ATPS及[C4mim]Cl辅助乙醇/硫酸铵ATPS四种系统对茶多酚提取液的组成。从图7中可知,水、50%乙醇溶液、乙醇/硫酸铵ATPS及[C4mim]Cl辅助乙醇/硫酸铵ATPS对茶渣多酚提取液的HPLC谱图中各峰保留时间基本一致,但各峰的峰高及峰面积存在差异。峰位置不同,代表不同组分,峰面积大小及其百分比则代表了该组分的含量。茶渣多酚提取液中主要含有茶多酚及咖啡因(CAF)等组分,茶多酚主要成分为儿茶素类物质,其是由儿茶素(C)、表儿茶素(EC)、没食子儿茶素(GC)、表儿茶素表没食子酸酯(ECG)及表没食子儿茶素表没食子酸酯(EGCG)等组成,各种儿茶素成分的保留时间[22]如表6所示。[C4mim]Cl辅助乙醇/硫酸铵ATPS与其他体系提取茶渣多酚提取液中主要成分含量的测定结果如图7、表6及表7所示。
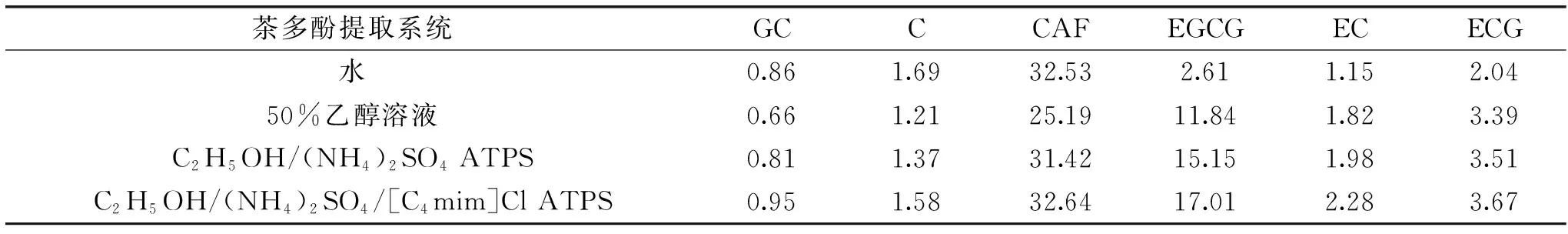
表7 不同体系提取茶渣多酚提取液中儿茶素成分含量比较(%)Table 7 Comparison of the catechin content in extraction of polyphenol extracted by different methods(%)
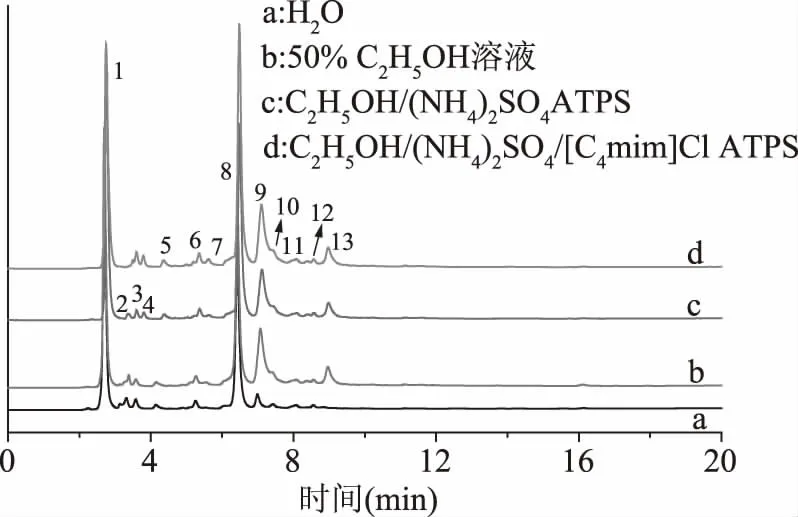
图7 不同体系提取茶渣中多酚提取液的HPLC谱图Fig.7 HPLC spectrums of the extraction ofpolyphenol extracted by different methods
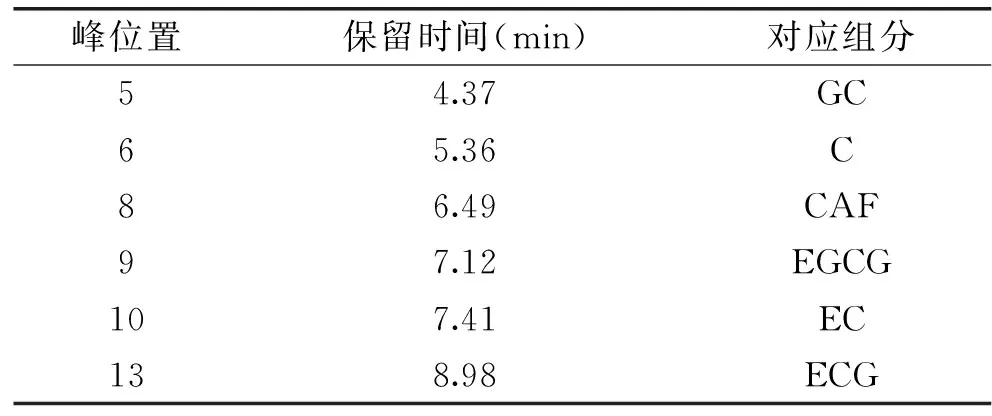
表6 茶渣提取液中主要成分及其保留时间Table 6 The main components in theextraction and it’s retention time
从表7中数据可知,水溶剂提取法对茶多酚的萃取能力最弱,其提取液中各种组分含量也最低。有机溶剂乙醇的加入,使其提取茶多酚能力有所提高,各种组分含量也有所增加。无机盐分硫酸铵的加入可与乙醇溶液形成双水相系统,进一步提高了体系对多酚组分的萃取能力,且提取液中儿茶素类物质组分的含量有所提高。[C4mim]Cl辅助乙醇/硫酸铵ATPS对茶多酚提取能力最高,其对茶渣的提取液中各种儿茶素类物质组分含量也最大。这主要是由于乙醇分子与茶多酚组分间作用力更强,乙醇引入可以提高体系的提取茶多酚能力。双水相体系作为一种液液分相的非色谱过程,可对目标组分实现分配,进行一定程度的富集作用,使组分含量和纯度提高[12];[C4mim]Cl的少量辅助,通过调节乙醇/硫酸铵上下相性质,提高了ATPS的分相能力和富集茶多酚能力。将这5种儿茶素类组分含量总和作为多酚提取液中儿茶素的总量,则可计算出[C4mim]Cl辅助乙醇/硫酸铵ATPS对茶渣的多酚提取液中儿茶素总量为25.49%,其比水溶剂、50%乙醇溶液及乙醇/硫酸铵ATPS提取液中儿茶素含量分别提高了205.27%、42.24%及11.70%。
3 结论
IL的加入使乙醇/硫酸铵ATPS相图中的两相区域面积增大,分相能力提高,IL加入量增加,乙醇与硫酸铵的分相能力提高。
通过对[C4mim]Cl辅助乙醇/硫酸铵ATPS茶多酚工艺的正交试验优化考察,发现各因素按影响大小顺序依次为乙醇体积分数>硫酸铵质量分数>料液比>超声功率,最佳工艺条件为乙醇体积分数为60%、硫酸铵质量分数为30%、料液比为1∶40 g/mL和超声功率为540 W,在此条件下,茶多酚得率为85.31±1.25 mg·g-1。
IL添加对ATPS体系提取茶多酚得率有明显改善作用,且[C4mim]Cl辅助乙醇/硫酸铵ATPS对茶渣中茶多酚得率明显高于其他体系,其提取液中儿茶素类组分含量更高,达到25.49%,比水溶剂、50%乙醇溶液及乙醇/硫酸铵ATPS提取液中儿茶素类组分总量分别提高了205.27%、42.24%及11.70%。
离子液体种类多、结构杂,其他不同结构组成离子液体对茶多酚得率及其影响机制,有待进一步研究。
