紫草素衍生物诱导肺癌细胞A549细胞周期阻滞及细胞凋亡
2020-08-17郝莹莹于佳斌练旭冬谢丹萍毛莹莹刘晓冬贺鑫梅金成浩申贵男
郝莹莹,于佳斌,练旭冬,谢丹萍,毛莹莹,刘晓冬,贺鑫梅,金成浩,申贵男*
(1.黑龙江八一农垦大学 生命科学技术学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学 食品学院,黑龙江 大庆 163319)
紫草为多年生传统中药材,可治疗丹毒、烧伤等疾病[1],其中以紫草素(Shikonin)为主要代表的萘醌类化合物是紫草中含量较多的化学活性成分[2]。萘醌类化合物具有包括抗癌、抗氧化在内的多种生理药理功能,但除了外用的烧烫伤治疗剂外,尚未得到广泛的临床应用[3-5]。
多项研究表明,萘醌类衍生物在生物体内可以通过诱导细胞凋亡以及导致细胞周期阻滞的方式抑制体内肿瘤和癌症细胞的生长[6-7]。其诱导细胞凋亡和细胞周期阻滞可以通过多种关键信号蛋白介导,例如P53与MAPKs(丝氨酸/苏氨酸蛋白激酶)家族蛋白[8-9]。紫草素可以使黑色素瘤细胞A375-S2的P53蛋白表达量增加,增高的P53蛋白激活促凋亡蛋白质Bax,进一步导致细胞线粒体大量释放细胞色素c激活caspase家族蛋白,诱导细胞发生线粒体依赖的细胞凋亡[10-11]。多项研究还表明MAPKs信号通路在细胞增殖、分化以及凋亡的过程中均起到重要调节作用[12]。前期研究表明,紫草素及其衍生物的生物活性主要来自于萘环羰基的亲电作用,通过结构修饰提高萘醌类衍生物的选择性并降低细胞毒性是化学合成的主要研究方向[13-15],羟基的甲基化正可大大降低萘醌母核5,8位羟基的较强细胞毒性[3]。
本实验设计合成了两种不同长度的2-取代萘醌类衍生物,对肺癌细胞A549的抗癌活性进行评价后探究了活性较强的2-辛亚砜-5,8-二甲氧基萘-1,4-二酮 (a) 抑制A549细胞周期阻滞和细胞凋亡的分子机制,以及不同长度,不同取代基基团对萘醌类衍生物构效关系有何影响。
1 材料与方法
1.1 材料
人肺腺癌细胞系 A549 使用黑龙江八一农垦大学生命科学技术学院细胞库的冻存细胞。
1.2 试剂及仪器
1,4-二甲氧基苯、马来酸酐、无水三氯化铝、对甲苯磺酸甲酯、氯化钠、浓盐酸、石油醚60-90、无水碳酸钠、邻二氯苯、正辛硫醇、正辛胺、浓硫酸、重铬酸钠、间氯过氧苯甲酸、碳酸氢钠、二甲基亚砜、无水硫酸钠均购自阿拉丁公司。DMEM/高糖(Gibco公司);胎牛血清(Gibco公司);抗p-JNK、p-ERK、p-P38、JNK、ERK、P38、P53、P21(Sigma-Aldrich);Cyclin A、Cyclin B1、Cyclin D1、Cyclin E、α-tubulin抗体(Santa Cruz公司);硝酸纤维素膜(Millipore公司);细胞凋亡试剂盒、细胞周期试剂盒(Sigma-Aldrich);MTT(Amresco公司);NC膜(PALL公司);ECL(Thermo公司);培养皿(NEST公司);蛋白免疫印迹系统(Amersham Bioscience公司);PE SCIX API2000 MS/MS质谱分析仪(SCIEX公司);AVANCE DPX-400 超导核磁共振谱仪(布鲁克公司);二氧化碳培养箱(SANYO);多功能酶标仪(TECAN公司)。
1.3 化合物合成
化合物的中间体5,8-二甲氧基萘-1,4-二酮以1,4-二甲氧基苯和马来酸酐为原料同三氯化铝、氯化钠155 ℃熔融反应获得5,8-二羟基萘-1,4-二酮,利用甲基化试剂对甲苯磺酸甲酯、碳酸钠进行甲基化获得[17]。
1.3.1 2-辛亚砜-5,8-二甲氧基萘-1,4-二酮(a)的合成
将5,8-二甲氧基萘-1,4-二酮(266.2 mg,1.22 mmol)溶于30 mL甲醇、加正辛硫醇(212.1 mg,1.45 mmol),室温搅拌6 h,加入浓硫酸(5 mL)和重铬酸钠(223.5 mg,0.75 mmol)的混合水溶液25 mL,继续搅拌2 min,氯仿萃取,脱水浓缩干燥后,乙醇重结晶得2-辛巯基-5,8-二甲氧基萘-1,4-二酮。
将2-辛巯基-5,8-二甲氧基萘-1,4-二酮(442.2 mg,0.35 mmol)溶于30 mL氯仿。分4次加入间氯过氧苯甲酸(65.6 mg,0.38 mmol),0 ℃反应,薄层层析法观察反应进程,至2-辛巯基-5,8-二甲氧基萘-1,4-二酮反应完毕,立即加入10 %碳酸氢钠水溶液(5 mL)终止反应。加入饱和氯化钠水溶液(30 mL)利用氯仿提取两次,脱水浓缩干燥后,硅胶柱层析得2-辛亚砜-5,8-二甲氧基萘1,4-二酮(a)。
1.3.2 2-辛胺基-5,8-二甲氧基萘-1,4-二酮(b)
将5,8-二甲氧基萘-1,4-二酮(266.2 mg,1.22 mmol)溶于30 mL甲醇、加正辛胺(187.4 mg,1.45 mmol),室温搅拌6 h,加入浓硫酸(5 mL)和重铬酸钠(223.5 mg,0.75 mmol)的混合水溶液25 mL,继续搅拌2 min,氯仿萃取,脱水浓缩干燥后,硅胶柱层析得2-辛胺基-5,8-二甲氧基萘-1,4-二酮(b)。
1.4 细胞培养
将从液氮取出的肺癌细胞(A549)复苏后培养于CCM高糖培养基内(CCM高糖培养基含10 %灭活的胎牛血清和1 %青霉素/链霉素),将细胞放置于培养箱中培养约24 h,24 h后可进行细胞换液,48h后可进行细胞传代(环境保持37 ℃、5% 的CO2及饱和湿度)。
1.5 MTT检测细胞增殖抑制
将第3代对数生长期状态良好,形态饱满的A549细胞接种于96孔的细胞培养板中(5×104个mL-1),培养24 h后分别加入不同浓度的化合物a和b继续培养24 h,24 h后每孔加入10 μL的MTT试剂(5 mg/mL)轻柔混匀后继续培养4 h。4 h后弃去除上层培养液,每孔加入100 μL二甲基亚砜,37℃孵育15 min,15 min后轻柔吹打混匀,酶标仪检测波长570 nm处溶液吸光值。
1.6 增殖曲线绘制
将第3代对数生长期生长状态良好,形态饱满的A549细胞接种于96孔细胞培养板中(5×104个mL-1),培养24 h,分别于第1、3、5和7天每孔加入10 μL MTT(5 mg/mL),培养4 h。4h后弃除上层培养液,每孔加入100 μL二甲基亚砜,37℃孵育15 min,15 min后轻柔吹打混匀,酶标仪检测波长570 nm处溶液吸光值后将吸光值汇总分析。
1.7 蛋白质印迹法分析
将药物处理后的细胞离心回收,加入提前配制好的蛋白质裂解液将细胞混匀使其裂解,离心20 min (12000 r/min、4 ℃),回收蛋白质上清。将15 μg的总蛋白在12 %十二烷基硫酸钠-聚丙烯酰胺凝胶上进行凝胶电泳,电泳后将蛋白质转移至硝酸纤维素膜上,封闭后用抗p-JNK、JNK、p-ERK、ERK、p-P38、P38、P53、P21、Cyclin D1、Cyclin E、Cyclin A、Cyclin B1和α-tubulin一抗(1:2000)在4 ℃下孵育过夜。弃去一抗后用TBST缓冲液(含0.2 % Tween-20、15 mmol/L 氯化钠和10 mmol/L Tris-Hcl)洗涤5次,每次5 min,与HRP标记二抗(鼠或兔、1∶5000)孵育2 h,洗膜、ECL显色、成像并分析结果。
1.8 细胞周期及细胞凋亡检测实验均参照试剂盒说明进行。
1.9 统计学分析
用绘图软件SigmaPlot绘图,多组均数采用t检验进行比较,P<0.05为有统计学差异,P<0.01为有显著性统计学差异,P<0.001为有极其显著性统计学差异。
2 结果
2.1 萘醌类衍生物的合成与鉴定
2-Octylsulfinyl-5,8-dimethoxy-naphthalene-1,4-dione (a):1H NMR (CDCl3,400 MHz) δ 7.41 (d,J = 9.2 Hz,1H),7.36 (d,J = 9.6 Hz,1H),7.30 (s,1H),3.99 (s,6H),3.23 (m,1H),2.90 (m,1H),1.90 (m,1H),1.64 (m,1H),1.45 (m,2H),1.25 (m,8H),0.87 (t,J = 7.2 Hz,3H); ESI-MS: m/z 400.8 (M+Na)+。
2-Octylamino-5,8-dimethoxy-naphthalene-1,4-dione (b):1H-NMR (CDCl3,400 MHz) δ 7.34 (d,J = 9.6 Hz,1H),7.18 (d,J = 9.6 Hz,1H),5.69 (br,1H),5.61 (s,1H),3.96 (s,3H),3.94 (s,3H),3.11 (q,J=6.8 Hz,2H),1.68~1.61 (m,2H),1.41-1.20 (m,10H),0.88 (t,J=6.4 Hz,3H); m/z 346 (M+H)+。
根据波谱学数据显示,2种产物为目标化合物。化合物的合成路线如下(Fig.1)。
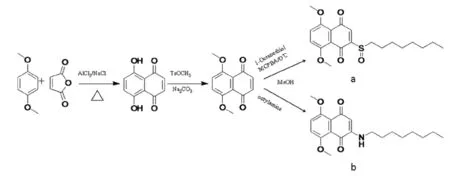
图1 萘醌类衍生物a、b的合成路线
2.2 化合物a对A549细胞具有明显的增殖抑制作用
为检测含有不同取代基的萘醌类衍生物对A549细胞的增殖抑制效果,以1、3、5、7、9、11、13、15μmol/L浓度的2种萘醌类化合物处理A549细胞24 h,通过MTT assay的方法对A549细胞活力进行检测(图2)。结果显示,化合物a浓度依赖性的抑制A549细胞;而化合物b在各浓度梯度均未显示出抑制活性。说明不同取代基(辛亚砜与辛胺基)对萘醌类衍生物的抗癌活性影响较大,巯基取代显示较好的抑制A549细胞增殖活性,而氨基取代导致化合物不能抑制A549细胞的增殖能力。
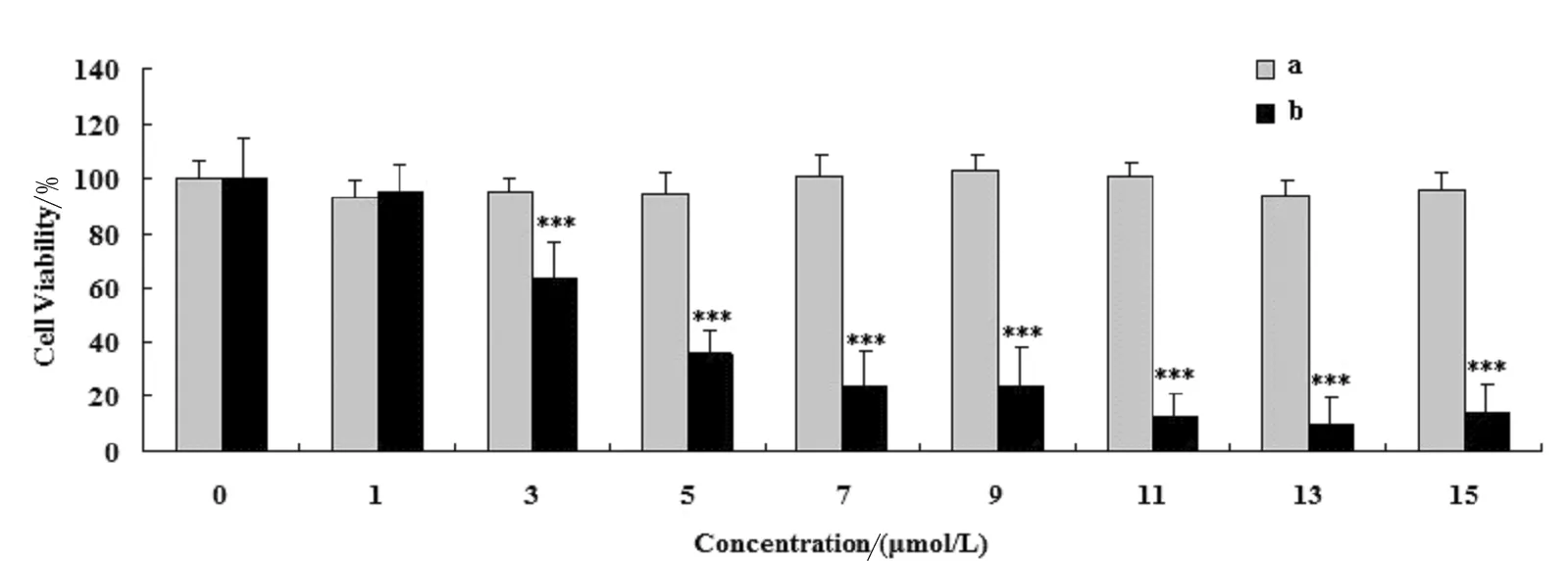
图2 萘醌类衍生物对A549细胞活力影响 MTT法检测A549细胞活力.***P<0.001,compared with control (0 μmol/L) group
2.3 化合物a抑制A549细胞增殖并导致G0/G1期阻滞
上述结果证明化合物a对A549细胞具有明显的生长抑制作用,随后通过3 μmol/L 化合物a处理A549细胞绘制出的生长曲线(图3A),以及0、3、8、12 μmol/L 浓度处理A549细胞6 h的细胞周期变化情况(图3B)可知,化合物a在3 μmol/L浓度下对A549细胞增殖具有显著地抑制作用。细胞周期的数据显示,化合物a可导致A549细胞发生显著的G0/G1期阻滞,且阻滞百分比呈药物浓度依赖性。
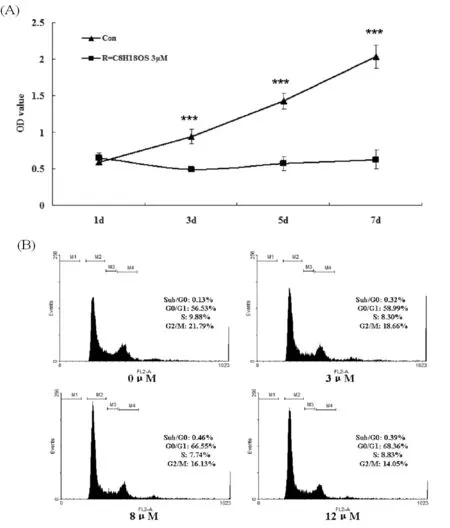
图3 化合物a抑制A549增殖和G0/G1细胞周
期阻滞 (A)3 μmol/L化合物a处理A549细胞绘制生长曲线;***P<0.001,与空白对照组(0 μmol/L) 比较 (B) 检测0、3、8、12 μmol/L 化合物a处理A549细胞6 h的细胞周期变化情况。
2.4 化合物a对A549细胞P53、MAPKs和细胞周期蛋白的影响
P53作为体内的抑癌基因,在正常细胞中表达较少,但是其在防止肿瘤的发生、发展中扮演着非常重要的角色,P53蛋白可与P21基因调节区相互结合,激活P21基因转录,抑制Cyclin D,CDK4/6复合体和CyclinE导致细胞停滞在细胞周期的G1期[18]。MAPKs信号通路也可以介导细胞凋亡,细胞周期阻滞以及细胞因子的分泌等过程。因此对P53及MAPKs的检测有助于深入探讨2-辛亚砜-5,8-二甲氧基萘-1,4-二酮的结构与其生物活性的关系。经过检测0、3、8、12 μmol/L 化合物a处理6 h后A549细胞的P53/P21信号关键蛋白,MAPKs信号通路关键蛋白以及细胞周期相关蛋白(图4)。结果显示,P53,P21的表达水平和P38,ERK的磷酸化水平以及多种细胞周期蛋白的表达水平都随化合物浓度的增加而显著增加,但是JNK的磷酸化水平无明显变化。以上结果显示,化合物a可激活A549细胞中P53、P38和ERK信号通路。
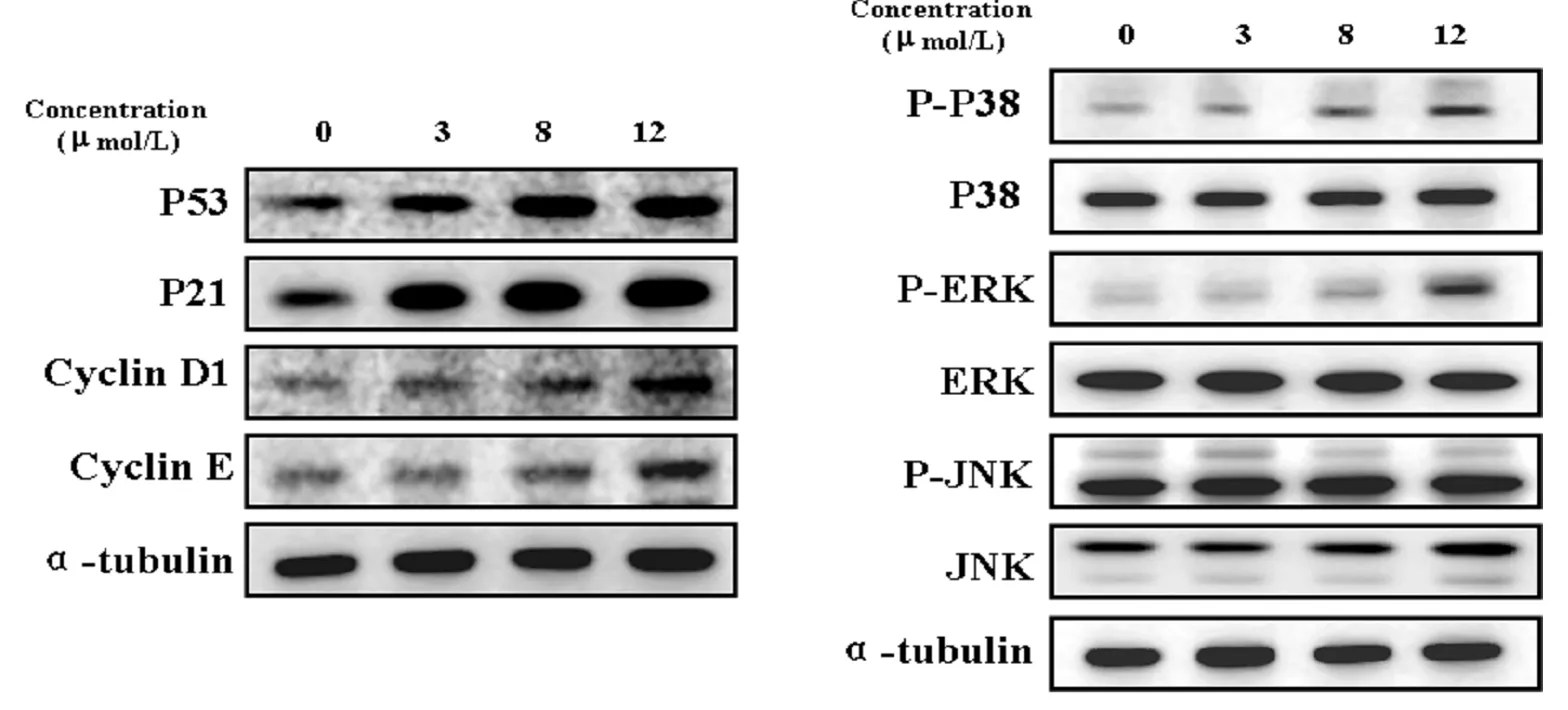
图4 化合物a对A549细胞P53、MAPKs和细胞周期蛋白的影响
2.5 化合物a可导致A549细胞凋亡
萘醌类化合物可诱导多种细胞发生凋亡,通过检测化合物a对A549细胞凋亡的影响(图5)。显示,在6 h处理时,化合物a并不会引起细胞凋亡(图5A),这与之前细胞周期Sub/G0期的变化相一致(图3),但是结果显示相应的信号通路已经被激活(图5B)。因此延长处理时间来检测A549细胞凋亡和细胞周期的情况,结果显示,在较长时间处理(12 h、24 h、48 h)处理时,部分A549细胞发生细胞凋亡,并且随处理时间的延长凋亡的细胞逐渐增多(图5C、D)。以上结果证明,化合物a可显著诱导A549细胞发生细胞凋亡。

图5 化合物a对A549细胞凋亡的影响 (A)和(C)AnnexinV染色法检测A549细胞凋亡水平;(B)和(D)检测细胞凋亡信号通路
3 讨论
萘醌类衍生物具有良好的抗肿瘤活性,实验通过MTT法明确化合物a对A549细胞很强的生长抑制作用,它可以使A549细胞发生G0/G1期的细胞周期阻断,并随着处理时间的延长有部分细胞会发生凋亡;从时间的先后顺序以及细胞周期的结果可以看出,化合物a先导致细A549细胞发生细胞周期阻滞,随着处理时间的延长,细胞无法突破细胞周期阻滞随后发生了细胞凋亡。A549细胞会大量的表达细胞周期相关蛋白使其突破细胞周期的限制快速增殖,而化合物a通过p21抑制周期相关蛋白质的活性使细胞周期发生阻滞,但相关细胞周期蛋白代偿性的表达量增多,因此可以看出化合物a可抑制细胞增殖。化合物a值得进一步修饰,并在多种肿瘤细胞上评价其抗癌活性。
化合物b在相同的浓度下没有表现出对A549细胞的抑制作用,说明2位的胺基大幅降低了该化合物对A549细胞的细胞毒性,这是也非常有意义的发现。首先,这两种化合物结构非常相似,不同之处只在于2位的取代基,这一发现可以给今后的萘醌类衍生物修饰提供理论依据;其次,虽然化合物b对A549细胞没有增殖抑制作用,因为没有毒性可在其它领域如抗炎、抗老化方面检测活性,做进一步研究。
4 结论
综上所述,化合物a能够激活P53和MAPKs信号通路导致A549细胞G0/G1期的细胞周期发生周期阻滞,进一步诱导凋亡,抑制了A549细胞增殖。化合物b在相同浓度下没有抑制A549细胞增殖的作用,说明萘醌2-位的巯基取代相对于氨基取代显示较好的抗癌活性。此结论为萘醌类衍生物的构效关系研究提供了重要的理论依据,为萘醌类衍生物抗肿瘤药物的筛选与合成提供了新的思路。
