绵羊GDF9基因G1突变可视化检测方法的建立
2020-08-17徐越仁李慧向张梦丹胡圣伟
刘 莉,姚 瑞,徐越仁,李慧向,张梦丹,胡圣伟
(石河子大学 生命科学学院,新疆 石河子 832003)
在牲畜物种中,排卵率和胚胎存活率是具有重要经济意义的指标[1]。绵羊是一种小型产仔动物,非常适合作为研究繁殖力基因的模型生物[2]。绵羊排卵率的遗传变异已引起许多学者的关注,PURFIELD等[3]研究发现,不同绵羊品种之间排卵率存在显著差异,并且在许多情况下,不同品种(系)之间存在异常差异。由于目前没有进行定向选育,带有多胎性能主效基因的个体数量较少,大多数还分散在群体之中。如果按照多胎绵羊的选育措施,加强本品种选育,建立核心群,就可以提高多胎性能基因型频率,使多胎性能主基因固定下来。
绵羊生长分化因子(GDF9)是卵母细胞分泌的旁分泌因子,是早期卵泡形成以及绵羊卵巢中颗粒细胞和卵泡膜细胞的关键分化因子[4-7]。绵羊GDF9对早期卵泡的生长和发育起着重要的调节作用[8],甚至这个卵母细胞衍生的生长因子会影响绵羊的排卵率[9-11]。前人将GDF9基因定位到绵羊第5条染色体上,基因跨度约为2.5 kb,由2个外显子组成,由单个长为1 126 bp的内含子分隔,编码453个氨基酸残基的前肽,活性成熟肽由135个氨基酸组成[12-14]。HANRAHAN等[14]通过PCR-单链构象多态性(PCR-single-strand conformation polymorphism,PCR-SSCP)分析,在GDF9中已经鉴定出8个单核苷酸多态性(Single nucleotide polymorphism,SNP)位点(G1—G8),其中有5个突变(G1、G4、G6、G7和G8)会导致氨基酸的改变。G1突变是在260位点处的碱基由G突变为A,在外显子1的氨基酸残基87处,导致精氨酸向组氨酸的变化[12],这种取代可能会影响成熟的GDF9蛋白的活性[15]。POLLEY等[16]研究发现,GDF9基因G1突变在加罗莱羊中具有多态性。随后,KOLOSOV等[17]在俄罗斯绵羊品种中也鉴定出G1多态性,并发现其与绵羊多产相关联。此外,在伊朗的Moghani、Ghezel绵羊[18]和印度的Garole绵羊[19]中也发现了GDF9基因G1突变。目前,国内存在G1突变的绵羊品种包括小尾寒羊、湖羊、特克塞尔羊、德国肉用美利奴羊、陶赛特羊、洼地绵羊、杜泊羊以及巴音布鲁克羊[20]。CHU等[21]通过PCR-SSCP研究发现,GDF9基因G1突变与小尾寒羊多胎性状显著相关,对于小尾寒羊中的G1突变,基因型AA的第1胎和第2胎的最小产仔数均较基因型AG多。因此,建立快速、准确的可视化检测绵羊GDF9基因G1突变的方法可为多胎绵羊的选育提供参考。
目前,检测绵羊GDF9基因G1突变的方法主要有聚合酶链式反应-限制性片段长度多态性(Polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)[17-18,20]、PCR-SSCP[21]等,但是这些方法在准确度、成本、劳动力和时间消耗等方面存在不足。为此,研究通过将改良的扩增阻滞突变系统(ARMS)与核酸染料SYBR Green Ⅰ结合,以期快速可视化检测出具有经济性状的候选基因GDF9基因G1突变。
1 材料和方法
1.1 试验材料
1.1.1 供试样本 样本于2018年10月采集自新疆石河子市某屠宰场,包括2个小尾寒羊子宫样本和25个小尾寒羊肌肉样本。其中,子宫样本采集自怀孕母羊,1个子宫样本中只有1只羊羔,另1个子宫样本中有2只羊羔。将所有样本分别置于冻存管内并贴标签后放在-20 ℃的环境中保存。
1.1.2 主要试剂 基因组DNA提取试剂盒、2×TaqPCR Master Mix购自天根生化科技(北京)有限公司;ExTaq酶、DL500 DNA Marker、10×Loading Buffer购自宝日医生物技术(北京)有限公司;SYBR Green Ⅰ(10 000×浓缩液)购自索莱宝科技(北京)有限公司。
1.2 试验方法
1.2.1 DNA提取 按照基因组DNA提取试剂盒说明书提取采集样本的基因组DNA,并将DNA保存在无菌水中。采用琼脂糖凝胶电泳和微量核酸蛋白质检测仪(ND 2000)检测以确定提取的DNA的质量。
1.2.2 引物设计 参考GenBank公布的绵羊GDF9基因(NC_040256.1)序列,使用引物设计软件Primer Premier 5.0设计ARMS特异性引物,根据ARMS的原理,使下游引物3′端的最后1个碱基与G1突变位点(rs410123449)互补,下游引物3′端的最后1个碱基是T而不是C。分别在下游引物3′末端的第2、3、4位碱基处引入1个额外的错配以提高引物的特异性(表1、图1)。具有额外错配的引物对于突变型模板来说只存在1个错配,然而对于野生型模板来说,引物与模板之间存在2个错配,链延伸反应会因磷酯键形成困难而受阻。筛选4对引物中只扩增突变型,而不扩增野生型样本的最佳引物对。
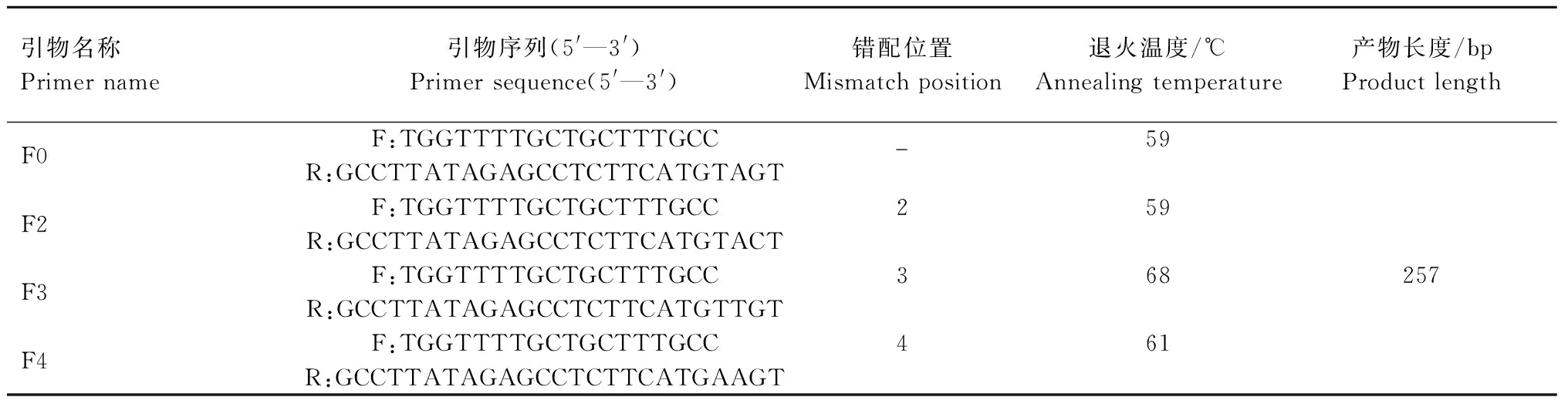
表1 用于检测GDF9基因G1突变的ARMS引物序列及其反应条件Tab.1 ARMS primers sequences used to detect G1 mutation of GDF9 gene and their reaction conditions
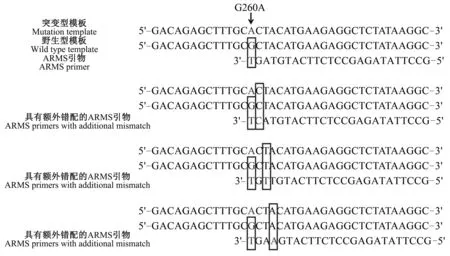
图1 ARMS引物设计原理 Fig.1 Design principle of ARMS primers
此外,针对绵羊GDF9基因G1突变设计1对常规引物,用于样本的测序。引物序列为F:5′-TCCTATTAGCCTTGATTCTCTG-3′;R:5′-TGCTCCTACACACCTGCC-3′,预计扩增片段为354 bp。引物均由北京睿博兴科生物技术有限公司合成。
1.2.3 ARMS PCR及最佳引物对的筛选 采用ARMS检测GDF9基因G1突变,以20 μL反应体积进行ARMS PCR。每个反应均包括0.1 μL ExTaq(5 U/μL)、1.6 μL dNTP Mixture(各2.5 mmol/L)、1.2 μL MgCl2(25 mmol/L)、2 μL 10× PCR Buffer(Mg2+free)、0.5 μL 0.1 μmol/L上游引物、0.5 μL 0.1 μmol/L下游引物、1 μL 绵羊的基因组DNA,最后加入ddH2O将反应体积补至20 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,退火温度(表1)复性30 s,72 ℃延伸30 s,30个循环;最后72 ℃延伸5 min,4 ℃保存。采用2%琼脂糖凝胶电泳检测PCR产物并用分子成像仪[伯乐生命医学产品(上海)有限公司]拍照。
将已知产羔数并通过测序验证基因型的怀孕母羊的子宫样本基因组DNA与设计的特异性引物进行如上所述的ARMS扩增,以ddH2O代替基因组DNA作为阴性对照,通过电泳筛选出反应最佳的引物对。
1.2.4 ARMS和SYBR Green Ⅰ结合可视化检测GDF9基因G1突变 利用筛选的最佳引物对进行GDF9基因G1突变的可视化检测。所使用的模板与引物筛选使用的模板相同,以ddH2O代替模板作为阴性对照。ARMS PCR结束后,向PCR产物中加入SYBR Green Ⅰ,混匀后立刻用肉眼观察PCR管中颜色的变化,并拍照记录。
1.2.5 可视化检测系统的准确度检测 对25个小尾寒羊样本进行了GDF9基因G1突变的可视化检测,以已知产羔数和基因型的样本作为参考,以ddH2O代替模板作为阴性对照。同时,将25个样本的PCR产物进行琼脂糖凝胶电泳,初步验证可视化检测结果。此外,将25个样本送到北京睿博兴科生物技术有限公司测序,以验证可视化检测的准确度。
2 结果与分析
2.1 GDF9基因G1突变可视化检测最佳引物对的筛选
从图2可以看出,所有引物都可以对突变型样本的基因组进行扩增,然而在距离下游引物3′端的第2(F2)和第4位(F4)碱基处具有额外错配的引物,尤其是不具有额外错配的引物(F0)都能对野生型样本基因组进行扩增。当额外的错配位于下游引物3′端的第3位碱基处时(F3),特异性引物只对突变型样本的基因组进行扩增,而不扩增野生型样本基因组,且扩增产物的条带清晰。可见,F3是可用于可视化检测的最佳引物对。

M:DL500 DNA Marker;NC:阴性对照;1、2:F0对野生型、突变型绵羊基因组扩增结果;3、4:F2对野生型、突变型绵羊基因组扩增结果;5、6:F3对野生型、突变型绵羊基因组扩增结果;7、8:F4对野生型、突变型绵羊基因组扩增结果M:DL500 DNA Marker;NC:Negative control;1,2:The results of F0 amplification of genome DNA of wild type and mutant genotype,respectively;3,4:The results of F2 amplification of genome DNA of wild type and mutant genotype,respectively;5,6:The results of F3 amplification of genome DNA of wild type and mutant genotype,respectively;7,8:The results of F4 amplification of genome DNA of wild type and mutant genotype,respectively图2 ARMS引物PCR扩增结果Fig.2 PCR amplification results of ARMS primers
2.2 GDF9基因G1突变可视化检测结果
ARMS PCR后,向PCR产物中加入SYBR GreenⅠ,可以在突变型中观察到明显的颜色变化(图3)。野生型与阴性对照都没有发生颜色变化,显示SYBR Green Ⅰ 原本的颜色即橙黄色,然而突变型模板与引物发生特异性扩增,其产物与SYBR Green Ⅰ 结合后使SYBR Green Ⅰ的颜色变为亮绿色。
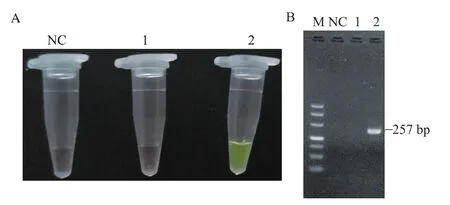
A:可视化检测绵羊GDF9基因G1突变野生型和突变型;B:与可视化检测结果对应的电泳结果。M:Marker;NC:阴性对照;1:野生型样本;2:突变型样本A:Visual detection of wild type and mutant genotype of G1 mutation of GDF9 gene in sheep;B:Electrophoresis results corresponding to visual detection results.M:Marker;NC:Negative control;1:Wild type sample;2:Mutant uype sample图3 绵羊GDF9基因G1突变可视化检测Fig.3 Visual detection results of G1 mutation of GDF9 gene in sheep
2.3 GDF9基因G1突变可视化检测系统的准确度
采用建立的可视化检测绵羊GDF9基因G1突变的方法检测小尾寒羊样本,结果显示,野生型和突变型样本之间颜色变化明显,可视化检测结果与电泳结果一致(图4)。25个样本中,有9个样本被检测为突变型,16个样本被检测为野生型,可视化检测结果与测序结果完全一致,可视化检测方法的准确度高达100%(表2)。结果表明,ARMS与SYBR Green Ⅰ结合的可视化检测有很好的稳健性,每个样本检测成本低于3元。

A、 B:可视化检测10个小尾寒羊样本;C、D:与可视化检测结果对应的电泳结果。NC:阴性对照;1—10:分别代表表2中序号1—10样本;WT:已知野生型样本;MT:已知突变型样本A,B:10 small tail han sheep samples for visual detection;C,D:Electrophoresis results corresponding to visual detection results.NC:Negative control;1—10:Represent samples with serial numbers 1—10 in Tab.2,respectively;WT:Known wild type sample;MT:Known mutant genotype sample图4 可视化检测10个小尾寒羊样本GDF9基因G1突变Fig.4 Visual detection results of G1 mutations of GDF9 gene of 10 small tailed Han sheep samples

表2 可视化检测25个小尾寒羊样本GDF9基因G1突变及对应的测序基因型Tab.2 Visual detection results of G1 mutation of GDF9 gene and corresponding sequencing genotypes of 25 small tailed Han sheep samples
3 结论与讨论
目前,最常用的检测ARMS扩增的方法是琼脂糖凝胶电泳,该方法操作繁琐,且需要借助电泳仪等设备[22]。相比较而言,染料分析的方法既提高了肉眼的识别率,又有望应用于现场的检测,是最为简单方便的结果判定方式[23-25]。本研究选择SYBR Green Ⅰ核酸染料,向PCR产物中加入染料后,可通过观察PCR管内的颜色变化来判断其是否扩增成功,进而判断样本是否含有GDF9基因G1突变。采用SYBR Green Ⅰ检测ARMS扩增,其原理是SYBR Green Ⅰ能嵌入双链DNA(Double-stranded DNA,dsDNA)双螺旋小沟区域,其在游离状态下发出很弱的荧光,然而当其与dsDNA结合后,荧光强度大大增强,可以利用其荧光强度变化来检测核酸扩增。此外,当SYBR Green Ⅰ含量较高时,自然光条件下呈现橙黄色,当其与dsDNA结合后则会显现为亮绿色。PCR反应结束后,直接将SYBR Green Ⅰ加入PCR产物中,混匀后直接观察PCR管内颜色的变化,携带有GDF9基因G1突变的样本呈亮绿色,反之则为橙黄色。
GDF9和BMP15基因对排卵率、卵母细胞健康和妊娠的建立起着至关重要的作用[26]。CRAWFORD等[27]研究发现,裸卵(Denuded oocyte,DO)中GDF9与BMP15基因表达水平的比值与物种间繁殖率有关。BMP15、GDF9基因不仅具有较高的同源性、相似的结构及在卵巢中类似的表达模式,而且在功能上也密切相关,通常表现出协同效应。CHANG等[28]在母羊中发现,GDF9、BMP15基因共存突变对排卵率具有累积影响。GDF9和BMP15基因共同突变母羊的排卵率高于GDF9或BMP15基因单个突变母羊的排卵率[29]。在今后的研究中,检测绵羊的GDF9基因突变的同时,还要检测绵羊的BMP15基因的突变,以筛选出繁殖力尤其突出的绵羊进行下一步的培育。
本研究将核酸染料SYBR Green Ⅰ与改良的ARMS一起应用于可视化检测绵羊的GDF9基因G1突变,突变型显现亮绿色而野生型显现为橙黄色,建立的检测方法可直观检测GDF9基因G1突变,且准确度达到100%。
