野猪粪便中乳酸菌的分离鉴定及特性研究
2020-08-15王翌李淼李永锋孙元仇华吉
王翌,李淼,李永锋,孙元,仇华吉
野猪粪便中乳酸菌的分离鉴定及特性研究
王翌,李淼,李永锋,孙元,仇华吉
(中国农业科学院哈尔滨兽医研究所/兽医生物技术国家重点实验室,哈尔滨 150069)
【】筛选安全的、具有优良特性的乳酸菌菌株,进一步研发益生制剂,为饲料添加剂等动物相关产品提供资源。从我国黑龙江省大兴安岭地区采集野猪粪便样品13份,编号后置于4℃保温箱迅速运回实验室,利用MRS培养基分离纯化乳酸菌。使用细菌基因组DNA提取试剂盒提取分离菌株的基因组DNA,利用细菌16S rDNA通用引物进行PCR鉴定,将扩增得到的序列测序后在NCBI上使用BLAST与GenBank数据库中序列进行对比分析,确定各菌株的分类学地位。将鉴定后的乳酸菌菌株分别接种于酸性(pH 3.0)和含胆盐(0.3%)的MRS培养基,在不同条件下评价乳酸菌菌株的耐酸、耐胆盐特性。将过夜培养的乳酸菌于室温条件下静置,在不同时间测定其OD600nm,进行自凝集能力评价;过夜培养的菌株分别与致病性埃希氏大肠杆菌、金黄色葡萄球菌和鼠伤寒沙门氏菌3种致病菌混合后于室温静置,进行共凝集能力检测。在体外,分别进行乳酸菌菌株对Caco-2细胞和IPEC-J2细胞的黏附能力测定,评价不同菌株的黏附能力。通过测定乳酸菌菌株对致病性埃希氏大肠杆菌、金黄色葡萄球菌和鼠伤寒沙门氏菌3种致病菌的抑菌环直径,评价分离菌株的抑菌活性。通过体内外试验评价乳酸菌菌株的安全性。在体外,分别以模式菌株嗜酸乳杆菌和金黄色葡萄球菌作为阴性对照和阳性对照,将3株乳酸菌菌株和对照菌株在血平板上划线,37℃厌氧孵育18—24 h,观察细菌菌落周围是否形成溶菌环,评价分离菌株的溶血特性。使用文献中已报道的毒力因子引物对分离的乳酸菌菌株进行PCR扩增,检测是否存在毒力因子的编码基因,评估分离菌株的安全性。在体内,将过夜培养的乳酸菌连续饲喂7周龄的BALB/c小鼠21 d,分别测定小鼠的初始体重和最终体重,观察计算体重变化情况;饲喂21 d后,解剖获取小鼠的脾脏、肝脏和肾脏计算器官指数,评价分离乳酸菌菌株的体内安全性。从野猪粪便中分离得到3株对酸和胆盐具备一定耐受力的乳酸菌,经鉴定分别为蒙氏肠球菌()、耐久肠球菌()和黏膜乳杆菌()。3株乳酸菌菌株均表现出较强的自凝集能力和对致病菌的共凝集能力,同时对Caco-2细胞和IPEC-J2细胞均表现出较强的黏附能力,抑菌试验结果显示黏膜乳杆菌对3种致病菌均具备较强的抑菌活性。经体内外安全性评价,3株乳酸菌菌株无溶血性,且均未检测到毒力基因,经其连续饲喂的小鼠行为表现正常、状态良好,其中,与对照组相比,黏膜乳杆菌饲喂后小鼠增重显著。从大兴安岭野猪粪便中分离的3株乳酸菌(特别是黏膜乳杆菌)具有良好的特性和安全性,具备进一步开发益生菌制剂的潜力。
野猪;乳酸菌;凝集能力;黏附能力;安全性
0 引言
【研究意义】当前,抗生素作为饲料添加剂广泛用于促进动物生长及疾病预防,而动物相关产品及制品中抗生素残留以及细菌耐药性问题日趋严峻并亟需解决[1]。因此,抗生素替代品的开发备受关注。益生菌是一类对宿主有益的活性微生物,不存在耐药性或残留的问题。在众多的益生菌产品中,最为常见的是乳酸菌,它能够利用碳水化合物发酵产生乳酸,是人体和哺乳动物肠道微生物的主要组成部分,对宿主的健康有着重要的促进作用,国家食品药品监督局将其评定为食品安全级的菌株[2]。【前人研究进展】乳酸菌具有广泛的益生作用,例如改善消化功能,增强机体免疫水平,缓解炎症性肠病和便秘,增强黏膜屏障作用等。乳酸菌作为益生菌不但有利于宿主的健康,一些乳酸菌分离株甚至具有抗癌或治疗糖尿病的效用[3-7]。为了发挥良好的益生效果,乳酸菌在胃肠道的转运过程中必须保持高水平的存活效率和定植能力[8]。因此,乳酸菌对酸性环境的抵抗力、对胆盐的适应浓度以及对肠上皮细胞的黏附特性等是评价其免疫调节功能的重要指标。【本研究切入点】目前,从乳制品、泡菜等食品和禽类、鱼等动物体内分离益生菌的研究较多,而对于从野猪中分离益生菌的研究鲜有报道。【拟解决的关键问题】本研究以大兴安岭野猪粪便中的乳酸菌株为研究对象,对其进行分离与鉴定,进一步评价了其对pH和胆盐的耐受能力、黏附能力、凝集能力和抑菌特性,同时评估了其安全性,以期筛选出安全且具有良好特性的乳酸菌,为进一步应用于饲料添加剂等动物相关产品奠定基础。
1 材料与方法
1.1 主要材料
1.1.1 样品来源 2018年6月从黑龙江大兴安岭地区采集野猪粪便样品13份,用无菌棉签小心地拨开粪便,再用新的无菌棉签从粪便内部轻轻蘸取少许,收集于50 mL无菌离心管,编号后置于4℃保温箱迅速运回实验室。
1.1.2 菌株、细胞和试验动物 标准致病菌株主要用于抑菌试验和共凝集试验,包括致病性埃希氏大肠杆菌(BNCC 337304)、金黄色葡萄球菌(ATCC 6538P)及鼠伤寒沙门氏菌(ATCC 14028)。模式菌株嗜酸乳杆菌(ATCC 4356)用于比较乳酸菌菌株的黏附能力和溶血性分析。结肠腺癌细胞Caco-2(BNCC 338148)使用含20%血清的MEM培养基,猪小肠上皮细胞IPEC-J2(BNCC 338252)使用含10%血清的DMEM培养基,在37℃ 5% CO2条件下培养,用于乳酸菌黏附试验。以上菌株及细胞均由兽医生物技术国家重点实验室保存。20只7周龄的雌性BALB/c小鼠购自辽宁长生生物技术有限公司,用于乳酸菌的体内安全性评价。
1.1.3 主要试剂 MRS培养基购自青岛高科园海博生物技术有限公司。细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。异硫氰酸荧光素(fluorescein isothiocyanate, FITC)购自哈尔滨宝士德生物科技有限公司。MEM培养基、DMEM培养基、胎牛血清(FBS)及0.25%胰酶购自Gibco公司。
1.2 乳酸菌的分离与鉴定
从大兴安岭采集野猪粪便,每管粪便样本中加入约5倍体积的MRS培养基,充分振荡混匀,分别取1 mL转接至8 mL MRS培养基中,于37℃温箱厌氧培养24 h,分别取微量过夜培养的菌液,在MRS固体培养基上进行划线,置于37℃温箱中厌氧培养24 h。挑取特征明显的菌落反复划线分离,直至分离出形态、大小一致的菌落,进行革兰氏染色。对菌体形态进行显微观察,确定为单一的革兰氏阳性菌后,使用细菌基因组DNA提取试剂盒提取分离菌株的基因组DNA。利用细菌16S rDNA通用引物进行扩增(表1),PCR反应程序为:95℃5 min;95℃ 45 s,50℃ 1 min,72℃ 90 s,共10个循环;95℃ 45 s,58℃ 1 min和72℃ 90 s,共15个循环;95℃ 45 s,55℃ 1 min和72℃ 90 s,共10个循环;72℃延伸10 min。扩增片段测序后,使用BLAST与GenBank数据库中序列进行对比分析。
将分离的乳酸菌在酸性(pH 3.0)和胆盐(0.3%)条件下评价其耐受性[9],将过夜培养的菌液接种于5 mL pH 3.0的MRS和含0.3%胆盐的MRS培养基中,37℃孵育4 h,测定其OD600nm值,筛选出具备较强耐酸、耐胆盐特性的菌株用于后续试验。
1.3 乳酸菌的自凝集能力测定
按照Collado等[10]的方法稍作改进后进行乳酸菌的自凝集能力检测:将分离的乳酸菌转接于5 mL MRS培养基中,37℃温箱中静置培养18 h。以5 000×离心10 min收集菌体,PBS洗涤2次后将其重悬于2 mL PBS中,调节OD600nm为0.25 ± 0.05,室温条件下静置,在不同时间点(0、2、4、6、10和24 h)分别取100 μL上层悬液测定其OD600nm。乳酸菌的自凝集率AA(%)计算公式如下:AA(%)= [(A0− At)/A0]×100。其中,A0是0 h测定的乳酸菌悬液OD600nm值;At是静置后不同时间点测定的OD600nm值。
1.4 乳酸菌与致病菌的共凝集能力测定
对乳酸菌进行共凝集能力检测,方法如下[11]:取乳酸菌悬液2 mL(OD600nm= 0.25 ± 0.05)分别与3株标准致病菌株等体积混合,室温静置,在不同时间点(0、2、4、6、10和24 h)分别取100 μL上层悬液测定其OD600nm。根据如下公式计算乳酸菌与致病菌的共凝集率AC(%):AC(%)= [(Apro+Apat)-Amix]/ (Apro+Apat)×100。其中,Apro+Apat代表0 h混合悬液的OD600nm值;Amix是不同时间点测定的OD600nm值。
1.5 乳酸菌的黏附能力测定
将Caco-2细胞和IPEC-J2细胞分别接种于24孔板,待其贴壁生长至80%—90%时进行黏附试验。将过夜培养的乳酸菌以5 000×离心10 min收集菌体,PBS洗涤2次,将其以108CFU/mL重悬于PBS(含100 μg·mL-1FITC)中,37℃避光孵育1 h将细菌着色,随后PBS洗涤3次除去未结合的FITC,重悬于PBS中。用PBS将细胞洗涤3次,每孔加入500 μL FITC标记的菌悬液,使用多功能酶标仪测定其初始荧光强度(吸收光波长为485 nm,发射光波长为530 nm),将24孔板置于37℃、5% CO2的培养箱中孵育1 h。PBS洗涤24孔板3次,去除未黏附的乳酸菌,加入100 μL 0.25%的胰酶作用10 min后,再加入400 μL含20% FBS的培养基终止反应,使用酶标仪测定其荧光强度[12]。按照如下公式计算:黏附率(%)= C/C0×100。其中,C0代表乳酸菌黏附前的荧光强度,C代表乳酸菌黏附后的荧光强度。
1.6 乳酸菌的抑菌能力测定
按照Bhola等[13]的方法进行乳酸菌的抑菌能力测定。先将灭菌的牛津杯平放在底层MRS固体培养基上,将指示菌按1%接种于45—50℃的MRS固体培养基中,混匀后倒入放置好牛津杯的培养皿中,待其凝固后取出牛津杯,在杯孔中加入过夜培养的待测乳酸菌培养液,每孔100 μL,37℃温箱培养24 h后,使用游标卡尺测量抑菌环大小。
1.7 乳酸菌的安全性评价
将过夜培养的模式菌株嗜酸乳杆菌、金黄色葡萄球菌和3株乳酸菌菌株在血平板上划线,37℃厌氧孵育18—24 h,观察细菌菌落周围是否形成溶菌环。根据文献中已报道的毒力因子基因在NCBI上查找相关序列送至南京金斯瑞生物科技有限公司进行基因合成,同时设计相应引物(表1),以合成基因作为阳性对照,对分离菌株进行PCR扩增,检测是否存在毒力因子的编码基因,进行分离菌株的体外安全性评价[14-18]。

表1 PCR扩增引物
过夜培养的M6-5、M2-38和M6-27菌株以5 000×离心10 min收集菌体,将其以1010CFU/mL重悬于PBS。7周龄的BALB/c小鼠随机分为4组,每组5只,分别将上述3种细菌悬液和PBS连续饲喂21 d,100 μL·d-1。测定小鼠的初始体重以及饲喂7、14和21 d的体重,计算体重变化情况;连续饲喂结束后,解剖获取小鼠的脾脏、肝脏和肾脏按照如下公式计算器官指数:器官指数=器官重量/小鼠体重,对乳酸菌菌株进行体内安全性评价[19]。
1.8 统计学分析
采用SPSS 22统计软件分析试验数据,<0.05表示差异显著,所有试验设置3个重复,数值以平均数±标准差表示。
2 结果
2.1 乳酸菌分离株的分类
从野猪粪便样品中分离的细菌通过在MRS固体培养基反复纯化后,经革兰氏染色证明分离的菌株均为的革兰氏阳性菌(结果未显示)。耐酸、耐胆盐试验结果显示,其中有3株乳酸菌显示出一定程度的耐受性,在酸性和含胆盐的MRS培养基中存活率能达到50%—80%以上不等,其中M6-27菌株具备最为优良的耐酸、耐胆盐特性,在pH 3.0时存活率高达70.47%,胆盐浓度0.3%时存活率达80%以上。经16S rDNA鉴定,此3株乳菌分别为蒙氏肠球菌(M6-5)、耐久肠球菌(M2-38)和黏膜乳杆菌(M6-27)(表2)。
2.2 乳酸菌的自凝集能力与致病菌的共凝集能力
对分离的3株乳酸菌进行自凝集能力检测,结果如图1所示,随着时间的推移,3株乳酸菌的自凝集率稳步上升,其中,M6-27和M2-38菌株具有较强的自凝集能力,静置24 h后其自凝集率高达70%以上,明显高于M6-5菌株,而M6-5在静置24 h后凝集率也达到了50%(图1-A)。

表2 三株乳酸菌的种属鉴定及耐酸、耐胆盐特性
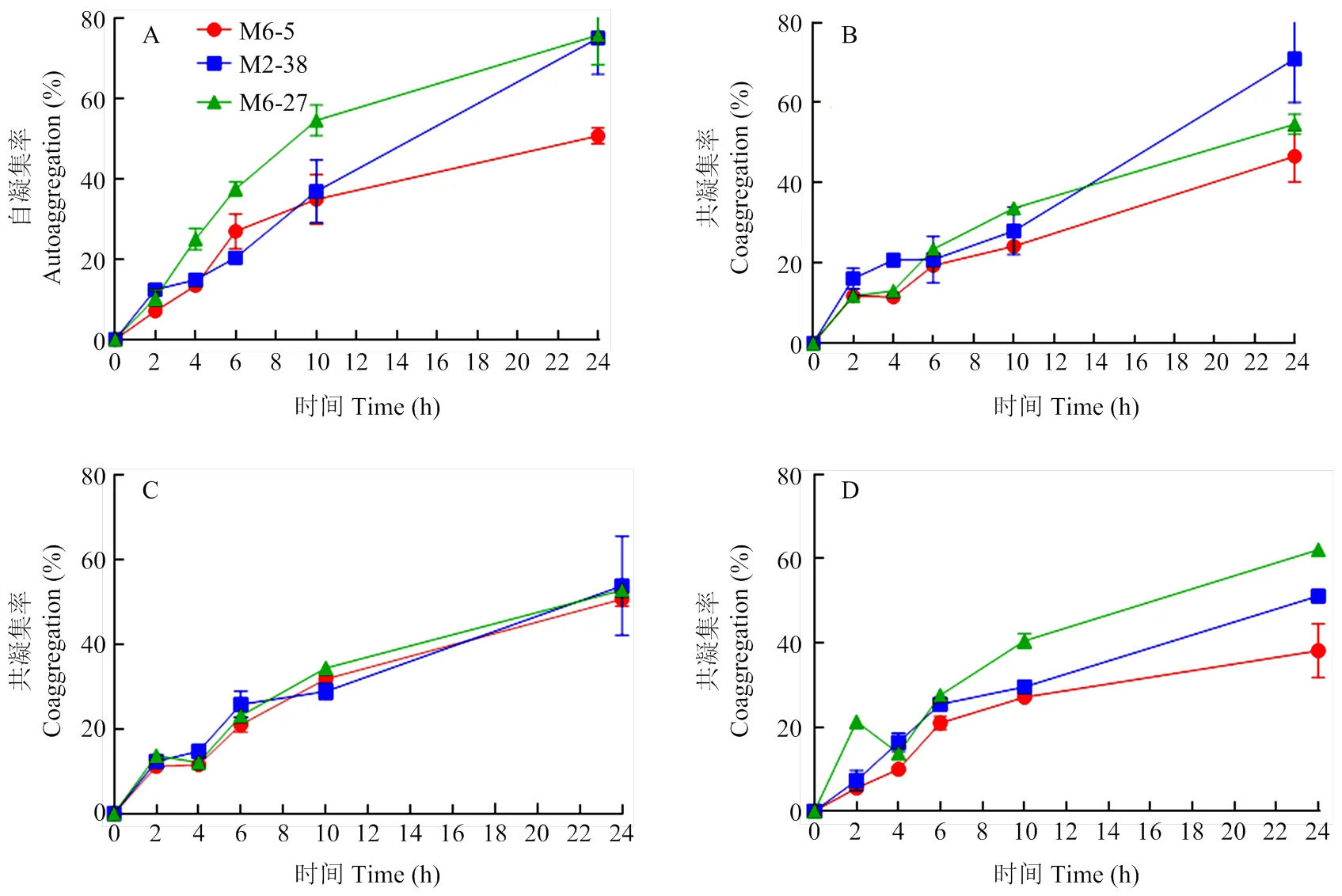
A:3株乳酸菌自凝集能力;B-D:3株乳酸菌与致病性埃希氏大肠杆菌、金黄色葡萄球菌及鼠伤寒沙门氏菌共凝集能力
共凝集能力检测结果显示,分离的乳酸菌菌株均能凝集致病性埃希氏大肠杆菌、金黄色葡萄球菌和鼠伤寒沙门氏菌3种致病菌。其中M2-38凝集致病性埃希氏大肠杆菌能力最强,可达到70%以上(图1-B)。3株乳酸菌凝集金黄色葡萄球菌的能力接近,凝集率均在50%左右(图1-C)。3株乳酸菌凝集鼠伤寒沙门氏菌的能力有所不同,其中M6-27凝集能力最强,可达60%;M2-38次之,凝集率接近50%;M6-5凝集能力最弱,只有不到40%(图1-D)。
2.3 乳酸菌的黏附能力
黏附试验结果显示,3株乳酸菌菌株对Caco-2细胞的黏附率均达到50%以上,其中,M6-27菌株黏附率最高,可达72%,显著高于模式菌株ATCC 4356(<0.05);另外,2株M2-38和M6-5菌株黏附率分别为63%和56%,其中M2-38也显著高于ATCC 4356菌株(<0.05)(图2-A),结果表明,2株乳酸菌菌株M6-27和M2-38均具有较强的黏附能力。图2-B显示,3株乳酸菌菌株对IPEC-J2细胞的黏附能力极显著高于参考菌株(<0.001),其中乳酸菌菌株M6-27的黏附能力最高,可达77%。
2.4 乳酸菌的抑菌能力
乳酸菌体外抑菌试验结果显示,3株乳酸菌均对鼠伤寒沙门氏菌有抑制作用,其中M6-27菌株抑菌能力最强,抑菌环直径为(13.61 ± 0.27)mm;M6-5和M6-27菌株对致病性埃希氏大肠杆菌有抑制作用,而只有M6-27菌株对金黄色葡萄球菌有抑制作用(表3)。以上结果表明,本研究筛选的3株乳酸菌抑菌能力不尽相同,M6-27菌株对3种致病菌均具有较强的抑菌活性。
2.5 乳酸菌的安全性
溶血性试验结果显示,金黄色葡萄球菌(ATCC 6538P)划线的血平板上菌落周围形成完全透明的溶血环(β型溶血),模式菌株嗜酸乳杆菌(ATCC 4356)和3株乳酸菌菌株划线的血平板上菌落周围无溶血现象,表明3株乳酸菌均无溶血性(图3)。食物来源的肠球菌存在单一或多重毒力因子,尽管其在益生性肠球菌中的发生率较低,另外,也有关于乳杆菌中存在毒力因子的报导,因此仍需对本试验中分离的两株肠球菌和一株黏膜乳杆菌进行毒力因子的分析,以评估其安全性。在本研究中,以乳酸菌分离株基因组DNA为模板,使用多对毒力因子相应引物进行PCR扩增,均未检测到毒力因子(图4)。
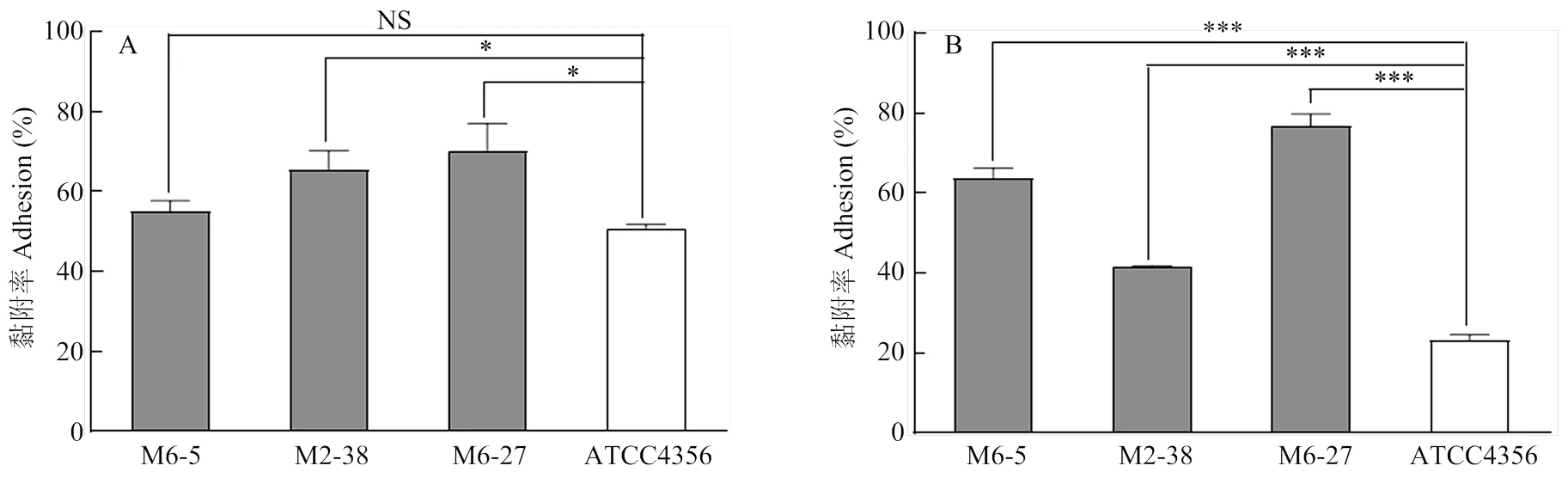
NS: not significant; *:<0.05; ***:<0.001
A:3株乳酸菌对Caco-2的黏附能力;B:3株乳酸菌对IPEC-J2的黏附能力
A: Adhesion ability of the three strains of lactic acid bacteria to Caco-2 cells;B: Adhesion ability of the three strains of lactic acid bacteria to IPEC-J2 cells
图2 3株乳酸菌黏附能力
Fig. 2 The adhesion ability of three lactic acid bacteria

表3 3株乳酸菌对致病菌的抑制能力
—表示乳酸菌株对致病菌未产生抑制作用Indicated there is no inhibition activity of LAB against pathogenic bacteria

A:M2-38;B:M6-5;C:M6-27;D:阴性对照:嗜酸乳杆菌(ATCC 4356);E:阳性对照:金黄色葡萄球菌(ATCC 6538P)

M:DL2000 Marker;1-3、6-8、11-13和16-18:扩增gelE、ebp、espA、agg基因片段;4、9、14和19:阳性对照;5、10、15和20:阴性对照
与对照组相比,连续饲喂乳酸菌菌株的各组小鼠在第7、14天的体重增加比例无显著性差异(结果未显示)。在第21天,黏膜乳杆菌M6-27饲喂小鼠的体重增加百分率与对照组相比差异极显著(<0.01)(图5-A)。此外,小鼠脾脏(图5-B)、肝脏(图5-C)和肾脏(图5-D)的器官指数在各小组间无显著差异。

NS: not significant; **:<0.01
A:3株乳酸菌对小鼠体重的影响;B-D:三株乳酸菌对小鼠脾脏、肝脏、肾脏指数的影响
A: Effect of probiotic supplementation on body weight gain of mice; B-D: The indices analysis of spleen, liver, and kidney in all the experimental groups
图5 乳酸菌在小鼠体内的安全性评价
Fig. 5 Safety evaluation of lactic acid bacteria in mice
3 讨论
野猪,也称“山猪”,属于偶蹄目猪科猪属。与家猪相比,野猪体躯健硕、野性凶猛、抗逆性强。野猪为杂食性动物,主要以植物、种子、菌类、果实、昆虫及小型脊椎动物为食,其饮食习惯、活动模式等也与统一化饲喂的家猪不同,因此,长期的进化导致二者肠道正常菌群组成也不尽相同。目前,关于家猪体内益生菌分离鉴定的报导较为常见,而少有研究从野猪体内进行益生菌的分离,因此本研究选择对野猪粪便样本进行采集与益生菌的分离鉴定。大兴安岭地区位于黑龙江省西北部、内蒙古自治区东北部、大兴安岭山脉东北坡,是中国最北端的地级行政区,土地面积占全省51.8%,地广人稀,是黑龙江野生动物的主要活动基地[20]。大兴安岭地区野猪资源丰富,野猪生长活动于此,人为污染少,常见病原感染少,有望能够分离出天然、具备优良特性的益生菌株。
益生菌在改善肠道功能和提高动物生产性能等方面发挥着重要作用。乳酸菌作为最为常见的益生菌,可以通过平衡肠道菌群维持宿主的肠道健康,甚至治疗人类和动物的肠道疾病[21]。同时,研究证实,益生菌作为饲料添加剂对不同生长期猪都能产生积极作用,比如改善动物健康和性能[22]。
为了获得具有优良特性的乳酸菌株,必须对其基本功能特性和安全性进行评价。因为胃中的酸性条件和十二指肠的胆盐是益生菌在胃肠道生存的最大障碍,所以在胃肠道定植的首要条件是拥有对低pH和胆盐的抵抗力[23-24]。不同菌株在酸性和胆盐条件下的存活率不同,可能是由于其对酸性和胆盐的耐受性机制不同所致[25]。在本研究中,我们筛选了3株不同的乳酸菌株,均具有较强的耐酸、耐胆盐能力。
黏附是乳酸菌有效地定植于肠上皮细胞表面、发挥益生作用的前提条件,因此黏附能力是评价益生菌的一个非常重要的指标[25-26]。益生菌的自凝集和共凝集能力在防止病原体表面定植方面发挥着重要作用。研究表明,聚集的益生菌能够形成覆盖肠道黏膜表面的物理屏障,防止病原体的定植,而益生菌与致病菌结合是宿主抵御感染的重要防御机制[27-29]。本研究中分离的乳酸菌株中,M6-27菌株具有较强的自凝集和共凝集致病菌的能力,同时可以抑制3种致病菌的活性。
通过比较分析3株乳酸菌的凝集能力、黏附特性和抗菌特性发现,每株益生菌各有特点,这可能与其生活环境、产生不同的副产物、生物特性以及其他因素等有关,但综合看来,M6-27各方面特性均较为优良。已有研究表明,部分益生菌株可能具有抗病毒和抗癌活性[30-31]。因此,深入探索3株益生菌的抗癌和抗病毒活性具有重要意义。
乳酸菌在乳制品、肉制品、泡菜和青贮饲料以及益生菌制品发酵中被广泛使用,具有悠久的历史,大部分乳酸菌被公认为安全级。但考虑到本研究中分离乳酸菌的目的是进一步作为饲料添加剂使用,因此,对其可能携带的毒力基因进行检测是十分必要的。在本研究中,分离得到的3株乳酸菌均无溶血性和毒力因子。同时,将乳酸菌连续饲喂小鼠后,对小鼠健康未产生任何不良影响,而饲喂黏膜乳杆菌(M6-27)的小鼠体重显著增加,表明这株乳酸菌在一定程度上能够提高生长性能,有望用于动物饲料添加剂的开发。
4 结论
从大兴安岭野猪粪便中分离得到3株乳酸菌,经16S rDNA鉴定,此3株乳酸菌分别为蒙氏肠球菌、耐久肠球菌和黏膜乳杆菌,在酸性和含胆盐培养基中存活能力较强。其中黏膜乳杆菌具备良好的黏附能力和凝集能力,并且能够抑制3种致病菌的生长,具有较强的抑菌活性,而连续饲喂21 d黏膜乳杆菌可显著增加小鼠体重,表明其具备良好的益生特性。后期将对黏膜乳杆菌的免疫调节活性、体内抑菌能力等进行进一步研究,使其能更好的作为益生制剂应用于饲料添加剂等动物相关产品中。
[1] Arena M P, Capozzi V, Russo P, Drider D, Spano G, Fiocco D. Immunobiosis and probiosis: antimicrobial activity of lactic acid bacteria with a focus on their antiviral and antifungal properties., 2018, 102(23): 9949-9958.
[2] Tan E W, Tan K Y, Phang L V, Kumar P V, In LLA. Enhanced gastrointestinal survivability of recombinantusing a double coated mucoadhesive film approach., 2019, 14(7): e0219912.
[3] Jäger R, Purpura M, Farmer S, Cash H A, Keller D.ProbioticGBI-30, 6086 improves protein absorption and utilization., 2018, 10(4): 611-615.
[4] Miller L E, Ouwehand A C, Ibarra A.Effects of probiotic- containing products on stool frequency and intestinal transit in constipated adults: systematic review and meta-analysis of randomized controlled trials., 2017, 30(6): 629-639.
[5] Alard J, Peucelle V, Boutillier D, Breton J, Kuylle S, Pot B, Holowacz S, Grangette C. New probiotic strains for inflammatory bowel disease management identified by combiningandapproaches., 2018, 9(2): 317-331.
[6] Lakritz J R, Poutahidis T, Levkovich T, Varian B J, Ibrahim Y M, Chatzigiagkos A, Mirabal S, Alm E J, Erdman S E. Beneficial bacteria stimulate host immune cells to counteract dietary and genetic predisposition to mammary cancer in mice., 2014, 135(3): 529-540.
[7] Niibo M, Shirouchi B, Umegatani M, Morita Y, Ogawa A, Sakai F, Kadooka Y, Sato M. ProbioticSBT2055 improves insulin secretion in a diabetic rat model., 2019, 102(2): 997-1006.
[8] Aristimuno Ficoseco C, Mansilla F I, Maldonado N C, Miranda H, Fatima Nader-Macias M E, Vignolo G M. Safety and growth optimization of lactic acid bacteria isolated from feedlot cattle for probiotic formula design., 2018, 9: 2220.
[9] Dowarah R, Verma A K, Agarwal N, Singh P, Singh B R. Selection and characterization of probiotic lactic acid bacteria and its impact on growth, nutrient digestibility, health and antioxidant status in weaned piglets., 2018, 13(3): e0192978.
[10] Collado M C, Surono I, Meriluoto J, Salminen S. Indigenous dadih lactic acid bacteria: cell-surface properties and interactions with pathogens., 2007, 72(3): M89-93.
[11] Maria Carmen Collado, Jussi Meriluoto, Seppo Salminen. Adhesion and aggregation properties of probiotic and pathogen strains., 2008, 226: 1065-1073.
[12] Dowdell P, Chankhamhaengdecha S, Panbangred W, Janvilisri T, Aroonnual A. Probiotic activity ofandisolated from Thai fermented sausages and their protective effect against., 2019, 12(2): 641-648.
[13] Rahmeh R, Akbar A, Kishk M, Al-Onaizi T, Al-Azmi A, Al-Shatti A, Shajan A, Al-Mutairi S, Akbar B. Distribution and antimicrobial activity of lactic acid bacteria from raw camel milk., 2019, 30: 100560.
[14] Aristimuño Ficoseco C, Mansilla F I, Maldonado N C, Miranda H, Fátima Nader-Macias ME, Vignolo G M. Safety and growth optimization of lactic acid bacteria isolated from feedlot cattle for probiotic formula design., 2018, 9: 2220.
[15] Nami Y, Vaseghi Bakhshayesh R, Mohammadzadeh Jalaly H, Lotfi H, Eslami S, Hejazi M A. Probiotic properties ofisolated from artisanal dairy products., 2019, 10: 300.
[16] Al-Talib H, Zuraina N, Kamarudin B, Yean C Y.Genotypic variations of virulent genes inandisolated from three hospitals in Malaysia., 2015, 24: 121-127.
[17] Šeme H, Gjuračić K, Kos B, Fujs Š, Štempelj M, Petković H, Šušković J, Bogovič Matijašić B, Kosec G.Acid resistance and response to pH-induced stress in twostrains with probiotic potential., 2015, 6: 369-379.
[18] Koirala R, Taverniti V, Balzaretti S, Ricci G, Fortina M G, Guglielmetti S. Melting curve analysis of aPCR fragment for the rapid genotyping of strains belonging to thegroup of species., 2015, 173: 50-58.
[19] Li A, Wang Y, Li Z, Qamar H, Mehmood K, Zhang L, Liu J, Zhang H, Li J. Probiotics isolated from yaks improves the growth performance, antioxidant activity, and cytokines related to immunity and inflammation in mice., 2019, 18: 112.
[20] 郭玉荣, 王利利, 金煜. 大兴安岭地区野生动物养殖业的机遇、挑战与应对措施. 野生动物杂志, 2006, 27(5): 29-31.
Guo Y R, Wang L L, Jin Y. Opportunity, Challenge and Countermeasure of wildlife farming in Greater Khingan Mountains., 2006, 27(5): 29-31. (in Chinese)
[21] Nami Y, Haghshenas B, Haghshenas M, Yari Khosroushahi A. Antimicrobial activity and the presence of virulence factors and bacteriocin structural genes inCM33 isolated from ewe colostrum., 2015, 6: 782.
[22] Wang W, Ganzle M. Toward rational selection criteria for selection of probiotics in pigs., 2019, 107: 83-112.
[23] Hsu T C, Yi P J, Lee T Y, Liu J R. Probiotic characteristics and zearalenone-removal ability of astrain., 2018, 13(4), e0194866.
[24] Sharma K, Attri S, Goel G. Selection and evaluation of probiotic and functional characteristics of autochthonous lactic acid bacteria isolated from fermented wheat flour dough babroo., 2019, 11(3):774-784.
[25] Zhang W, Liu M, Dai X. Biological characteristics and probiotic effect ofstrain isolated from the intestine of black porgy fish., 2013, 44(3): 685-691.
[26] Jose N M, Bunt C R, Hussain M A. Comparison of microbiological and probiotic characteristics ofisolates from dairy food products and animal rumen contents., 2015, 3(2): 198-212.
[27] Iniguez-Palomares C, Jimenez-Flores R, Vazquez- Moreno L, Ramos-Clamont-Montfort G, Acedo-Felix E. Protein-carbohydrate interactions betweenand pig mucins., 2011, 89(10): 3125-3131.
[28] Arques J L, Rodriguez E, Langa S, Landete J M, Medina M. Antimicrobial activity of lactic acid bacteria in dairy products and gut: effect on pathogens., 2015, 2015: 584183.
[29] CAMPANA R, VAN HEMERT S, BAFFONE W. Strain-specific probiotic properties of lactic acid bacteria and their interference with human intestinal pathogens invasion., 2017, 9, 12.
[30] KAUR M, SINGH H, JANGRA M, KAUR L, JASWAL P, DUREJA C, NANDANWAR H, CHAUDHURI S R, RAJE M, MISHRA S, PINNAKA A K. Lactic acid bacteria isolated from yak milk show probiotic potential., 2017, 101(20): 7635-7652.
[31] Drider D, Bendali F, Naghmouchi K, Chikindas M L. Bacteriocins: not only antibacterial agents., 2016, 8(4): 177-182.
Identification and Properties of Lactic Acid Bacteria Isolated from Wild Boar Feces
WANG Yi, LI Miao, LI YongFeng, SUN Yuan, QIU HuaJi
(State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069)
【】In order to screen safe lactic acid bacteria (LAB) strains with probiotic properties, LAB were isolated in this study for further developing probiotics and providing resources for animal related products such as feed additives.【】A total of 13 samples of wild boar feces were collected from Greater Khingan Mountains in China, and the samples were quickly returned to the laboratory at 4°C for isolation and purification of LAB. The genomic DNA of the isolated Gram-positive bacteria was extracted by bacterial genomic DNA extraction kit. After 16s rDNA identification, the sequence was compared with information in GenBank database using BLAST, and the classification status of each strain was determined. The tolerance capacity of LAB was evaluated under acidic pH condition (pH 3.0) and bile salt (0.3%). The LAB was cultured overnight, observed and determined at different time, and then the autoaggregation ability was evaluated. The strains cultured overnight were mixed with,andat room temperature for coaggregation test., the adhesion ability of LAB to Caco-2 cells and IPEC-J2 cells was measured and evaluated. The anti-pathogenic activities were detected by measuring the bacterial inhibition rings on plates of LAB against,, and. Evaluation of the safety of LAB strains byandtests. LAB isolates were cultured in MRS medium for 18–24 h at 37℃. Streak plate methods were performed on sheep blood agar plates to analyze hemolytic activity. The absence/presence of virulence factor genes for the isolated strains was performed using PCR amplification with primers. After 21 days of continuous LAB supplementation, the parameters of general health status including body weight gain and organ index were calculated to assess the safety of the LAB. 【】Three LAB strains isolated from wild boar feces were,, and, with the excellent tolerance to acid and bile salt. The results showed that these three strains showed strong adhesion and aggregation ability, and the antimicrobial effect ofon the three pathogenic bacteria was better than others. The result of safety evaluation demonstrated that these strains were free of hemolytic activity, and no virulence genes could be detected. The percentage of body weight gain of the mice treated withwas significantly higher (<0.01) than that of the control mice on day 21. 【】Taken together, the results indicated that three probiotic strains, especially, had good probiotic properties and safety, so this study provided a scientific basis for further development of probiotic preparations.
wild boar; lactic acid bacteria; aggregation; adhesion ability; safety

10.3864/j.issn.0578-1752.2020.14.019
2019-08-27;
2020-02-19
国家自然科学基金(31802169)、中国博士后科学基金(2018M641565)
王翌,E-mail:ywwhitewhy@163.com。通信作者孙元,E-mail:sy0604@126.com。通信作者仇华吉,E-mail:qiuhuaji@caas.cn
(责任编辑 林鉴非)
