武汉东湖夏冬两季浮游动物物种多样性及群落结构研究
2020-08-07王雨路袁丹妮袁国庆冯伟松龚迎春
王雨路 袁丹妮 袁国庆 冯伟松 龚迎春
(1.武汉大学生命科学学院,武汉 430072;2.中国科学院水生生物研究所,武汉 430072;3.武汉生物工程学院,武汉 430415)
浮游动物在自然水体中具有极为重要的生态功能。作为初级消费者,浮游动物以浮游植物、细菌及残渣碎屑为能量来源,自身可被滤食性鱼类和虾蟹摄食,在能量流动和物质循环的生态过程中具有承上启下的作用[1]。浮游动物个体小、寿命短、对环境变化敏感、抗逆性相对较差,所以种群数量和群落结构往往随环境变动发生较大变化[2]。因此,根据浮游动物群落结构反映当前水体环境状况,成为水质检测的重要手段[1]。
武汉东湖(30°33′N,114°23′E)是一个位于长江中下游的中型浅水湖泊,总面积约为32 km2,全湖平均深度约为2.5 m,年均水温18.6℃[3]。东湖为我国第二大城中湖,在观光、养殖、农灌以及调节净化生态环境等方面发挥重要作用[4]。20世纪以来,由于经济的快速发展以及人类高强度的生产生活等使东湖水体受到严重污染,水体环境遭到极大程度的破坏,成为富营养型湖泊[5,6]。近年来,在湖北省政府的高度重视下,东湖水质污染情况已有所改善[7]。虽然东湖水质已由劣V类转为IV类,但是仍为富营养型湖泊。因此,关注东湖水体及浮游生物组成特征依然至关重要。
由于武汉东湖所处位置的重要性及特殊性,从20世纪50年代开始,人们着手研究东湖水生生物生境状况,积累了许多有价值的资料[5]。之前的研究报道多关注于东湖渔业资源或水质变化与浮游动物群落结构之间的相关性[6,8—12],根据一些经典的著作进行物种鉴定进而阐述浮游动物丰度与生物量的变化情况[13—16],而缺乏对浮游动物重要特征的图像记录以及物种分子序列信息的确定,降低了物种鉴定信息的可参考性,增加了不同水体间各浮游动物物种信息交流的阻碍强度,也增大了对浮游动物生态学鉴定的难度。
本论文将以东湖主湖郭郑湖及水果湖的沿岸带为研究主体,通过对夏冬两季(7 月、8 月、12月、1月)水体中浮游动物组成与群落结构特征的分析与研究,结合环境因子调查,总结东湖在夏冬两季浮游动物群落结构的变化规律及群落结构对环境因子变化的响应,提供东湖水体中的浮游动物图像信息和分子序列信息(18S rRNA)。望以此为东湖水体环境监测与水质保护提供科学依据,并为自然水体中浮游动物的鉴定与研究提供具体、形象的参考资料。
1 材料与方法
1.1 采样点设置及环境因子测定
于2018年7月、8月、12月和2019年1月对东湖浮游动物物种组成及群落结构特征进行调查研究,采样点设置在东湖主湖郭郑湖及水果湖湾沿岸带,共设置4个采样点: S1(30°32′13″N,114°22′20″E)、S2(30°32′52″N,114°23′55″E)、S3(30°34′17″N,114°23′10″E)、S4(30°32′54″N,114°21′4″E),采样点具体信息如图1。每次采样时间在上午8:00—12:00,每周进行一次生物样品采集。用水质分析仪(YSI Professional Plus,美国)现场测定水温、pH、盐度、溶解氧和ORP(氧化还原电位)。
1.2 浮游动物样品采集与处理
浮游动物定性样品以25号浮游生物网(孔径64 μm)在表层水面下抛网收集,“Z”字形拖拽,将滤取的样品收集至50 mL采样瓶中,4 ℃保存。同时采集采样点周围岩石上的附着物,并添加一定量原位水保存,以作为浮游动物物种定性分析的补充。浮游动物定量样品的采集方法因生物个体大小的不同而有所差异。其中,轮虫定量样品以25号浮游生物网过滤2 L水样,浓缩至50 mL采样瓶中,现场用甲醛溶液固定保存(终浓度为4%)[17];甲壳类定量样品以13号浮游生物网过滤10 L水样,浓缩至50 mL采样瓶中,现场用甲醛溶液固定保存(终浓度为4%)[18]。

图1 武汉东湖浮游动物采样点分布示意图Fig.1 The diagram of zooplankton sampling stations in the East Lake in Wuhan
1.3 浮游动物的鉴定
在解剖显微镜(OLYMPUS SZX7,日本)或倒置显微镜(OLYMPUS CKX41,日本)下挑取活体样品中浮游动物的纯物种个体,并利用正置荧光显微镜(OLYMPUS BX53,日本)进行物种图片采集,轮虫主要参照《Rotatoria》[13]和《中国淡水轮虫志》[14],枝角类和桡足类主要参考《中国动物志(淡水枝角类)》[15]和《中国动物志(淡水桡足类)》[16]等相关资料描述进行物种鉴定。对于东湖水体中浮游动物常见物种,在解剖显微镜下挑取一定数量(大约20只)的纯物种个体于1.5 mL 灭菌EP管中,-20℃保存,以便后续的DNA提取及序列测定。
1.4 DNA提取与SSU rRNA基因测序
针对常见浮游动物类群,尽量获得其SSU rRNA基因序列信息。浮游动物DNA提取和PCR产物回收等操作分别参照DNeasy Blood&Tissue Kit试剂盒(Qiagen,德国)、OMEGA Gel Extraction Kit试剂盒(Omega,美国)的说明进行。以挑取的浮游动物基因组DNA为模板,采用真核生物通用引物SSU rRNA-F(5′-AACCTGGTTGATCCTGCCAGT-3′)和SSU rRNA-R(5′-TGATCCTTCTGCAGGTTCACC TAC-3′)进行PCR扩增[19]。PCR反应扩增体积为20 μL,其中2×GoTaqGreen Master Mix(Promega,美国)10 μL,DMSO 1 μL,每种引物(10 μmol/L)0.5 μL,模板DNA 8 μL。PCR反应条件为: 94℃预变性10min,94℃变性30s,48℃退火1min 30s,72℃延伸2min 30s,进行5个循环,然后94℃变性30s,48℃退火1min 30s,72℃延伸2min 30s,进行30个循环,最后再72℃延伸10min。将扩增获得的DNA保守片段与pGEM-T vector(Promega,美国)连接并转化入感受态大肠杆菌(DH5α)中,并进行蓝白斑检验,挑选阳性克隆的菌落,选用M13通用引物(M13-F: 5′-TTCCCAAGGAAAACCCT-3′;M13-R: 5′-CAG GAAACAGCTATGAC-3′)[20]进行菌落PCR,最后将阳性菌液送往武汉天一辉远公司进行序列测定。获得的基因序列上传至GenBank。
1.5 浮游动物群落结构特征分析
在OLYMPUS正置显微镜(CX-31)下,用1 mL和5 mL的浮游生物计数框分别进行轮虫和甲壳类的定量计数工作,每个样品计数两次,其浮游动物最终丰度由以下公式确定:式中,N指1 mL水中浮游动物个体数(ind./mL),N1与N2分别为两次计数个体数,Vj为计数框体积(mL)。

利用优势度Y指示浮游动物的出现频率和种群数量,以确定优势种,并且当Y≥0.02时确定为优势种:

式中,ni为浮游动物第i种的密度,N为物种总丰度值,fi为第i种的出现频率。
群落的丰富度采用Margalef指数(d)表示,按公式(3)计算:

式中,S为浮游动物物种总数,N为浮游动物总丰度值。
群落的多样性用Shannon-Weiner指数(H′)和Simpson多样性指数(D)表示,分别按公式(4)和(5)计算:

式中,S代表浮游动物物种总数;ni代表第i种的密度;N为浮游动物总丰度值。
群落的均匀度用Pielou指数(J)表示,计算按公式(6):

式中,H′为Shannon-weiner指数;S为浮游动物物种总数。
1.6 数据分析
物种丰度数据展示采用Origin8.5软件进行作图。利用Canoco5.0软件对各采样点水质数据(水温、pH、含氧量、盐度、ORP)与浮游动物群落结构进行冗余分析(Redundancy analysis,RDA)。
2 结果
2.1 浮游动物种类组成及优势种变化
通过定性样品观察,共发现浮游动物50种,其中轮虫22属37种、枝角类10属10种、桡足类3属3种(表1),并对大部分物种进行了图片展示(图版I—IV)以及部分物种的SSU rRNA序列确定(表2)。夏季共鉴定物种为43种,冬季物种数为24种。S1、S2、S3、S4四站点之间物种种类组成差异不显著。
夏冬两季的优势种(Y≥0.02)组成之间存在差异(表3)。夏季浮游动物优势物种为跨立小剑水蚤(Microcyclops varicans,Y=0.612,图版IV-12—15)、裂足臂尾轮虫(Brachionus diversicornis,Y=0.048,图版I-7—8)和微型裸腹溞(Moina micrura,Y=0.024,图版III-14—17),冬季出现的优势种为长肢多肢轮虫(Polyarthra dolichoptera,Y=0.407,图版III-1—3)、疣毛轮虫(Synchaetaspp.,Y=0.219,图版II-20—22)、角突臂尾轮虫(Brachionus angularis,Y=0.024,图版I-13—14)和犀轮虫(Rhinoglenasp.,Y=0.021,图版II-4—7)。夏冬两季之间不存在共有优势物种。
对于犀轮属,《中国淡水轮虫志》记载了2种(前额犀轮虫Rhinoglena frontalis和东京犀轮虫Rhinoglena tokioensis),2008年Willem等[21]报道了一个在南极洲发现的新种Rhinoglena kutikovae。然而这些物种的描述与在东湖发现的优势物种犀轮虫均存在一定的差异。
观察到的犀轮虫体长约为280—510 μm,宽度约为80—110 μm。体呈长圆锥形,透明。头冠上具有一较长的吻,吻上有纤毛。眼点一对,红色,很明显,在吻顶端的两旁。头冠下紧缩形成一“颈”,躯干部前端完全伸展时膨大(图版II-5,与前额犀轮虫类似)。具有槌型咀嚼器,槌钩每侧具6—7个齿(图版II-6,与前额犀轮虫不符,而与东京犀轮虫描述相同)。足短,与体的分界不明显。趾融合为一个,很小(图版II-7,与前额犀轮虫不符,而与东京犀轮虫描述相同)。卵胎生,体内常有多个正在发育中的卵。该物种在夏季没有观察到,而在冬季成为优势种之一(分布特点与前额犀轮虫类似,与东京犀轮虫不同;形态和分布上与Rhinoglena kutikovae均有较大差异)。确定东湖发现的犀轮虫种类还需要进一步研究。
2.2 东湖浮游动物群落结构特征
夏冬两季四个站点浮游动物各类群的平均密度和生物量之间存在较大差异,冬季轮虫丰度约为夏季的8.5倍,而夏季甲壳类生物量高于冬季(图2)。夏季,东湖轮虫平均密度和生物量分别为56.2 ind./L、0.22 mg/L;枝角类平均密度和生物量分别为8.8 ind./L、0.35 mg/L;桡足类平均密度和生物量分别为129 ind./L、2.53 mg/L;各采样点浮游动物密度为67.5—403.9 ind./L,总生物量为0.56—7.69 mg/L。冬季,东湖轮虫平均密度和生物量分别为476.3 ind./L、0.44 mg/L;枝角类平均密度和生物量分别为1.0 ind./L、0.01 mg/L;桡足类平均密度和生物量分别为52.1 ind./L、1.11 mg/L;各采样点浮游动物密度范围为275.0—683.3 ind./L,总生物量范围为0.68—3.49 mg/L。定量计数统计的物种数夏季略高于冬季(图3)。总体上,夏季轮虫丰度和生物量较冬季低,但甲壳类密度和生物量较冬季高。

表 1 东湖冬夏两季浮游动物的物种组成Tab.1 Species composition of zooplankton in the East Lake in summer and winter
2.3 东湖浮游动物多样性分析
基于公式(3)—(6),计算夏冬两季东湖各样点浮游动物Margalef丰富度指数(dM)、Pielou均匀度指数、Shannon-Wiener多样性指数(H′)和Simpson多样性指数(表4)。
夏季东湖浮游动物Margalef丰富度指数(dM)变化是1.189—1.860,均值为1.452;Pielou均匀度指数(J)变化范围为0.498—0.804,平均值为0.665;Shannon-Wiener多样性指数(H′)变化为0.954—1.699,平均值为1.316;Simpson多样性指数(D)变化范围为0.446—0.720,平均值为0.605。冬季东湖浮游动物Margalef丰富度指数(dM)变化范围是0.381—1.035,平均值为0.762;Pielou均匀度指数(J)变化范围为0.479—0.746,平均值为0.630;Shannon-Wiener多样性指数(H′)变化为0.694—1.347,平均值为0.949;Simpson多样性指数(D)变化为0.421—0.698,平均值为0.529。
对比可知,夏季Margalef丰富度指数和Shannon-Wiener多样性指数显著高于冬季;夏季Simpson多样性指数略高于冬季;而两季的Pielou均匀度指数之间相差较小。
2.4 浮游动物群落结构与环境因子相关关系
根据统计性检验,夏冬两季间五个环境因子均存在极显著差异(**P<0.01)。夏季平均水温(32.1℃)、pH(7.85)高于冬季(分别为5.0℃,6.69);而夏季平均含氧量(4.99 mg/L)、盐度(0.17)和ORP(116.69 mV)均低于冬季(分别为11.88 mg/L,0.20,201.525 mV)。
对夏冬季出现的7种优势物种以及5种环境因子进行冗余分析(RDA,图4)。RDA排序轴一与排序轴二的特征值分别为0.5389和0.0270,共解释了56.59%的浮游动物变化情况。水温、含氧量、盐度、pH、ORP五种环境因子共解释了物种组成总变异的58.9%,其中温度的解释度达52.3%。环境因子的变异可将夏冬两季样点较好地分为两个组。根据RDA分析,东湖水体中所出现的优势物种裂足臂尾轮虫、微型裸腹溞、跨立小剑水蚤与温度呈正相关,而长肢多肢轮虫、疣毛轮虫、犀轮虫与温度呈负相关。同时,跨立小剑水蚤与pH之间表现为更显著的正相关。由图4可知,轮虫总丰度与溶解氧之间呈现正相关关系,枝角类总丰度与温度之间呈现正相关,而桡足类总丰度与各环境因子之间相关性均不大。
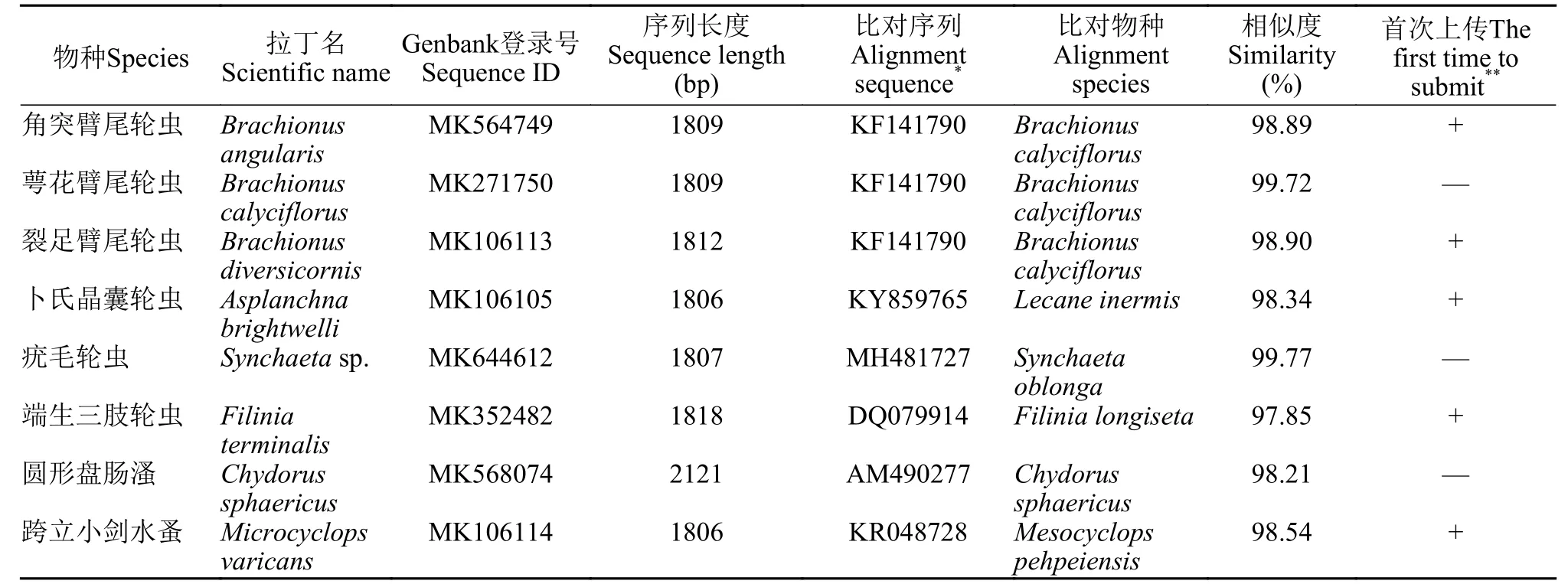
表 2 东湖水体中优势浮游动物种类的SSU rRNA序列信息Tab.2 SSU rRNA gene sequence information of dominant zooplankton in the East Lake
3 讨论
3.1 浮游动物的鉴定
在生态学的研究中,往往会涉及基本的物种鉴定工作[22],利用的传统手段主要是通过形态学观察,并参考分类书籍进行物种鉴定。然而当前浮游动物形态学的鉴定方法面临一些问题,例如在参考一些经典著作如《中国淡水轮虫志》、《中国动物志(淡水枝角类)》等时,对于近年更新的分类体系或物种分布的新变化,可能会存在一些出入;另外,浮游动物的形态学特征有时细微难察,要通过形态学观察来鉴定物种通常需要研究人员具有丰富的经验,否则很容易出错[23]。
而利用近年来发展迅速的分子鉴定手段就可以规避这些问题。一方面,利用分子鉴定不需要物种的形态完整,对成体、幼体甚至卵都适用;另一方面,分子手段可以在形态学鉴定上难以区分时,辅助发现一些门类的隐种和新种[24];最后,分子鉴定方法简单、方便、不易出错,且降低了对研究者的经验要求[23]。然而,当前浮游动物(尤其是淡水浮游动物)的分子序列数据库还不完善,很多常见物种的序列信息仍然缺乏。
因此,提供常见浮游动物的图像信息及分子序列信息对于生态学和分类学的发展有重要价值。本文为在东湖中发现的浮游动物提供了图像信息(图版I—IV),并对优势物种的重要鉴定特征提供了具体的图像;同时为一部分常见物种在GenBank上传了SSU rRNA序列信息,其中五条SSU rRNA全长序列为对应物种的首次报道(角突臂尾轮虫Brachionus angularis、裂足臂尾轮虫Brachionus diversicornis、卜氏晶囊轮虫Asplanchna brightwelli、端生三肢轮虫Filinia terminalis和跨立小剑水蚤Microcyclops varicans),为未来浮游动物鉴定研究提供了参考资料。

表 3 东湖夏冬两季各采样点浮游动物的最大丰度和优势度Tab.3 The highest density and the dominance index of zooplankton detected in the East Lake in summer and winter from four different sampling sites (S1—S4)
3.2 东湖浮游动物物种组成
浮游动物群落结构易随环境变化产生变动,因而依据浮游动物群落结构的特点,可以推测当前环境条件的特点,并按照趋势预测未来环境条件变化情况[1]。
根据历史文献资料,东湖浮游动物物种组成有较大变化(表5),与东湖的水质变化也存在一定的联系。20世纪60年代,东湖发现轮虫56—82种,枝角类中仅盘肠溞科就发现13属24种,桡足类发现7—14种,出现的优势物种主要为螺形龟甲轮虫、暗小异尾轮虫、对棘同尾轮虫、特异同尾轮虫、二突异尾轮虫、鼠异尾轮虫、尖尾疣毛轮虫、针簇多肢轮虫、透明溞、隆线溞、近邻剑水蚤、广布中剑水蚤、长江新镖水蚤、特异荡镖水蚤[25—29];20世纪80年代,东湖发现轮虫57种,桡足类10种,优势物种为针簇多肢轮虫、螺形龟甲轮虫、暗小异尾轮虫、角突臂尾轮虫、对棘同尾轮虫、矩形龟甲轮虫、前节晶囊轮虫、矩形臂尾轮虫、萼花臂尾轮虫、透明溞、透明薄皮溞、特异荡镖水蚤、广布中剑水蚤、球状许水蚤和近邻剑水蚤[26,29—31];20世纪90年代,东湖发现轮虫23—59种,枝角类18种,桡足类7—10种,优势物种为暗小异尾轮虫、针簇多肢轮虫、螺形龟甲轮虫、多须拟前翼轮虫、六腕轮虫、短尾秀体溞、微型裸腹溞、近邻剑水蚤、广布中剑水蚤、近邻剑水蚤、台湾温剑水蚤[8,10,12,31—33]。2006年,颜庆云等[3]在东湖发现轮虫39种;在本次调查中,东湖共发现轮虫21属37种、枝角类10属10种、桡足类3属3种,优势物种为裂足臂尾轮虫、角突臂尾轮虫、犀轮虫、疣毛轮虫、长肢多肢轮虫、微型裸腹溞和跨立小剑水蚤。
从物种数的变化来看,自20世纪60年代以来,东湖浮游动物物种数一直处于逐渐减少的趋势,分析可能的原因如下: 一方面,20世纪以来东湖周边经济迅速发展,大量污水或废水排入东湖导致水体受污染情况严重,环境条件的迅速改变可能造成部分物种无法及时适应而消失,这种现象与淮河流域的报道类似[34];另一方面,由于近年来人为对东湖的改造,包括围湖造田、修建东湖隧道等,东湖水域面积大大减小、浮游动物生存环境短期发生较大变化,这对东湖浮游动物群落也产生了一定的影响[35]。
在优势物种方面,几十年前东湖出现的主要优势物种如螺形龟甲轮虫、等棘异尾轮虫、暗小异尾轮虫等均为寡污型,针簇多肢轮虫为β-中污型,而近年出现优势物种如裂足臂尾轮虫、犀轮虫、疣毛轮虫等均为β-中污型,角突臂尾轮虫、萼花臂尾轮虫为β-中污型或α-中污型,可见东湖轮虫逐渐从寡污型转变为β-中污型或α-中污型[36];优势甲壳类浮游动物主要表现为逐渐趋向小型化。东湖浮游动物物种组成发生改变的原因在于,一是由于东湖的污染,水体逐渐富营养化,适应于富营养型水体的种群得到发展,并逐渐取代喜贫营养型水体的种群;二是受到东湖鲢鳙摄食的影响,大型甲壳类个体在鲢鳙密度高的水体中不占优势,从而促使甲壳类浮游动物向小型化发展[8]。

图2 夏冬两季东湖各点浮游动物丰度及生物量Fig.2 The abundance and biomass of zooplankton during summer and winter in the East Lake
需要指出的是,考虑到轮虫的大小一般为50—2000 μm[37],本研究中利用25号浮游生物网(孔径为64 μm)过滤2 L原位水对轮虫进行定量采集[17],与传统沉淀法比较其最大优点在于可以最大可能获得稀有或丰度较低的物种。但是该方法可能会造成小个体轮虫的生物量偏低。另外,考虑到沿岸带光照、氧气充足、营养条件良好,并生长有高等植物,可以为浮游动物提供更加复杂、多样、优质的生存环境,单位空间内物种丰富程度可能更高[38],为了更好地获取东湖浮游动物多样性的数据,本研究主要选择沿岸带作为采样点,从而有别于前人对东湖研究中在敞水区的样点设置[6,8,25]。因此,本次研究所新发现的优势物种很有可能与沿岸带样点的生境特征有关。例如新发现的优势物种跨立小剑水蚤,据文献报道[16],该物种主要生活于小型水域和流速缓慢的河流中,在湖泊沿岸带的水草丛中数量较多。因此,本研究所报道的优势物种是否在东湖敞水区也能形成优势群体值得进一步的验证研究。
3.3 浮游动物群落结构特征
在本次调查中,东湖夏冬两季浮游动物群落结构的丰富度、均匀度、多样性指数,以及各类群的丰度、生物量等方面均存在一定差异。
在本文中,东湖夏季浮游动物丰富度和多样性指数高于冬季,均匀度与冬季接近。根据许晴等[39]的研究,认为对均匀度接近、丰富度差别较大的群落进行比较时,应该利用Shannon-Wiener指数进行水质状况分析。在本次调查中,发现夏冬两季浮游动物均匀度指数相差较小(0.665和0.630),而丰富度相对差别较大(1.452和0.762),故利用Shannon-Wiener指数进行东湖水质分析。东湖夏季Shannon-Wiener指数和Margalef指数均处于1—2,根据水质评价标准(表6)[40],东湖水质为中污染;东湖冬季Shannon-Wiener指数和Margalef指数均小于1,水质为重污染。
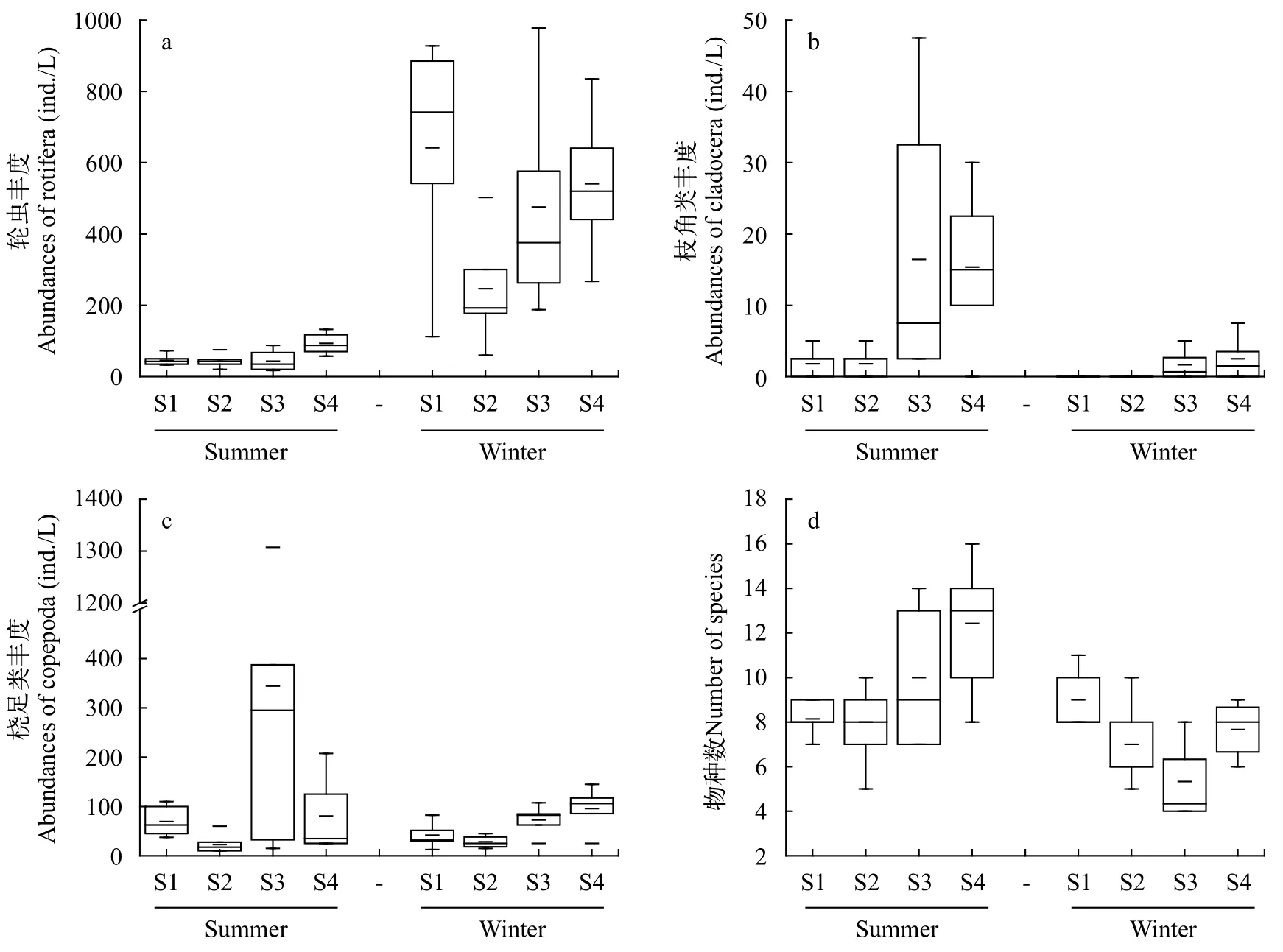
图3 夏冬两季东湖各点浮游动物类群丰度和物种数比较Fig.3 The comparison of the abundance and species number of zooplankton groups in summer and winter in the East Lake

表 4 冬夏两季东湖浮游动物的多样性指数Tab.4 Environmental factors for four stations in the East Lake in summer and winter

图4 东湖夏冬两季环境因子与浮游动物种群的冗余分析Fig.4 Redundancy analysis of zooplankton species-environmental factors in summer and winter of the East Lake

表 5 东湖浮游动物物种历年组成Tab.5 Comparison of the composition of zooplankton species in East Lake over the years
东湖夏季轮虫丰度和生物量低于冬季,而甲壳类丰度和生物量高于冬季(图2)。轮虫为喜富营养型种类,水体营养状态的提升有利于轮虫种类丰度的提高,枝角类喜还原性的中营养或贫营养的清洁水体,而桡足类受环境因子的影响较小[41]。东湖浮游动物群落组成差异也反映了夏季水质优于冬季,冬季水体富营养化程度更高。
此外,历史上对东湖比较系统全面的调查研究[6,8]主要是在东湖设两个采样站点。一个在湖的西部湾区域(靠近现在的水果湖),一个在湖中心。沈韫芬和陈受忠[25]发现第I站的浮游动物都具有沿岸带种类的共同特点,多在水浅而有高等植物生长的环境中生长,而第II站的浮游动物则具有亚沿岸带的特征。我们此次采样点的设置主要分布于II站所在湖区的沿岸带。将我们的数据与历年I站的研究结果[6,8,25]进行比较(表7)可以发现,本次调查中夏季轮虫丰度为历年最低(56 ind./L),而冬季除了1979年之外,轮虫的丰度与往年的丰度相当(476 ind./L),并略高于往年水平。夏季枝角类的丰度和1962年及1974年相当(9 ind./L),不过远远低于1979年和1980年,且与1991年全年的平均水平相当;冬季枝角类偏低(1.0 ind./L)。值得注意的是此次调查中夏季桡足类的丰度是历年最高,达129 ind./L,远远高于除1979年以外的其他年份,不过冬季桡足类的丰度(52 ind./L)和历年在一个数量级,相差不大。将我们的数据与II站比较也可以得到类似的变化规律,即冬季的轮虫与夏冬两季的桡足类的丰度在历年变化中有增多的趋势,而枝角类的丰度在夏冬两季中均偏低,轮虫在冬季的丰度与往年相比也较低。
夏季的水质优于冬季的现象在太平湖的相关研究中也存在类似的报道[42]。东湖冬季水质较差的原因可能在于,东湖冬季水位高于夏季,这可能导致一部分枯枝败叶或生活垃圾等进入水体,引起水质下降;另外,冬季由于电力需求大,空气污染较夏季严重,部分污染物(如固体颗粒物、SO2等)随着降雨进入湖泊,这些都导致冬季东湖水质下降[43]。

表 7 东湖历年夏冬两季浮游动物数量Tab.7 Comparison of the number of zooplankton (ind./L) in the East Lake over the summer and winter
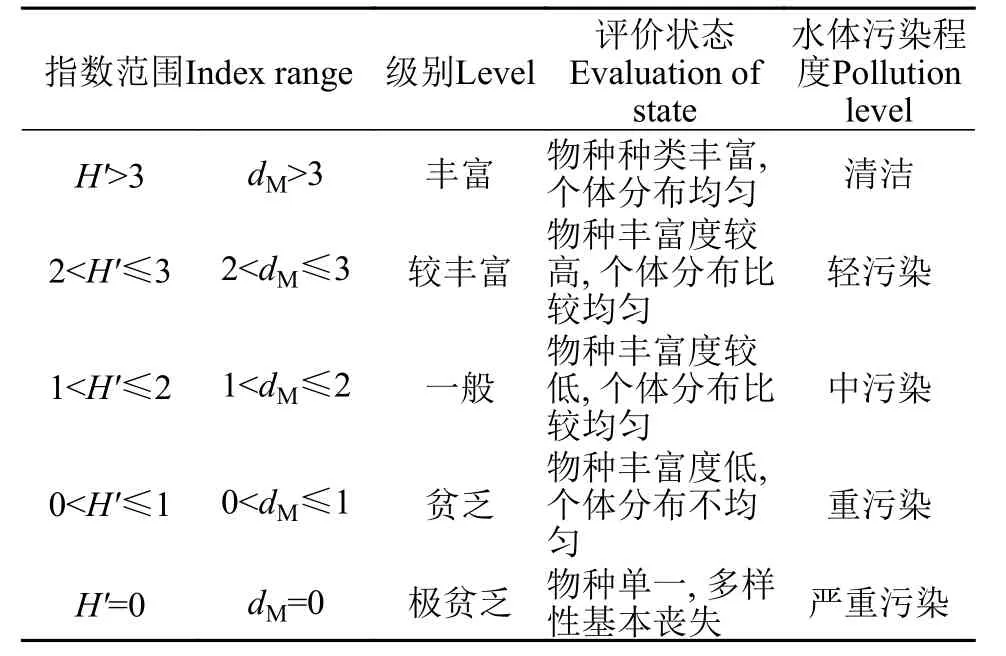
表 6 多样性指数对水质评价的标准[35]Tab.6 Standards of water quality assessed in terms of diversity index
3.4 浮游动物群落结构与环境因子相关分析
水体中环境因子是影响浮游动物密度和多样性的重要因素,环境因子的变动对不同物种有不同的影响。从东湖夏冬两季的物种组成分析的对比上来看,温度对夏冬两季浮游动物组成差异上解释度最大为52.3%。所以温度可能是引起夏冬两季浮游动物群落结构变化的最主要因素。有研究表明[44],浮游动物群落结构的季节动态变化常常与温度的变化有关。Gillooly[45]认为温度对浮游动物繁殖时间也有重要影响,温度越高浮游动物胚的发育时间越短,从而种群数量越大;崔福义等[46]同样认为温度与剑水蚤各发育阶段的发育时间呈负相关,温度高则剑水蚤的生长繁殖活跃,数量增加。从本次调查的结果分析,夏季出现的优势种裂足臂尾轮虫、微型裸腹溞、跨立小剑水蚤以及枝角类总量与温度呈现正相关,而冬季出现的优势物种长肢多肢轮虫、疣毛轮虫、犀轮虫与温度呈现负相关,这与物种对温度适应的特异性有一定关系[47],裂足臂尾轮虫是一种喜温性的轮虫,在夏季会大量出现[14];微型裸腹溞也是嗜暖性的种类,一般在四月到八月繁殖最快[15];跨立小剑水蚤由于温度对繁殖时间的影响,温度高时种群数量大;高温可以促进枝角类的生长,低温会延缓其生长[15];而长肢多肢轮虫为狭冷性物种,适应于在4—10℃的水体中生存,而水温高于15℃时很难发现[14];本次调查中未确定到种类的疣毛轮虫和犀轮虫两个类群可能适应于偏冷的水体;而角突臂尾轮虫属于广生性的种类[14],对温度的适应范围较宽,夏冬两季均有出现,因此水体温度不是决定其分布的主要环境因子。根据黄祥飞等的研究[25],绝大部分轮虫在15—25℃内,其发育时间会随着温度的升高而缩短,轮虫总数高峰一般在20℃以上时出现,而本文结果显示,夏季(28.9—35.5℃)轮虫总量低于冬季(4.6—5.6℃),可能的原因在于温度并不是解释轮虫总丰度分布的最主要环境因子。
通过RDA分析,发现轮虫总丰度和浮游动物总丰度与溶解氧正相关。Elliott[48]的研究发现在溶解氧浓度下降的情况下,绝大多数轮虫种群密度降低,仅极少数种类如螺形龟甲轮虫Keratella cochlearis和长刺盖氏轮虫Kellicottia longispina等对溶解氧浓度适应范围较宽,在低氧情况下也能维持种群密度。浮游动物进行呼吸作用时需要消耗氧气,这也能解释浮游动物总丰度与溶解氧之间的正相关关系。由于夏季东湖溶解氧含量低于冬季,故轮虫及浮游动物总丰度在冬季高于夏季。
在本文中,pH的变化可以影响跨立小剑水蚤丰度大小,两者之间存在明显的正相关关系(图4)。跨立小剑水蚤对酸碱度的适度范围在pH7.0—9.0[16],偏向于弱碱性水体,本次调查期间pH波动范围为6.69—7.85,故两者之间展现为正相关。pH对轮虫和枝角类丰度变化影响较小的原因在于轮虫常常表现出比较广泛的pH耐受性,绝大多数轮虫的生存pH范围至少有2.0个单位[49];而枝角类各个种对水域pH各有不同的适应性,因此在酸性、中性和微碱性的水域中都有分布[15],所以在不同pH环境下总丰度变化不大。桡足类总量与各环境因子的关系均不大,与张世羊等[37]的研究结果类似,说明桡足类对环境的抗逆性强,虽然个别物种会受到环境变动影响,但总量可以保持稳定。
除理化因子外,竞争和捕食也是影响浮游动物群落结构的重要因素。温新利等[50]指出,枝角类是与轮虫争夺食物的有力竞争对手,桡足类和鱼类是轮虫的捕食者。东湖夏季枝角类和桡足类丰度较高,可能与轮虫产生了较强的竞争和捕食关系;而冬季枝角类和桡足类受环境因子影响总量下降,对轮虫的限制减少,从而使得轮虫总量增加。此外,浮游动物是很多鱼类特别是我国的四大家鱼之一鳙的主要饵料,东湖鱼类的组成与产量对浮游动物群落结构也有重要的影响。本次调查中发现与往年相比,枝角类的数量下降非常明显(表7)。从该研究结果来看,东湖应该减少鲢鳙的放养密度,以逐步恢复水中的大型枝角类。
4 结论
本文通过对武汉东湖夏冬两季进行每周一次的生物样品采集及分析,发现夏冬两季东湖浮游动物群落结构存在明显差异,夏季物种数(43种)高于冬季(25种),夏季轮虫丰度及生物量小于冬季,而甲壳类丰度及生物量高于冬季。夏季发现3种优势物种,冬季发现4种优势物种,夏冬两季之间不存在共同优势物种。通过多样性指数对东湖水质进行评价,发现夏季浮游动物群落Margalef丰富度指数、Shannon-Wiener多样性指数和Simpson多样性指数均高于冬季,而夏冬两季Pielou均匀度指数差异不大,表明东湖夏季水质(中污染)优于冬季(重污染)。对东湖夏冬两季环境因子变化与浮游动物群落结构之间的相关性进行分析,发现温度是影响浮游动物群落结构变化的最重要的环境因子。本文提供的部分物种图像信息及SSU rRNA序列信息为浮游动物的研究提供了参考资料。
然而需要指出的是,本次调查采样时长及地理位置有较大局限,不能完全反映整个武汉东湖浮游动物全年的分布和动态变化特征,物种图像及分子序列信息的采集工作也不够完整。在今后的研究中,应该增加采样范围,对更多物种提供更加全面的图像及分子序列信息,以期在未来建立一套可以随相关研究工作不断更新的、更具参考价值的浮游动物鉴定体系。

图版 Ⅰ 东湖水体中分离获得的浮游动物的形态学观察图片(标尺: 1、3—13为50 μm;2为20 μm)Plate Ⅰ Pictures of zooplankton isolated from the East Lake (Scale bars: 50 μm for 1,3—13;20 μm for 2)

图版 Ⅱ 东湖水体中分离获得的浮游动物的形态学观察图片(续)(标尺: 1—5、8—9、11—22为50 μm,6—7为10 μm,10为100 μm)Plate Ⅱ Pictures of zooplankton isolated from the East Lake (Continued) (Scale bars: 50 μm for 1—5,8—9,and 11—22;10 μm for 6—7;100 μm for 10)

图版 Ⅲ 东湖水体中分离获得的浮游动物的形态学观察图片(续)(标尺: 2、3、8、11、12、15、16、21为20 μm;1、4—7、17、19为50 μm;10、13、14、18为100 μm;9为200 μm)Plate Ⅲ Pictures of zooplankton isolated from the East Lake (Continued) (Scale bars: 20 μm for 2,3,8,11,12,15,16,21;50 μm for 1,4—7,17,19;100 μm for 10,13,14,18;200 μm for 9)

图版 Ⅳ 东湖中分离的浮游动物的形态学观察图片(续)(标尺: 1为100 μm;2为20 μm;3、4、6—8、10、 11、14、15为50 μm;5、9、12、13为200 μm)Plate Ⅳ Pictures of zooplanktons isolated from the East Lake (Continued) (Scale bars: 100 μm for 1;20 μm for 2;50 μm for 3,4,6—8,10,11,14,15;200 μm for 5,9,12,13)
