熊本牡蛎壳金品系与壳黑品系的生长、存活、性腺发育及生化成分的周期性变化
2020-08-07武祥伟张跃环秦艳平马海涛喻子牛
武祥伟 张跃环 肖 述 秦艳平 马海涛 喻子牛
(1.中国科学院南海海洋研究所,中国科学院热带海洋生物资源与生态重点实验室,广东省应用海洋生物学重点实验室,广州510301;2.云南农业大学动物科学技术学院,昆明 650201;3.云南省高校高原渔业资源保护与可持续利用重点实验室,昆明 650201)
海洋双壳贝类的壳色常呈现缤纷的色彩。壳色不仅受遗传因素的调控,还受外部环境,如浮游生物种类、水温、盐度、底质等的影响[1],因此,壳色与贝类的生态与行为紧密相关[2]。但最近的研究发现,壳色还与贝类的生长与存活等性状相关联[3—6]。因此,壳色具有成为一种可选育性状的潜力,与经济性状进行协同选择,可以培育出兼具目标壳色与经济性状的新品系。对壳色进行选育,首先必须明确壳色的遗传模式。有研究认为牡蛎的壳色受单基因控制,属于质量性状,通过合适的选配设计可使目标壳色性状分离,经过连续多代的选择即可获得纯系[7,8]。目前,国内研究人员已通过多代选育成功培育出金色壳长牡蛎(Crassostrea gigas)“海大2号”[9]与黄色壳葡萄牙牡蛎(Crassostrea angulata)“金蛎1号”[10]。
海洋双壳贝类营养成分的含量多寡与性腺发育和配子发生密切相关,影响着性腺发育的程度及配子发生的快慢[11,12]。糖原和甘油三酯是牡蛎配子形成过程中卵黄生成所需的主要物质,蛋白质亦是饵料匮乏时性腺发育所需能量的主要来源,对牡蛎的配子发生、成熟与排放起到重要作用[13]。本研究以熊本牡蛎金色壳品系和黑色壳品系F3群体为研究对象,比较了两个品系生长与存活率的差异及与壳色的相关关系,并进一步确认了性腺发育特征及配子发生与生化成分含量的关系。本研究为熊本牡蛎壳色品系的选育提供了依据。
1 材料与方法
1.1 金色壳与黑色壳品系的构建与培育
以2015年构建的熊本牡蛎壳金品系、壳黑品系的F2群体为亲本,采用截头法分别选择200个个体(雌∶雄=3∶1)构建F3群体,留种率为10%,选择强度为1.755[14]。人工解剖获取精卵,并使用新鲜海水促熟卵子与激活精子后备用。
采用人工授精,受精卵密度为5×107个/L,孵化条件: 温度27—30℃,盐度20,pH 7.8—8.5。在室内进行浮游幼虫培育;采用成吊的牡蛎壳作为附着基,幼虫变态并附着完毕后转移至广西北海自然海区吊养,进行稚贝与成贝的培育。室内幼虫培育与室外成贝养殖过程中养殖密度调节至相同。实验重复3次。
1.2 性状测量
使用显微镜(Olympus CX22,Tokyo,Japan)测量9、12和15 dph (day post hatching)浮游幼虫的壳高(μm);使用游标卡尺(精确至0.01 mm)测量40日龄稚贝的壳长与壳高(mm),以及180、360、450 dph成贝的壳长、壳高(mm)。每次测量60个个体。
测量180、360、450 dph成贝的总体积,方法为: 1 mL淡水的重量为1 g,因此总体积定义为同体积淡水的重量。使用量筒或烧杯盛满淡水,把整只牡蛎放入其中,收集溢出的淡水并称重(g),即为总体积(mL)。
测量180、360、450 dph成贝的总重,方法为:使用天平称量牡蛎总重(精确至0.01 g);牡蛎开壳后用滤纸吸干体腔液,称量软体重(精确至0.01 g)。
计算9、12、15 dph浮游幼虫的存活率,方法为: 使用300目筛绢网随机收集幼虫,浓缩至1.5 mL离心管中显微镜下统计空壳数与幼虫数,存活率为幼虫数占总数量的百分比。
计算40、180、360、450 dph的成活率;方法为: 在每个时间点随机各采集3吊牡蛎(约120个个体),统计空壳数与活体数,成活率为活体数占总数的百分比。
1.3 性腺发育分期与性别鉴定
金色壳与黑色壳品系分别在180(2016年12月)、360(2017年6月)、450(2017年10月) dph取样,每次随机采集60个个体制作石蜡切片。解剖后取性腺组织(去除消化腺),固定于Bouin’s液中,24h后转入70%乙醇溶液中,之后依次进行脱水、透明、包埋,并做连续切片,切片厚度6—8 μm。将切片置于45℃恒温箱中烘干后进行苏木精-伊红(HE)染色。
使用显微镜观察性腺切片,参照已报道方法[15,16]鉴定性腺发育阶段,本研究把牡蛎性腺发育分为6个时期: 未分化期、形成期、生长期、成熟期、排放期、耗尽期,每期特征为: 未分化期: 滤泡长条形,较薄,生殖细胞紧贴滤泡壁,不能辨别雌雄。形成期: 生殖细胞(精原细胞、卵原细胞)开始形成,滤泡开始增大。生长期: 滤泡较大,滤泡壁处具有较多的精原细胞或卵原细胞,滤泡腔中可出现少量精细胞或卵黄形成前期的卵母细胞,可辨别雌雄。成熟期: 性腺饱满,滤泡紧密相连,内充满多边形的卵子或辐射状排列的精子,但无排卵或排精现象。排放期: 卵子或精子大量排入生殖导管中,滤泡内出现较大空白空间。耗尽期: 卵巢中残存少量扁塌的卵子,处于重吸收状态,滤泡壁上有少量不连续的生殖细胞,如卵原细胞或精原细胞。
通过生殖细胞的有无和类型辨别每个个体的性别,把个体的性别分为未分化、雌性、雄性、雌雄同体等四种类型。
1.4 生化成分定量
分别在180、360、450 dph取样,每次每个品系随机采集15个个体,解剖后分别取性腺(去除消化腺)、闭壳肌、鳃、外套膜,每5个个体的4种组织分别混合,每种组织制成3个混合样品保存于-80℃备用。
采用二喹啉甲酸法测定总蛋白含量[17],即准确称取1 g组织,按照重量(g)∶体积(mL)=1∶9的比例加入9倍体积的生理盐水,冰浴条件下匀浆,2500 r/min离心10 min,取上清液待测。使用酶标仪比色法,以双蒸水作为空白对照,标准品浓度为563 μg/mL,读取波长562 nm处的吸光度,按照总蛋白浓度(μg/mL)=(待测样OD值-空白OD值)/(标准OD值-空白OD值)×标准品浓度×待测样稀释倍数,计算总蛋白含量。
采用磷酸甘油氧化酶法(GPO-PAP)测定甘油三酯含量[18],即组织匀浆后制成待测液,使用酶标仪比色法,以双蒸水作为空白对照,标准品浓度为2.26 mmol/L,读取波长500 nm处的吸光度。按照甘油三酯含量(mmol/g prot)=(待测样OD值-空白OD值)/(标准OD值-空白OD值)×标准品浓度/待测样本蛋白浓度(g/L),计算甘油三酯含量。
采用蒽酮法测定糖原定量[19]。取新鲜组织,使用生理盐水漂洗后再用滤纸吸干水分,称重,并按照样本重(mg)∶碱液体积(μL)为1∶3的比例向样本中加入碱液,沸水煮沸20min,流水冷却后制成待测液,并按照5%的待测液浓度加入蒸馏水。取1 mL检测液加入1 mL显色剂,沸水浴5min,冷却后以双蒸水为空白对照,标准品浓度为0.01 mg/mL,使用分光光度计读取波长620 nm处的吸光度(1 cm光径),按照糖原含量(mg/g组织)=待测样OD值/标准OD值×标准品含量×待测样稀释倍数×10/1.11计算糖元含量。
1.5 数据分析
使用SPSS18.0 (SPSS Inc.,Chicago,IL,USA)计算每组数据的平均值与标准差(Mean±SD),采用单因素方差分析(One-Way ANOVA)检测组间的差异显著性,水平均为P<0.05。
2 结果
2.1 浮游幼虫与稚贝的生长比较
9—40 dph壳金品系的壳高均小于壳黑品系,差异显著(P<0.05,15 dph除外)。壳金品系在浮游幼虫期无生长优势(表1)。
2.2 幼贝与成贝生长比较
180—450 dph,壳金品系的壳高、壳长、总重、总体积、软体重均大于壳黑品系,总重呈显著性差异(P<0.05,表2),表明在幼贝与成贝阶段,壳金品系具有较全面的生长优势。
表 1 熊本牡蛎壳金品系与壳黑品系9—40 dph的壳长与壳高Tab.1 Shell length and shell height of golden shell and black shell lines from 9 to 40 dph in Crassostrea sikamea (n=60; ±SD)
注: 同列数据上标不同表示差异显著 (P<0.05);下同Note: Values in each column with different superscripts are significantly different (P<0.05).The same applies below
品系Line 9日龄9 dph 12日龄12 dph 15日龄15 dph 40日龄40 dph壳高Shell height (μm) 壳高Shell height (μm) 壳高Shell height (μm) 壳高Shell height (mm) 壳长Shell length (mm)壳金Golden shell 170.04±20.71b 264.88±47.68b 340.91±39.56a 9.88±1.17b 8.06±0.94a壳黑Black shell 211.74±42.76a 331.26±47.85a 347.07±46.81a 11.15±1.30a 9.27±1.43a
表 2 熊本牡蛎壳金品系与壳黑品系180—450 dph的生长Tab.2 Growth of golden shell and black shell lines from 180 to 450 dph in Crassostrea sikamea (n=60; ±SD)

表 2 熊本牡蛎壳金品系与壳黑品系180—450 dph的生长Tab.2 Growth of golden shell and black shell lines from 180 to 450 dph in Crassostrea sikamea (n=60; ±SD)
品系Line 壳高 Shell height (mm) 壳长Shell length (mm) 总重Total weight (g) 总体积Total volume (mL) 软体重Body weight (g)180 dph(2016年12月) 180 dph (December 2016)壳金Golden shell 43.92±6.77a 31.61±6.20a 10.94±3.81a 6.02±2.17a 2.36±0.90a壳黑Black shell 38.83±7.65b 26.47±5.91b 7.13±3.70b 4.35±2.45b 1.32±0.76b 360 dph(2017年6月) 360 dph (June 2017)壳金Golden shell 50.99±9.42a 34.87±6.99a 23.53±4.76a 15.58±2.95a 4.12±0.88a壳黑Black shell 50.12±8.95a 37.97±6.39a 19.41±8.74b 12.04±5.38b 3.86±1.74a 450 dph(2017年10月) 450 dph (October 2017)壳金Golden shell 56.56±10.94a 39.36±8.27a 30.28±12.33a 18.71±7.62a 4.83±1.84a壳黑Black shell 57.57±6.24a 38.68±5.25a 27.33±8.79b 17.50±5.81a 4.17±1.83a
2.3 成贝存活率差异比较
熊本牡蛎浮游幼虫期(9—15 dph)、稚贝期(40 dph)与幼贝期(180 dph)壳金品系的存活率高于壳黑品系,但无显著性差异(P>0.05)。360 dph与450 dph(2017年6月与10月)壳金品系的成活率分别为55.35%与42.22%,是壳黑品系成活率(分别为25.23%与12.09%)的2.19倍与3.49倍,差异显著(P<0.05)。壳金品系在成贝期具有较高的存活率优势(表3)。
2.4 性别比例
180—450 dph壳金品系与壳黑品系性别比例同步变化。180、360与450 dph壳金品系的雌雄比分别为1∶0.56、1∶0.45与1∶0.9,180与360 dph时19%与4%的个体具有未分化性腺。而相同时间壳黑品系的雌雄比分别为1∶1.7、1∶0.27与1∶0.28,仅在180 dph时存在15%的未分化个体(图1)。
2.5 性腺发育特征
180—450 dph壳金品系与壳黑品系的性腺发育具有同步性(图2)。180 dph壳金品系与壳黑品系处于性腺分化期的个体比例分别为47.6%与53.5%,处于成熟期和排放期的个体比例分别为14.3%与7.1%;而360 与450 dph时90%以上的个体均处于成熟期、排放期或耗尽期(图3)。
2.6 生化成分含量变化
180—450 dph壳金与壳黑品系的糖原含量均逐渐升高,而甘油三酯含量逐渐降低;并且壳金品系的糖原含量与甘油三酯含量大于壳黑品系,但无显著性差异(P>0.05,图4)。总蛋白含量在不同组织和不同时期无显著变化(图4)。

表 3 熊本牡蛎壳金品系与壳黑品系第9到第450 dph的存活率Tab.3 Survival rate of golden shell and black shell lines of Crassostrea sikamea in 9 to 450 dph

图1 180—450 dph熊本牡蛎壳金品系(a)与壳黑品系(b)的性别比例Fig.1 Sex ratio of golden shell and black shell lines from 180 to 450 dph in Crassostrea sikamea

图2 熊本牡蛎壳金与壳黑品系性腺发育分期Fig.2 Gonad developmental stages for golden shell and black shell lines of Crassostrea sikamea
3 讨论
3.1 壳色对生长与存活的影响
海洋双壳贝类普遍具有壳色多态性现象,浅色壳个体具有较高的基因纯合度,但亦表现较低的适合度[6]。壳色与经济性状常存在显著的相关性。同时期的长牡蛎壳白色群体软体重与存活率均低于深壳色群体[20]。长牡蛎中亦发现壳金色与壳紫色群体幼虫的壳高显著高于壳白色群体(P<0.05),成贝阶段壳金色群体的生长亦显著大于壳白色与壳黑色群体,并且壳紫色群体的存活率显著高于其他壳色的群体[21]。进一步研究表明,长牡蛎贝壳的金黄色是一种背景色,为单基因控制的显性性状,可以稳定遗传[8];不同壳色个体生长与存活的差异性可能是由于有害隐性等位基因纯合导致生长速度下降[5,22]。在本研究中熊本牡蛎不同壳色群体中亦发现相似现象,壳金品系成贝的生长与存活率均高于壳黑品系,并且在幼贝与成贝期壳金品系的壳高、壳长、总重、总体积与软体重均大于壳黑品系。同时,熊本牡蛎成贝的存活率与壳色亦显著相关,6月与10月壳金品系的存活率是壳黑品系的2.19倍与3.49倍。因此,熊本牡蛎壳金品系表现出显著的生长优势与存活优势(P<0.05)。

图3 180—450 dph熊本牡蛎壳金品系(a)与壳黑品系(b)的性腺发育特征Fig.3 Gonadal development for golden shell (a) and black shell(b) lines of Crassostrea sikamea from 180 to 450 dph
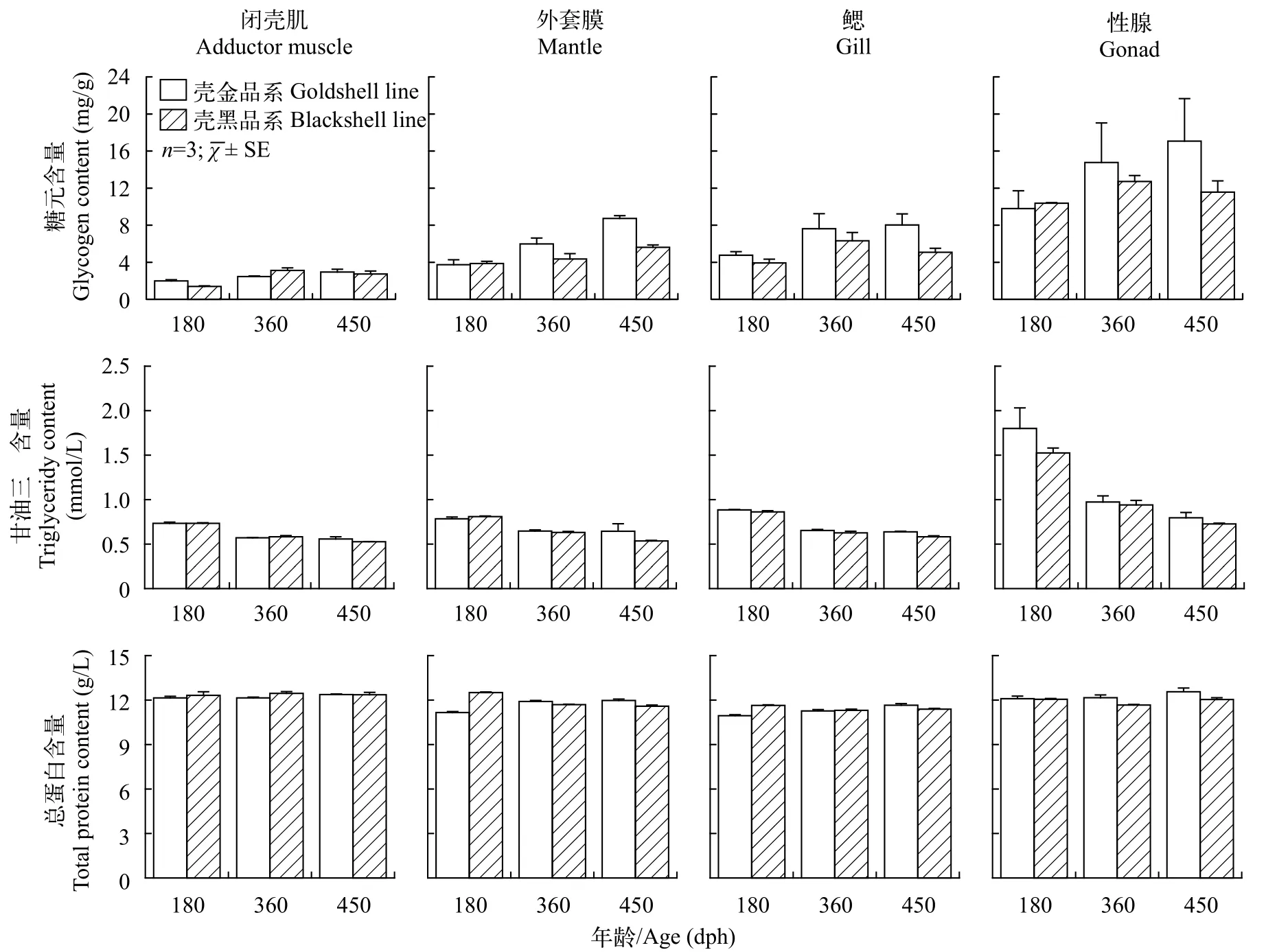
图4 180—450 dph熊本牡蛎壳金品系与壳黑品系闭壳肌、外套膜、鳃和性腺中糖元、甘油三酯和总蛋白含量的变化Fig.4 Contents of glycogen,triglyceridy and total protein contents in the adductor muscle,mantle,gill and gonad in golden shell and black shell lines of Crassostrea sikamea from 180 to 450 dph
3.2 性腺发育周期
外源性因素是影响牡蛎性腺发育的重要因素,包括水温、盐度、饵料生物多寡等[23]。水温是变化较大的外部因素,水温通过影响新陈代谢速率从而影响配子发育和产卵等生殖活动,水温升高新陈代谢加快,通过供给性腺充足的能量来促进性腺生长[24]。即使在没有繁殖活动的冬季,人为升高海湾扇贝(Argopecten irradians)养殖水温5—20℃,均可促使其生殖腺的发育成熟[25]。在本研究中180 dph(2016年12月)壳金与壳黑品系仅分别有14.3%和2.8%的个体处于性腺成熟期,约50%的个体性腺仍处于生长期。熊本牡蛎壳金与壳黑品系养殖于广西北海自然海区,12月份水温最低。因此,较低的水温是推迟性腺成熟的原因之一。本研究中壳金与壳黑品系全年只有一个繁殖期,在6—10月份为繁殖盛期,这种性腺发育特征与长牡蛎壳金群体以及魁蚶的性腺发育相似[11,26]。
3.3 生化成分含量周期性变化
糖原和甘油三酯是牡蛎配子形成过程中卵黄生成所需的主要物质[27]。在本研究中壳金与壳黑品系的糖原与甘油三酯含量在性腺中最高,并随着配子生成与性腺发育成熟而增减,表明糖原和甘油三酯与熊本牡蛎繁殖相关。糖原是牡蛎配子形成过程中的主要供能物质,配子发育成熟需要大量的能量,一旦发育成熟,能量需要即减少[28]。180—450 dph(12月—次年10月)熊本牡蛎壳黑品系性腺中糖元含量在6月(360 dph)最高,之后逐渐降低,而在壳金品系性腺中糖元含量一直升高,可能表明熊本牡蛎壳金品系比壳黑品系具有更长的繁殖期。同时,壳金与壳黑品系性腺中甘油三酯含量均逐渐降低。脂质是卵子的重要组成成分,甘油三酯是脂质积累所需的主要物质,随着卵子大量成熟并排放,脂质积累完成,甘油三酯需求减少,性腺中甘油三酯含量逐渐降低[27]。在长牡蛎壳金品系以及菲律宾缀锦蛤(Tapes philippinarum)性腺的发育过程中亦发现甘油三酯含量随性腺发育成熟而减少的现象[11,29]。蛋白质是贝类卵黄的重要组成部分,是精巢发育的能量来源,卵子发生过程中蛋白质在卵细胞中积累,并随卵子排放而在性腺中的含量快速降低[30,31]。冬季牡蛎饵料匮乏时蛋白质亦是主要的供能物质[13]。但在本研究中壳金与壳黑品系总蛋白含量无组织与时间差异性。熊本牡蛎性腺在发育过程中可能具有不同的蛋白代谢方式。
总之,熊本牡蛎壳金品系具有生长优势与存活率优势;两个品系之间的性腺发育具有同步性,性腺中糖原和甘油三酯的含量高低与性腺发育周期密切相关。壳金品系与壳黑品系为熊本牡蛎选择育种提供了有用的素材。
