人尿激肽原酶通过调控NLRP3炎性小体对小鼠脑缺血/再灌注损伤的影响
2020-08-07温璐璐
韩 冬,温璐璐,王 珏,高 岩,冯 娟
卒中是导致成年人死亡及长期残疾的主要原因,其中缺血性卒中占绝大多数[1]。缺血性卒中是由血栓或栓塞阻塞大脑主要动脉造成的,导致局部血流阻断随后组织坏死。脑缺血再灌注损伤通常伴随炎症反应的发生,导致严重的神经元损伤,进一步造成神经障碍和记忆障碍。人尿激肽原酶是自人尿液中提取得到的蛋白水解酶,是目前应用于临床治疗脑梗死I类新药,具有舒张血管,抑制血小板聚集等功能[2]。本论文主要研究人尿激肽原酶调控nucleotide-binding oligomerization domain-like receptor protein 3(NLRP3)炎性小体改善小鼠脑缺血/再灌注损伤的作用及初步机制,为其临床应用提供依据。
1 实验材料和方法
1.1 实验材料 雄性成年C57BL/6小鼠(22~25 g),由南京市江宁区青龙山动物繁殖场提供,生产许可证号:SCXK(苏)2017-0001。人尿激肽原酶(Human Urinary Kallindinogenase,UK)购自广东天普生化医药股份有限公司(规格:0.15PNA单位/瓶,批号:311711021,商品名:尤瑞克林)。小鼠IL-1β、IL-18 ELISA试剂盒购自上海酶联生物科技有限公司;RNA提取试剂、逆转录试剂盒、real time PCR扩增试剂盒购自南京诺唯赞生物科技有限公司;NLRP3、ASC抗体购自爱博泰克生物科技有限公司;Casepase-1抗体购自abcam公司。
1.2 动物分组及给药 雄性C57/BL6小鼠60只,于造模前随机分为4组,分别为假手术组(Sham),模型组(MCAO/R),人尿激肽原酶高剂量组(UK-H,35×10-3PNAU/kg)、人尿激肽原酶低剂量组(UK-L,17.5×10-3PNAU/kg)。各组分别于复灌后0.5 h静脉给药,给药容积0.1 ml/10 g,假手术组与模型组分别静脉给予生理盐水溶液。
1.3 模型制备 线栓法制备小鼠大脑中动脉闭塞再灌注(MCAO/R)模型[3]:将小鼠用2%水合氯醛腹腔注射(i. p)麻醉后,解剖分离暴露颈部血管,于颈外动脉主干剪一小口,将硅胶直径为(0.22±0.01)mm的特制线栓由剪口向颈内动脉入颅方向慢慢插入,至颈总动脉分支约10 mm左右时稍有阻力,阻断了大脑中动脉的血流供应。1 h后,拔出线栓,完成复灌。假手术组的小鼠麻醉后,如其他组一般分离暴露血管,但不使用线栓堵塞大脑中动脉。
1.4 神经行为学评分及脑梗死面积测定 小鼠于MCAO/R后24 h,按Bederson报道方法[4]对动物的神经功能缺陷进行分级评分。脱颈处死后取出全脑,做冠状切片,每片厚度为2 mm。1%TTC染色,数码相机拍照,ImageJ软件进行分析,计算梗死面积如下:梗死面积(%)=(缺血对侧面积-缺血侧正常面积)/缺血对侧面积×100%
1.5 酶联免疫吸附试验(ELISA)法检测缺血脑组织和血清中炎症因子释放 小鼠于MCAO/R后24 h,摘眼球取血,室温血液自然凝固20 min,4℃ 2500 r/min离心20 min,取上清。脱颈处死后取脑,分离缺血侧半脑,按质量体积比1∶10的量加入预冷PBS,冰上匀浆,4 ℃ 2500 r/min离心20 min,取上清。根据不同ELISA试剂盒的说明书进行操作,分别检测血清和脑组织中的IL-1β、IL-18。
1.6 Real Time PCR、Western blot法检测NLRP3炎症小体mRNA及蛋白表达 小鼠于MCAO/R后24 h,脱颈处死后取脑,分离缺血侧半脑。Real time PCR:Trizol法提取总RNA,逆转录参照试剂盒说明书操作,然后进行实时定量PCR实验。引物序列如下:NLRP3 forward:ATGCTGCTTCGACATCTCCT,reverse:AACCAATGCGAGATCCTGAC;ASC forward:GAAGCTGCTGACAGTGCAAC,reverse:GCCACAGCTCCAGACTCTTC;caspase-1 forward:AGATGGCACATTTCCAGGAC,reverse:GATCCTCCAGCAGCAACTTC;β-actin forward:AGAGGGAAATCGTGCGTGAC,reverse:CAATAGTGATGACCTGGCCGT。以β-actin作为内参基因,2-△△CT计算目的基因相对表达量。
Western blot:收集脑组织匀浆,RIPA裂解细胞,BCA法测定蛋白含量,煮沸变性,-80 ℃保存。凝胶电泳分离蛋白,电转至PVDF膜。5%脱脂奶粉-TBST溶液封闭非特异性蛋白,加一抗4 ℃孵育过夜,加入二抗,室温孵育90 min,ECL发光液显色,曝光成像,ImageJ软件分析照片。
2 结 果
2.1 尤瑞克林降低脑缺血再灌注小鼠脑梗死面积 由图1可见,与假手术组比较,模型组小鼠的脑梗死率显著性升高(P<0.01)。与模型组比较,人尿激肽原酶高、低剂量组均能极显著降低MCAO/R后小鼠脑梗死面积(P<0.01)。


(A) TTC染色各组代表图片 ;(B) 脑梗死面积柱状图;与假手术组比较#P<0.05,##P<0.01;与模型组比较*P<0.05,**P<0.01
2.2 人尿激肽原酶改善脑缺血再灌注小鼠神经行为学损伤 由图2可见,与假手术组比较,模型组小鼠神经行为学评分极显著性升高(P<0.01)。与模型对照组比较,人尿激肽原酶高剂量组能极显著降低MCAO/R后小鼠神经行为学评分(P<0.01)。

与假手术组比较#P<0.05,##P<0.01;与模型组比较*P<0.05,**P<0.01
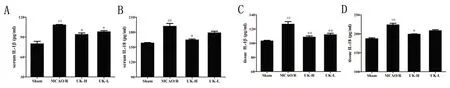
2.3 人尿激肽原酶抑制脑缺血再灌注小鼠血清和脑组织中IL-1β和IL-18表达 由图3可见,与假手术组比较,模型组小鼠血清和脑组织中IL-1β和IL-18含量极显著性升高(P<0.01)。与模型组比较,人尿激肽原酶高、低剂量组均能不同程度降低小鼠血清中和脑组织中IL-1β含量(P<0.05,P<0.01)。与模型组比较,人尿激肽原酶高剂量组能显著降低小鼠血清中和脑组织中IL-18含量(P<0.05)。
2.4 人尿激肽原酶下调脑缺血再灌注小鼠脑组织NLRP3、ASC和caspase-1 mRNA表达 由图4可见,与假手术组比较,模型组小鼠脑组织中NLRP3、ASC和caspase-1 mRNA含量显著性升高(P<0.05)。与模型组比较,人尿激肽原酶高、低剂量组均能显著降低小鼠脑组织中NLRP3和ASC mRNA含量(P<0.05);与模型组比较,人尿激肽原酶高剂量组能显著降低小鼠脑组织中caspase-1 mRNA含量(P<0.05)。
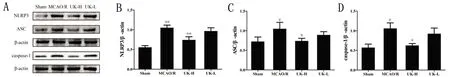
2.5 人尿激肽原酶抑制缺血再灌注小鼠脑组织NLRP3、ASC和caspase-1蛋白表达 由图5可见,与假手术组比较,模型组小鼠脑组织中NLRP3、ASC和caspase-1蛋白表达水平不同程度升高(P<0.05,P<0.01)。与模型组比较,人尿激肽原酶高剂量组能极显著降低小鼠脑组织中NLRP3蛋白表达水平(P<0.01);与模型组比较,人尿激肽原酶高剂量组能显著降低小鼠脑组织中ASC和caspase-1蛋白表达水平(P<0.05)。
与假手术组比较#P<0.05,##P<0.01;与模型组比较*P<0.05,**P<0.01

与假手术组比较#P<0.05,##P<0.01;与模型组比较*P<0.05,**P<0.01
与假手术组比较#P<0.05,##P<0.01;与模型组比较*P<0.05,**P<0.01
3 讨 论
人尿激肽原酶能够促进激肽原中具有血管活性激肽的释放,选择性扩张脑组织小动脉,增加缺血脑组织的血流量[5],改善神经功能缺失。目前已证实缺血性卒中患者应用人尿激肽原酶的临床疗效[6],改善缺血脑组织血流灌注[7]。本文主要研究其对小鼠脑缺血/再灌注损伤的治疗作用及其可能机制。实验结果表明,人尿激肽原酶治疗给药可显著减轻小鼠脑缺血/再灌注损伤后的梗死面积及其神经行为学评分,显示了较好的抗脑缺血作用。
脑缺血再灌注后,缺血脑组织内有大量炎症因子产生,以及炎症细胞的激活、浸润,继而产生级联放大效应加重脑组织损伤,使脑组织由缺血性损伤转向炎症性损伤,炎症反应在脑缺血损伤中起重要作用[8,9]。而炎症小体是炎症免疫反应的核心,目前研究最多的是NLRP3炎症小体。NLRP3炎性小体是属于NLRs家族中重要成员之一的细胞质内的多蛋白复合体,可以识别多种病原体相关的分子模式(PAMPs)。在受到刺激后可发生寡聚化反应,N-末端的热蛋白结构域用于募集ASC以活化caspase-1前体,进而可水解切割pro-IL-1β、pro-IL-18为成熟形式的IL-1β、IL-18,释放到细胞外参与局部或全身炎症反应[10]。实验动物及人缺血脑组织当中NLRP3小体蛋白以及IL-1β、IL-18表达量均升高[11],而给予NLRP3拮抗剂能够起到神经保护作用[12]。因此,NLRP3是治疗脑缺血/再灌注损伤药物研究的重要靶点。本实验研究结果表明,小鼠脑缺血/再灌注损伤后,NLRP3、ASC及caspase-1 mRNA及蛋白表达明显上调,进一步介导血清及脑组织中IL-1β、IL-18表达增加,加剧脑缺血后炎症反应。人尿激肽原酶治疗给药可显著抑制IL-1β、IL-18表达,下调NLRP3、ASC及caspase-1 mRNA及蛋白表达。有文献报道,人尿激肽原酶在缺血性脑损伤中具有抗炎作用[13,14],但是人尿激肽原酶通过干预NLPR3炎症小体来抑制炎症反应尚未见报道。
因此,人尿激肽原酶可能通过抑制小鼠脑缺血/再灌注后NLRP3炎性小体表达,进而抑制炎症反应,减轻脑缺血损伤。在以后的工作中,我们还将继续通过体外细胞实验、NLRP3敲除小鼠及应用NLRP3特异性拮抗剂等方法进一步研究人尿激肽原酶抗脑缺血损伤的靶细胞及其分子机制。
