4种SARS-CoV-2核酸检测试剂一致性评价
2020-08-05颜新生杨荟荟蒿叶霞胡元萍张李涛范庆坤刘泽金
颜新生,杨荟荟,蒿叶霞,胡元萍,张李涛,廖 鑫,范庆坤,刘泽金
(1.武汉亚心总医院检验科,湖北 武汉 430056;2.武汉亚洲心脏病医院检验科,湖北 武汉 430022)
目前,严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)的检测仍是新型冠状病毒肺炎(corona virus disease 2019,COVID-19)的主要确诊依据[1]。诊断COVID-19的2种分子生物学方法中,一种是病毒的基因测序,一种是实时荧光逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)核酸检测。基因测序需要较昂贵的设备以及生物信息团队对结果进行分析解读,检测成本高、周期长,难以普及[2]。因此,临床上主要依靠实时荧光RT-PCR核酸检测方法。截至2020年2月26日,我国相关部门依据《医疗器械应急审批程序》先后批准了6家企业的6种实时荧光RTPCR法SARS-CoV-2核酸检测试剂盒,全力服务疫情防控需要,为COVID-19的诊断提供了重要保障。同时不断有企业研发、生产相关核酸检测试剂盒,产品供应已经得到了极大的缓解。然而,在临床实际应用过程中,核酸检测结果受到采样部位、采样时机、标本的运输、保存条件、实验室的操作流程和检测试剂的敏感性、特异性等多种因素的影响。通过加强人员的培训可以很大程度解决标本的问题,与此同时,高质量的核酸检测试剂就显得尤为重要[3]。正常情况下,从研发到取得核酸检测类试剂盒注册证需要3~5年,其间需要不断优化,并通过大量临床标本的验证。由于疫情初期核酸检测试剂盒研发时间紧迫,临床试验规模太小,缺乏大量科学数据支撑,核酸检测试剂盒特别是初代批次试剂盒的检测性能不尽如人意,给临床诊断造成了较大的困扰。本研究在现有的条件下,比较4家已批准上市的SARSCOV-2核酸检测RT-PCR试剂盒的检测性能,供各临床实验室参考。
1 材料和方法
1.1 研究对象
收集2020年2月18—24武汉亚心总医院住院的COVID-19患者鼻咽拭子标本204例,患者男104例、女100例,年龄12~92岁。本研究经武汉亚心总医院伦理审查委员会审核通过(伦理号:WAGHMEC-KY-2020004),并批准予以豁免患者知情同意。
1.2 仪器与试剂
病毒采样管(江苏康健医疗用品有限公司),磁珠法病毒核酸提取试剂盒(广州美基生物科技有限公司),Kingfisher Duo Prime核酸提取仪(美国赛默飞世尔科技有限公司),Cobas z480实时荧光定量PCR仪(瑞士罗氏公司),SLAN-96S实时荧光定量PCR仪(上海宏石医疗科技有限公司)。选取4家不同企业生产的已取得紧急审批注册证的核酸检测试剂盒,4种试剂基本情况见表1。

表1 4种SARS-CoV-2核酸检测试剂基本情况
1.3 SARS-CoV-2核酸检测
采用磁珠法病毒核酸提取试剂盒对鼻咽拭子标本进行RNA病毒的提取。采用实时荧光RT-PCR技术,按照试剂说明书建议,对SARSCov-2进行基因检测。其中A、B、C试剂针对ORF1ab基因和N基因进行双靶标检测,D试剂针对SARS-Cov-2高度保守区域ORF1ab基因进行单靶标检测。4种试剂均设置了内参对照,用于对标本采集、保存和运输以及核酸提取过程进行监控,减少假阴性结果。核酸检测结果判定参考试剂说明书建议的Ct值,并根据《新型冠状病毒肺炎病毒核酸检测专家共识》建议[4],对于ORF1ab基因和N基因同时阳性的结果,报告为阳性,若仅ORF1ab或N基因其中之一检测结果为阳性,判定为可疑,需复查或重新采样复查。
1.4 统计学方法
采用MedCalc16.2.1软件进行数据分析,2×2四格表总结检测结果,对各试剂盒的一致性进行kappa一致性分析,不同试剂间的一致性比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 4种核酸检测试剂盒对SARS-CoV-2的整体检出率比较
在4种试剂整体检出率(任一基因检出即视为检出)和ORF1ab基因检出率的比较中,采用在临床诊断为COVID-19的基础上,4种试剂任一试剂检出阳性为参考。在N基因检出率比较中,采用在临床诊断为COVID-19的基础上,A、B、C 3种试剂任一试剂检出阳性为参考。任一试剂检出阳性标本123例,全阴性标本81例。在整体检出率比较中,A、B、C、D 4种试剂阳性检出率分别为72.4%、78.0%、59.3%和72.4%,不同试剂差异有统计学意义(P=0.011),见表2。

表2 4种试剂对SARS-CoV-2的整体检出率比较
2.2 4种核酸检测试剂盒对SARS-CoV-2的ORF1ab基因和/或N基因检出率比较
204例标本中,针对ORF1ab基因共检出107例阳性、97例阴性,A、B、C、D试剂对SARSCoV-2ORF1ab基因的检出率分别为47.7%、31.8%、68.2%和83.2%,不同试剂检出率差异有统计学意义(P<0.000 1),见表3。针对N基因共检出105例阳性、99例阴性,A、B、C试剂对SARS-CoV-2N基因的检出率分别为79.0%、90.5%和16.2%,不同试剂检出率差异有统计学意义(P<0.000 1),见表4。此外,在4种试剂对ORF1ab基因检出不一致的83例标本中,Ct值>34(弱阳性)的标本70例(84.3%)。在83例检出不一致的样本中,试剂A、B、C、D分别检出26例(31.3%)、10例(12.0%)、49例(59.0%)和64例(77.1%)。
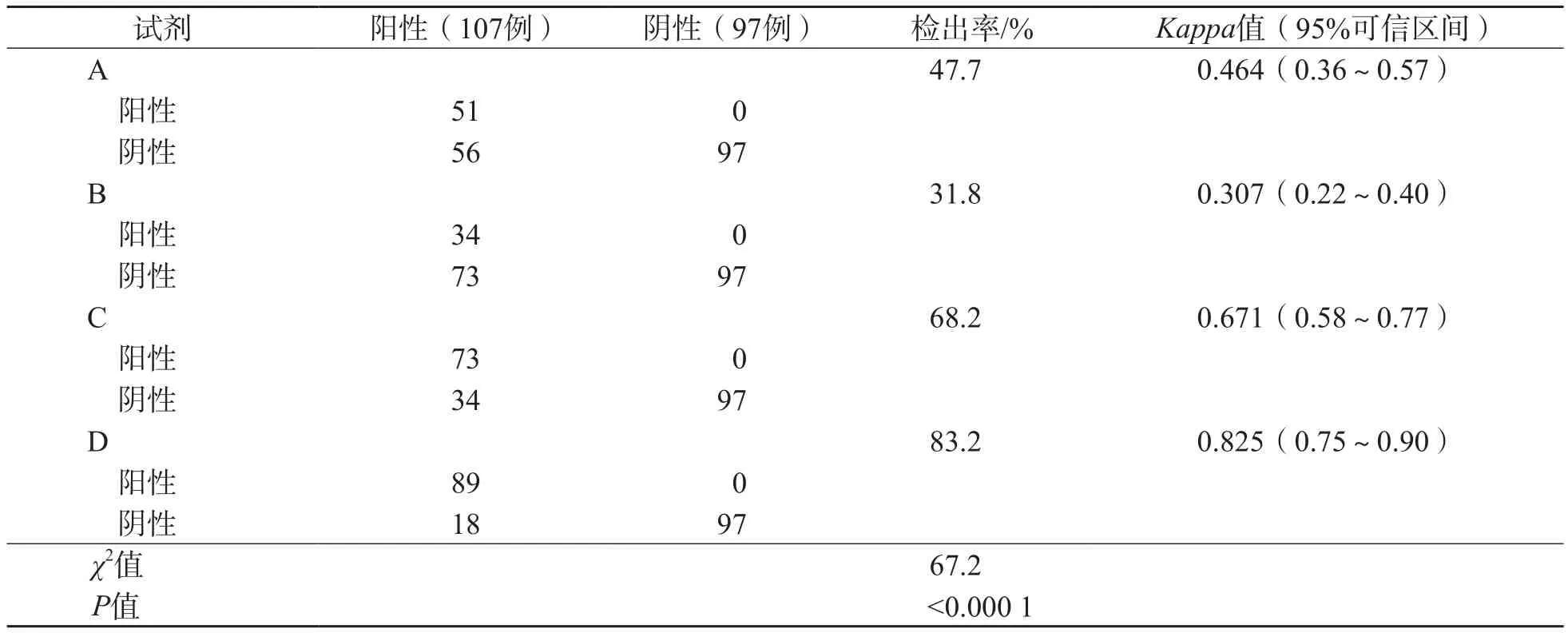
表3 4种试剂对SARS-CoV-2的ORF1ab基因的检出率

表4 A、B、C 3种试剂对SARS-Cov-2的N基因的检出率
3 讨论
SARS-CoV-2是一种新型β属冠状病毒,属于单链RNA病毒,可引起人类呼吸道感染[5],该冠状病毒为第7种可感染人类的冠状病毒家族成员[6]。对SARS-CoV-2的核酸检测是COVID-19的确诊依据和痊愈出院指标。
本研究结果表明,4种检测试剂盒对SARSCoV-2,特别是对弱阳性标本的检出率存在较大差异,可能与试剂引物设计和探针设计有关,也可能与模板量或各组分在体系中的配比有关,从而导致检测的灵敏度不高。由于疫情突发,各企业紧急投入试剂研发和生产,初代批次试剂盒难免存在问题,有一定的漏检率,应对可疑结果使用另一种试剂盒进行复检。本研究只针对现有的试剂批号进行比较,存在一定的局限性,不能完全代表其他批次试剂的检测性能。在实际应用过程中,特别是初代批次试剂盒的使用过程中,应尽可能对不同品牌和批号的试剂盒进行比较验证,检测结果务必结合临床判断,以弥补初代试剂盒的缺陷。另外,还需要关注和验证标本采集管、提取试剂和扩增仪器与各品牌试剂盒的匹配适用性,以找到最优条件,最大程度提高试剂盒的敏感性和特异性。
随着COVID-19出院患者的增多,其病毒核酸检测“复阳”情况受到广泛关注,有COVID-19患者治愈出院后,再次出现咽拭子核酸检测结果阳性[7]。本研究团队小样本研究结果显示,数字聚合酶链反应的敏感性要比目前RTPCR高5~10倍,因此出院前的2次核酸检测阴性结果很有可能是由于标本中的病毒载量低于试剂盒最低检测限导致的假阴性结果。有条件的实验室可采用更敏感的数字聚合酶链反应技术来降低假阴性情况的发生,同时应关注检验前、中、后各环节其他影响因素,注意采样部位和方式、运输和保存条件以及提取扩增环节的质量控制。并把抗体的检测作为核酸检测的有效补充,提高实验室检测的特异性和检出率[8],从而降低漏诊和误诊带来的风险。
