虾青素对脂多糖诱导的RAW264.7细胞炎症反应的影响及机制
2020-08-05朱凌羽李若楠
宋 阳,朱凌羽,李若楠,郑 鑫
(吉林农业大学 动物科学技术学院,吉林 长春 130118)
炎症反应是一种复杂的生物学、生理学和病理学反应。一方面是对损伤的正常生理反应,可以抵御入侵的病原体,没有炎症反应,伤口和感染无法痊愈;但另一方面,不受控制的炎症反应是有害的,随着炎症反应的不断增强,会导致宿主组织损伤和疾病,如急性或慢性炎症、自身免疫性疾病或癌症[1],因此是一把双刃剑。脂多糖(Lipopolysaccharide,LPS)是来自革兰阴性细菌外叶的典型内毒素[2],可强烈诱导机体炎症反应。在炎性刺激物LPS暴露时,与 Toll样受体 (Toll-like receptors,TLR)结合,巨噬细胞被激活,核因子−κB(Nuclear factor kappa-B,NF-κB)活化,导致促炎介质和细胞因子以及活性氧物质的大量产生。此外,主要的促炎细胞因子,例如肿瘤坏死因子−α(Tumour necrosis factor-α,TNF-α)、白细胞介素−6(Interleukin- 6,IL-6)和白细胞介素−1β(Interleukin-1β,IL-1β),在 LPS 刺激的巨噬细胞中过表达,会导致各种炎症性疾病的发生[3-4]。因此,能够有效抑制NF-κB活化,使促炎细胞因子与抗炎细胞因子处于相对平衡的状态,是治疗炎症反应的潜在策略。现如今,大多数合成抗炎药价格昂贵,长期使用会对机体产生胃肠道和呼吸道刺激、肾毒性、身体依赖性和便秘等不良反应。所以,急需寻找具有低毒性和更好耐受性的经济有效的天然药物,来避免长期服用合成抗炎药所造成的毒副作用和成本上升。虾青素(Astaxanthin,AST)属于类胡萝卜素家族,是近年来受到广泛关注的新一代强大的抗氧化剂。其抗氧化能力比其他β类胡萝卜素或维生素E的抗氧化能力更高,已经有体内试验报道其不仅对氧化应激有很好的保护作用,而且还能有效地缓解炎症反应[5]。本试验将LPS作为刺激源建立RAW264.7细胞炎症模型,研究虾青素预保护对RAW264.7细胞的炎症反应有何影响,对虾青素的抗炎效果进行评估,为今后的炎症治疗及疾病防控方面奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 虾青素,纯度 (w)98%(美国Sigma公司)、脂多糖和MTT溶液(美国Sigma公司)、DMSO(北京 Solarbio 公司)、RNA Lyzol(上海ExCell Bio 公司)、First-Strand cDNA Synthesis Kit(美国 GeneCopoeia公司)、ELISA 试剂盒 (上海朗顿生物公司)、引物(上海生工生物公司)、RIPA裂解液(北京Solarbio公司)、BCA法蛋白定量试剂盒(上海碧云天公司)、TLR4抗体、MyD88抗体、NF-кB p65 抗体、β-actin 抗体 (美国 CST 公司)、辣根过氧化物酶 (Horseradish peroxidase,HRP)标记的羊抗鼠/兔抗体(天津三箭公司)、ECL 试剂盒 (美国 Millipore 公司)、RPMI 1640 培养基和胎牛血清(美国Gibco公司)。
1.1.2 主要仪器 二氧化碳恒温细胞培养箱(德国Binder公司);倒置相差显微镜及全自动显微摄像装置(日本Olympus公司);Thermo酶标仪(上海赛默飞世尔仪器公司);高速冷冻离心机(德国Sigma公司);荧光定量PCR仪(美国Bio-Rad公司);超声波细胞破碎仪(美国Branson公司)。
1.2 方法
1.2.1 细胞培养 小鼠单核巨噬细胞系 (RAW264.7)保存于吉林农业大学细胞生物学实验室。复苏冻存的RAW264.7细胞后,接种到含有双抗和体积分数为10%胎牛血清的RPMI1640培养基中,放在37 ℃、CO2体积分数为5%的恒温培养箱中进行培养。间隔1~2 d更换培养液1次,待其贴壁生长到铺满所用培养瓶底面积的80%~90%时进行传代,然后将细胞从培养瓶转移至96孔细胞板中继续培养,用于后续试验。
1.2.2 细胞分组 将试验细胞分为4组,分别为对照组(CK组)、虾青素组(AST组)、脂多糖组(LPS组)和虾青素+脂多糖组(AST+LPS组)。
1.2.3 MTT 法测定虾青素对 RAW264.7 细胞活力的影响 通过细胞计数板计数使细胞的密度保持在 1×105个/mL,每孔 100 μL,随后放置于 37 ℃、CO2体积分数为5%的恒温培养箱中进行细胞贴壁培养。将 5 mg虾青素溶于 1 mL DMSO 中进行稀释,制成虾青素溶液,取 0、18、36、72、108、144 μL 的虾青素溶液分别加入到6 mL的RPMI1640培养液中,使虾青素终浓度为 0、25、50、100、150、200 μmol/L。加入上述含不同浓度虾青素的培养液,每个浓度梯度设置5个重复,分别进行3、6、12、24、48 h的处理后将培养液弃掉,随即在每孔中加入1 mg/mL 的 MTT 溶液 100 μL 进行恒温培养,4 h后弃掉液体并在每孔加入100 μL DMSO,在振荡器中震荡5 min以充分混合,然后用酶标仪测定D490 nm,计算不同虾青素浓度组和对照组D490 nm的比值。根据不同处理时间的细胞活力最高值来判断用虾青素处理RAW264.7细胞的最佳浓度及处理时间。
1.2.4 MTT 法测定脂多糖对 RAW264.7 细胞活力的影响 参照“1.2.3”的步骤对细胞进行贴壁培养,随后加入不同质量浓度的脂多糖,即0、0.5、1.0、2.0、5.0、10.0 μg/mL,每个质量浓度梯度设置5 个重复,分别进行 3、6、12、24、48 h 的处理后将培养液弃掉,根据“1.2.3”的操作步骤先后加入MTT及DMSO测定D490 nm,计算不同脂多糖浓度组和对照组的D490 nm比值,并根据不同处理时间的细胞活力最高值来判断用脂多糖处理RAW264.7细胞的最佳质量浓度及处理时间。
1.2.5 ELISA 检测细胞炎症因子分泌量 采用ELISA检测虾青素作用于脂多糖刺激的细胞后对细胞炎症因子分泌量的影响,步骤如下:用PBS缓冲液对最佳条件处理的细胞进行稀释,使其密度保持在1×106个/mL。用超声波细胞破碎仪对细胞反复进行破碎处理后放入高速离心机中,4 ℃、2 000~3 000 r/min 离心 20 min 并收集上清液。参照ELISA试剂盒的说明进行操作,通过细胞浓度和D450 nm的数据进行标准曲线的绘制及回归方程的计算。
1.2.6 qPCR检测细胞炎症因子表达量 采用荧光定量PCR(qPCR)检测虾青素作用于脂多糖刺激的细胞后对细胞炎症因子表达量的影响,步骤如下:将最佳条件处理的细胞取出,根据RNA Lyzol说明书提取细胞RNA,并对样品进行RNA质量的检测,若D260 nm/D280 nm及D260 nm/D230 nm保持在1.8~2.0的范围内,方可进行下一步的试验;按照First-Strand cDNA Synthesis Kit说明书进行cDNA的合成;最后采用qPCR技术进行表达量的测定。qPCR 采用 20 μL 的反应体系:SYBR Premix 10 μL、上、下游引物各 1 μL、ddH2O 6 μL、cDNA 模板 2 μL。反应程序为:95 ℃ 预变性 30 s;95 ℃ 变性 5 s,60 ℃ 退火 30 s,40 个循环;65 ℃ 5 s,95 ℃ 5 s。每次试验用 18s RNA 作为内参,用 2−△△Ct法计算相关炎症因子的相对表达量,引物序列如表1所示。
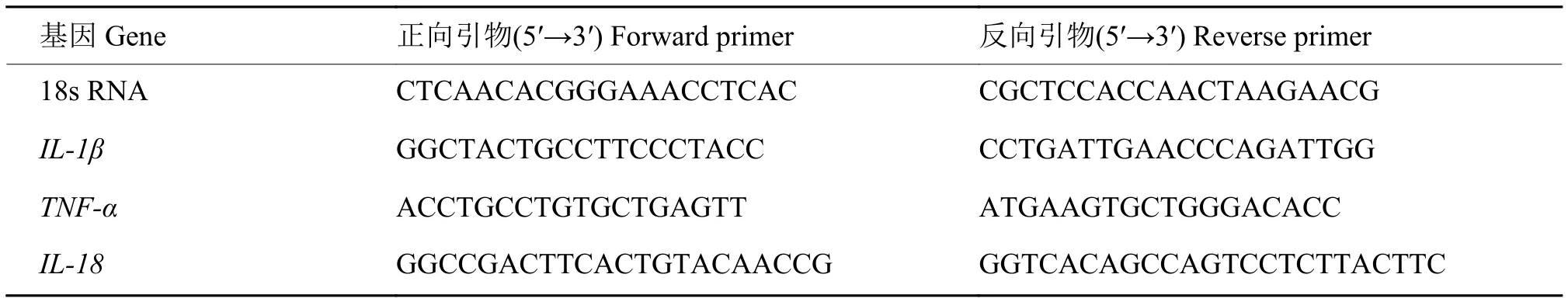
表1 qPCR的引物序列Table 1 qPCR primer sequence
1.2.7 Western blot法检测细胞炎症因子的蛋白表达 采用Western blot法检测虾青素作用于脂多糖刺激的细胞后对细胞炎症因子蛋白表达的影响,步骤如下:取出最佳条件处理的细胞,用预冷的PBS缓冲液进行清洗,洗涤1~2次后用RIPA裂解液将细胞轻轻刮下,放入高速离心机中,4 ℃、12000 r/min 离心 5 min,用 BCA 法对收集的上清液进行蛋白浓度的测定。用30 μg总蛋白进行SDSPAGE凝胶电泳,将蛋白转至PVDF膜上,用0.05 g/mL脱脂奶粉封闭 1 h,分别以鼠源的 NF-кB p65 抗体(按 1∶1 000 体积比稀释)、鼠源的β-actin 抗体 (按 1∶5 000体积比稀释)、兔源TLR4抗体(按1∶500体积比稀释)和兔源 MyD88抗体 (按 1∶1000体积比稀释)作为一抗在4 ℃条件下孵育过夜。用1×TBST溶液进行洗膜后分别加入相对应的HRP标记的二抗,即山羊抗鼠(按1∶2 000体积比稀释)和山羊抗兔(按 1∶2 000 体积比稀释),并在 37 ℃ 条件下孵育 1 h。继续用1×TBST洗膜,感光,最后用显影液进行显色,目的蛋白量通过灰度比值来表示。
1.3 数据分析
所有数据进行初步整理后使用SPSS23.0统计软件进行分析,采用Duncan’s法对各处理组进行多重比较分析。
2 结果与分析
2.1 虾青素和脂多糖对RAW264.7细胞活力的影响
2.1.1 虾青素对 RAW264.7 细胞活力的影响 对RAW264.7细胞采用不同浓度梯度的虾青素进行不同时间的处理,即:0、25、50、100、150、200 μmol/L的虾青素各作用于细胞 3、6、12、24、48 h,通过 MTT法测定RAW264.7细胞活力。结果如图1所示:随着浓度的增长,各处理时间的细胞活力总体呈现先升后降的趋势;用不同浓度的虾青素作用RAW264.7 细胞 3、6、12 h 后,可以增强细胞活力,与 0 μmol/L AST 组相比,当浓度在 25、50、100、150 μmol/L 且作用 3 h后,可以显著增强细胞活力(P<0.05),在浓度为 100 μmol/L 时,细胞活力达到峰值;随着时间的延长,虾青素浓度越高,细胞的活力会随之降低,当用200 μmol/L虾青素作用RAW264.7细胞48 h后,可以显著降低细胞活力(P<0.05),所以选取作用 3 h、浓度为 100 μmol/L 的虾青素作为试验的最佳作用条件,在此时间点和浓度范围内,虾青素对细胞无毒性,可以用于后续试验。
2.1.2 脂多糖对 RAW264.7 细胞活力的影响 对 RAW 264.7细胞采用不同质量浓度梯度的脂多糖进行不同时间的处理,即:0、0.5、1.0、2.0、5.0、10.0 μg/mL 的脂多糖各作用于细胞 3、6、12、24、48 h。通过MTT法测定RAW264.7细胞活力。结果如图2所示:在细胞处理3、6、12 h后,脂多糖可以不同程度地激活RAW264.7细胞;与0 μg/mL的LPS组相比,当质量浓度在2.0 μg/mL且处理3 h后,细胞活力显著增强(P<0.05)并达到峰值;随着时间和质量浓度的增加,细胞活力逐渐降低,当质量浓度为0.5 μg/mL以上且处理48 h后,细胞活力显著降低(P<0.05)。
综合图1、图2结果,100 μmol/L的虾青素和2 μg/mL的脂多糖作用3 h为最佳的处理条件。
2.2 虾青素对脂多糖刺激的细胞中炎症因子分泌量的影响
采用ELISA法对炎症相关因子TNF-α、IL-1β、IL-6及Caspase-1的分泌量进行检测,如图3所示:LPS 组的 TNF-α、IL-1β、IL-6及 Caspase-1的分泌量达到最高,与对照组相比差异显著(P<0.05),而用虾青素进行预保护使 TNF-α、IL-1β、IL-6及 Caspase-1的分泌量相对于LPS组来说有所下降,其中TNF-α、IL-6和Caspase-1的分泌量与LPS组相比分别降低了12.83%、9.66%和20.80%,差异显著(P<0.05),而 IL-1β 无显著差异 (P>0.05)。
2.3 虾青素对脂多糖刺激的细胞中炎症因子mRNA相对表达量的影响
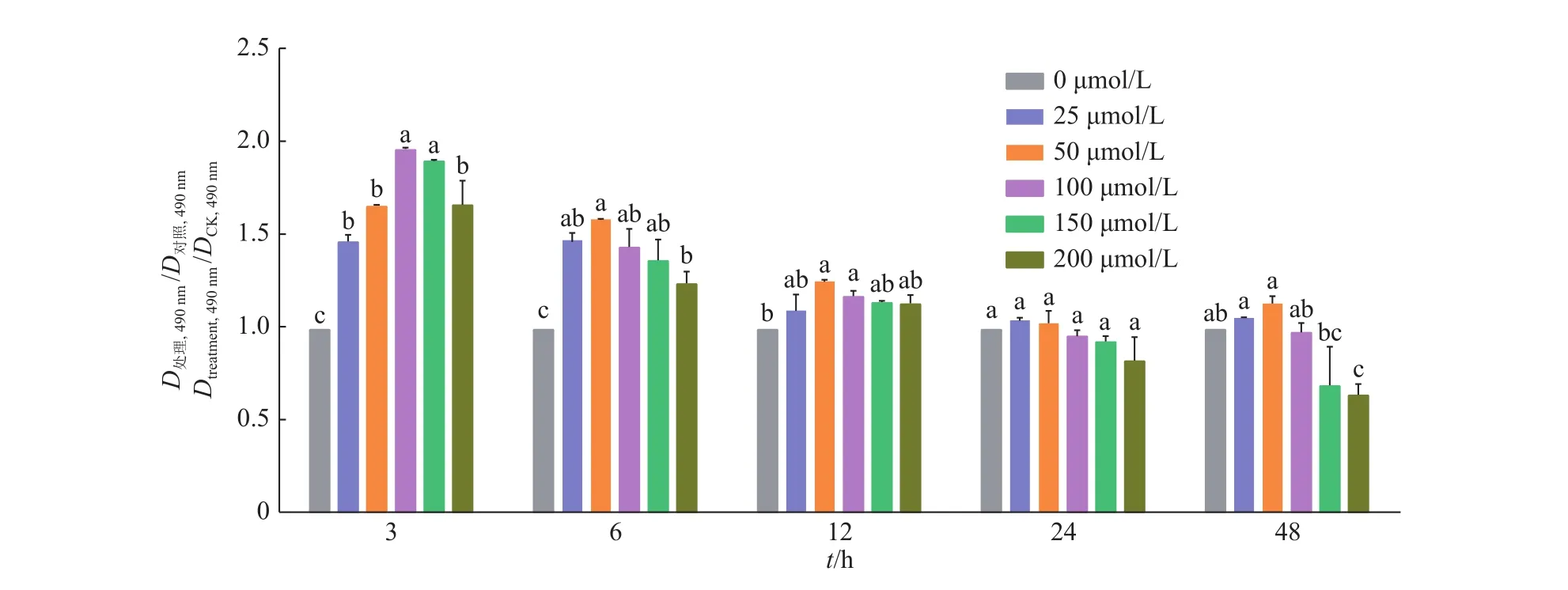
图1 不同浓度虾青素对RAW264.7细胞活力的影响Fig.1 Effect of astaxanthin on the viability of RAW264.7 cells at different concentration
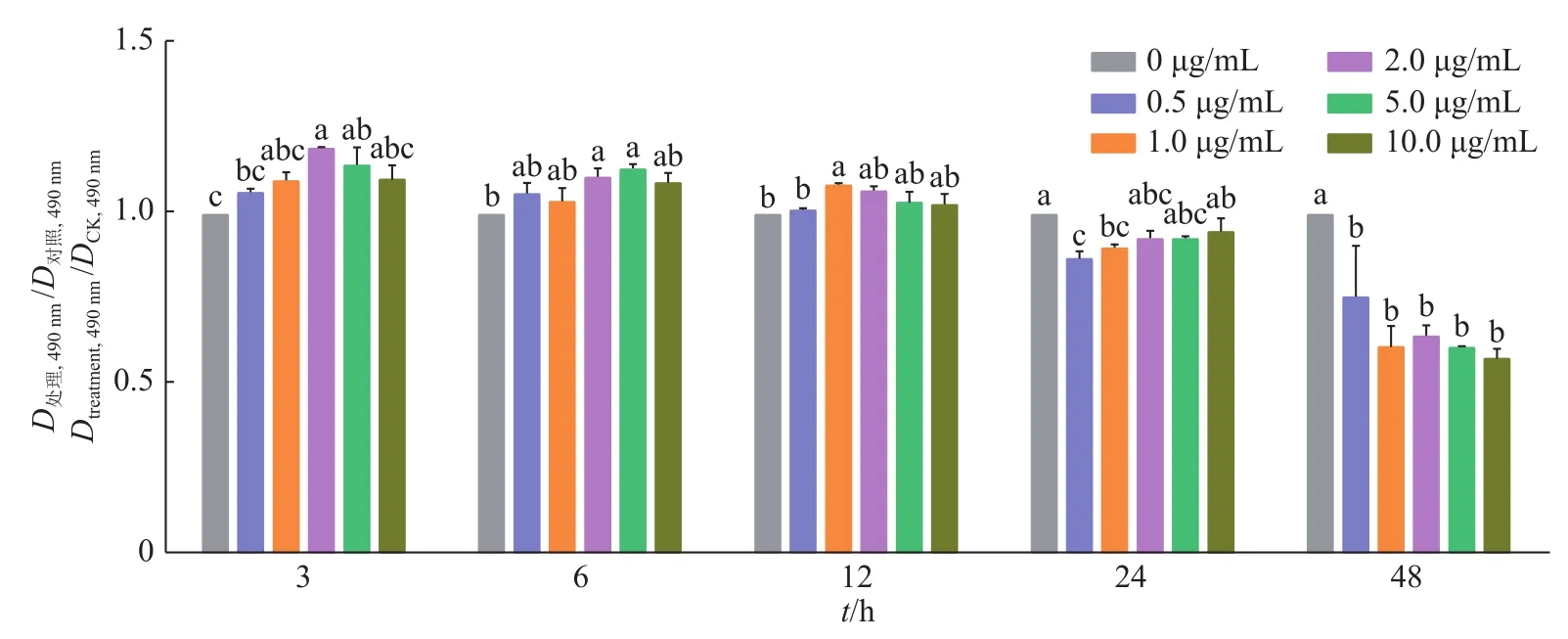
图2 不同质量浓度脂多糖对RAW264.7细胞活力的影响Fig.2 Effect of different content of lipopolysaccharide on the viability of RAW264.7 cells
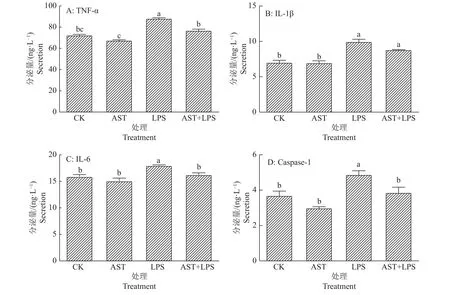
图3 虾青素预保护对脂多糖刺激RAW264.7细胞炎症因子分泌量的影响Fig.3 Effects of astaxanthin pre-protection on inflammatory factor secretion from RAW264.7 cells stimulated by lipopolysaccharide
对炎症因子的表达进行量化分析是反映炎症严重程度的必要措施,通过荧光定量PCR技术检测 RAW264.7细胞中TNF-α、IL-1β、IL-6及IL-18mRNA的相对表达量,以此来判断虾青素预保护是否可以抑制脂多糖刺激的RAW264.7细胞中炎症因子的释放。由图4可知:LPS组中TNF-α、IL-1β及IL-18mRNA的相对表达量最高,相较于对照组呈现显著差异(P<0.05),虾青素预保护使得炎性因子mRNA的相对表达量发生显著降低(P<0.05);而LPS组中IL-6mRNA的相对表达量相较于对照组显著升高(P<0.05),AST+LPS组中其mRNA相对表达量有所降低,但与LPS组相比并没有显著性差异(P>0.05)。由此证明虾青素预保护可以有效地抑制炎性因子的表达。
2.4 虾青素对脂多糖刺激的细胞中炎症因子蛋白表达的影响
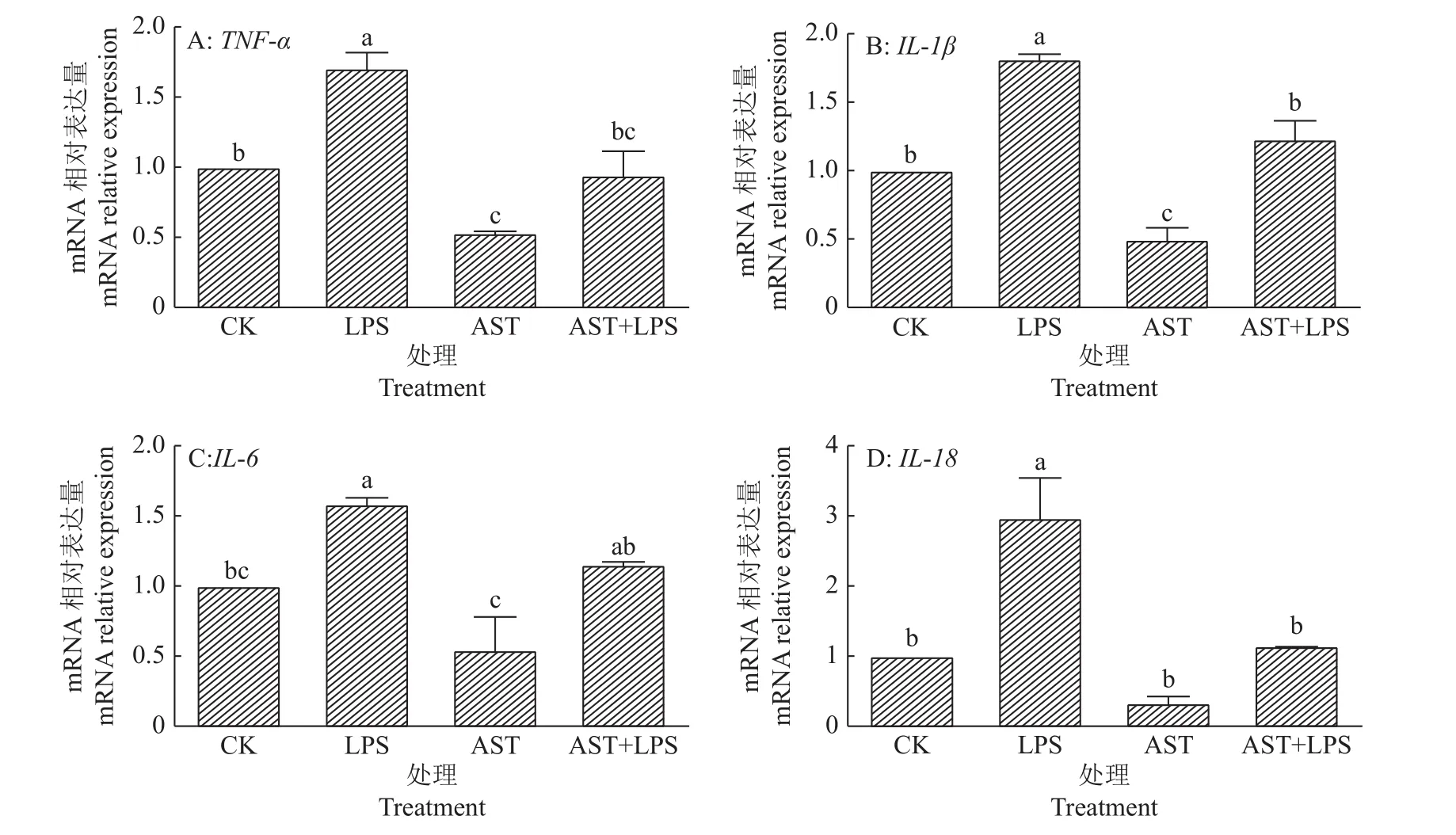
图4 虾青素预保护对脂多糖刺激的RAW264.7细胞中炎症因子mRNA相对表达量的影响Fig.4 Effects of astaxanthin pre-protection on mRNA expression of inflammatory factor in RAW264.7 cells stimulated by lipopolysaccharide
通过Western blot检测 RAW264.7细胞中TLR4、MyD88、NF-кB p65 的蛋白相对表达量,以此来证明虾青素是否可以通过阻止LPS与其Toll样受体4(TLR4)结合来减少促炎信号的传导以缓解LPS造成的炎症。结果如图5、图6所示:LPS组与对照组相比,TLR4、MyD88、NF-кB p65 的蛋白相对表达量都有不同程度的提高,其中TLR4和NF-кB p65蛋白的相对表达量分别升高了195.40%和226.95%(P<0.05),MyD88的蛋白相对表达量差异不显著(P>0.05);而 AST+LPS 组中,TLR4、MyD88和 NF-кB p65的蛋白相对表达量较LPS组分别降低了54.99%、45.70%和28.20%(P<0.05)。综合结果显示,虾青素的添加可以降低 TLR4、MyD88、NF-кB p65的蛋白表达水平。

图5 虾青素预保护下脂多糖刺激的RAW264.7细胞中炎症因子蛋白的电泳图Fig.5 Electrophoresis of inflammatory factor in RAW264.7 cells stimulated by lipopolysaccharide under astaxanthin pre-protection
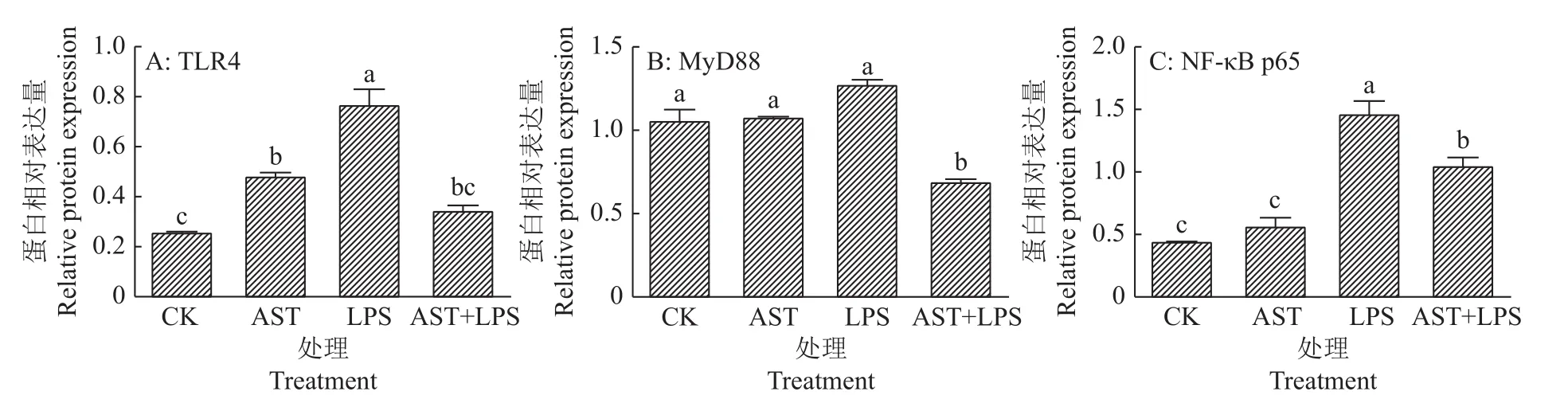
图6 虾青素预保护对脂多糖刺激的RAW264.7细胞中炎症因子蛋白相对表达量的影响Fig.6 Effects of astaxanthin pre-protection on relative protein expression of inflammatory factor in RAW264.7 cells stimulated by lipopolysaccharide
3 讨论与结论
炎症是病原体、受损细胞或刺激物靶向的基本防御机制。炎症反应可用于宿主防御、组织修复反应和稳态的恢复等多种生理目的。然而,这种反应也会产生病理学后果,导致炎症性组织损伤,化生和体内稳态的改变。因此,身体需要适当调节炎症反应[6]。
细胞因子发挥着广泛的免疫调节作用,对人体生物学和疾病至关重要。细胞因子分为促炎因子和抑炎因子,二者通过动态平衡维持着机体的健康。促炎性细胞因子增多往往会引起发烧、发炎、组织破坏或全身性发炎,从而使疾病恶化。TNF-α是一种单核因子,主要由单核细胞和巨噬细胞产生,LPS是较强的刺激剂[7-9]。IL-1是一种重要的促炎细胞因子,能够激活多种免疫和炎症细胞,包括IL-lα和IL-1β,主要由巨噬细胞分泌,并且像TNF-α一样充当“报警细胞因子”[8]。TNF-α及IL-1被认为是“早期反应”细胞因子,这意味着它们在免疫应答的最早阶段被释放,并作为随后的促炎性细胞因子级联性的触发。IL-1β能够通过自分泌或者旁分泌刺激其他细胞因子如IL-6的释放和炎症因子的产生[9]。IL-6是一种关键的多效性炎症细胞因子,既可以作为促炎性细胞因子,又可作为抗炎性细胞因子,在诱导下游炎症反应中起重要作用。在某种程度上,它起着防御的作用。但是,在一些炎症性疾病中,它是促炎性的[10]。半胱氨酸蛋白酶在调节细胞凋亡中的作用是众所周知的,而其家族的某些成员的主要作用是调节炎症,其中Caspase-1是小鼠中的促炎性半胱氨酸蛋白酶,主要催化促炎细胞因子Pro-IL-1β和Pro-IL-18在细胞内加工为成熟IL-1β和IL-18[11]。IL-18通过自分泌的方式促进一系列化合物和酶的产生,如IL-6、IL-18、iNOS等[12]。从本试验研究结果中可以看出,与对照组相比,TNF-α、IL-1β、IL-6 及 Caspase-1 作为促炎因子在用2 μg/mL的LPS给予RAW264.7细胞3 h刺激后分泌量或表达量有显著性升高,说明此时细胞处于炎症的状态,当用100 μmol/L的虾青素预保护3 h再给予刺激时,相较于LPS组,相关促炎因子的分泌量或表达量相较于LPS组显著下降,其中TNF-α、IL-1β和caspase-1分泌量分别降低了12.83%、9.66%和20.80%,这说明虾青素预保护可以一定程度地缓解LPS对RAW264.7刺激带来的炎症反应。
TLR在通过感应微生物对入侵病原体的早期先天免疫应答中起关键作用,并参与感应内源性危险信号。而脂多糖作为细菌细胞壁的组成部分,可以有效激活单核细胞/巨噬细胞。在免疫细胞中,TLR4作为TLR中主要的脂多糖识别的受体,严格调控炎症反应,可以避免LPS刺激所引起的组织损伤以及各种细胞因子的大量产生[13]。当免疫细胞被激活后,TLR4会与包含TIR结构域的衔接蛋白,如MyD88结合[14]。MyD88是TLR4必需的衔接子分子,当受到LPS刺激时,TLR4会与MyD88结合形成TLR4-MyD88复合物,导致转录因子的激活,主要是NF-κB和有丝分裂原激活的蛋白激酶(MAPK)[15-18]。NF-κB是先天免疫,应激反应和炎症的重要转录因子[19],其激活使NF-кB p65亚基从胞质转位至细胞核,与靶基因启动子上的转录原件相结合,诱导多种炎性细胞因子的表达[16]。本试验通过对细胞中 TLR4、MyD88、NF-кB p65 蛋白相对表达量的测定结果显示,LPS组中,细胞的各项检测指标相较于对照组均有所上升且TLR4和NF-кB p65的蛋白相对表达量分别升高了195.40%和226.95%,但MyD88的蛋白相对表达量无显著差异;相较于LPS组,虾青素预保护组中TLR4、MyD88及NF-кB p65的蛋白相对表达量分别下降了54.99%、45.70%和28.20%。由此推测虾青素可能能够负性调控TLR4介导的通路之一,即TLR4/MyD88/NF-кB通路,来减少炎症因子的释放,从而达到缓解炎症的目的。
综上所述,虾青素可以作为一种外源性抗炎的添加物。虾青素预保护可以不同程度地减少脂多糖诱导的炎症因子的分泌量及表达量,降低TLR4、MyD88、NF-кB p65 蛋白的表达来缓解炎症反应,此结果的产生与TLR4/MyD88/NF-кB通路密切相关。
