儿童进行性肌营养不良临床特征及基因分析
2020-08-04陈贤娥陈琅吴丽娟
陈贤娥 陈琅 吴丽娟
[摘要] 目的 对儿童进行性肌营养不良临床特征及基因进行分析。 方法 纳入2013年11月~2019年12月就诊本院的进行性肌营养不良儿童33例,对其临床表现、酶谱检查、肌电图及基因检测等相关资料进行回顾性研究。结果 33例患儿中有30例(90.9%)为男性,3例(9.1%)为女性,其中11例(33.3%)以行走困难,步态异常,肢体无力为主要症状,22例(66.7%)以肌酶、肝酶异常升高为首发症状,伴或不伴有智力发育迟缓。MLPA、NGS-DNA测序或者肌肉活检可明确诊断。基因测序显示其基因缺失部位主要在2个区段,以45~54号及2~20号最为常见,但临床表现与缺失或重复的片段部位无太大相关性。 结论 认识儿童进行性肌营养不良的临床特征及基因突变特点,早期进行基因筛查,为二胎产前诊断提供借鉴,更好实现优生优育,降低本病的发病率及死亡率。
[关键词] 进行性肌营养不良;抗肌萎缩蛋白;儿童;基因筛查
[中图分类号] R746.9 [文献标识码] B [文章编号] 1673-9701(2020)15-0066-03
Clinical characteristics and genetic analysis of children with progressive muscular dystrophy
CHEN Xian'e CHEN Lang WU Lijuan LIN Xin
Department of Pediatrics, Fujian Provincial Hospital Affiliated to Fujian Medical University, Fuzhou 350001, China
[Abstract] Objective To analyze the clinical features and genes of children with progressive muscular dystrophy. Methods A total of 33 children with progressive muscular dystrophy who were treated in our hospital from November 2013 to December 2019 were included, and their clinical manifestations, zymogram, electromyography, and genetic testing were retrospectively studied. Results Of the 33 children, 30(90.9%) were male and 3(9.1%) were female. Among them, 11(33.3%) had difficulty walking, abnormal gait, and limb weakness as the main symptoms, 22(66.7%) had abnormally increased muscle enzymes and liver enzymes as the first symptom, with or without mental retardation. MLPA, NGS-DNA sequencing or muscle biopsy can be used to confirm the diagnosis. Gene sequencing showed that the gene deletion site was mainly in two segments,with 45-54 and 2-20 as the most common.But the clinical manifestations were not much related to the missing or repeated fragments. Conclusion It can provide a reference for the prenatal diagnosis of the second child by recognizing the clinical features and gene mutation characteristics of children with progressive muscular dystrophy and conducting early genetic screening, to realize better outcome of pregnancy and better child-raising, and to reduce the incidence and mortality of this disease.
[Key words] Progressive muscular dystrophy; Anti-dystrophin; Children; Genetic screening
进行性肌营养不良(progressive muscular dystrophy)是逐渐进展的对称性肌无力、肌萎缩、步态异常为主要表现的原发性骨骼肌肉病,常见有杜氏进行性肌营养不良(Duchenne muscular dystrophy,DMD)和贝氏进行性肌营养不良(Becker muscular dystrophy)等[1]。它是编码抗肌萎缩蛋白的基因突变引起的X连锁隐性遗传病。常見有3种突变类型:缺失突变、重复突变、微小突变,以缺失突变最常见,绝大多数是缺失1个或多个外显子[2-3]。这些突变改变基因的阅读框架,影响抗肌萎缩蛋白的合成,导致肌细胞的坏死、肌肉组织纤维化,造成肌无力[4]。通常在3~4岁开始发病,病情进展快,10余岁开始不能行走,一般20~30岁死于呼吸衰竭或心力衰竭[5]。目前尚无有效治疗,因此认识其表型,及早基因筛查,尽早诊断,为产前诊断提供借鉴,以降低本病的发病率及死亡率。
1 资料与方法
1.1 一般资料
纳入2013年11月~2019年12月就诊于福建省立医院的进行性肌营养不良儿童33例的病例资料。符合进行性肌营养不良的临床表现,经多重连接依赖式探针扩增技术(Multiplex ligation- dep-endent probe amplification,MLPA)和二代基因测序(Next generat-ion sequencing technology,NGS)或肌肉活检明确诊断。
1.2 方法
收集患儿的年龄、性别,临床表现、酶谱检测、肌电图、心电图、心脏彩超、基因检测如MLPA或NGS、肌肉活检、家族史、智力情况、治疗及随访情况。
2 结果
2.1 病史资料
33例中,男30例(90.4%),女3例(9.1%);确诊年龄6个月~11岁,平均(6.0±3.1)岁。其中11例(33.3%)以行走困难、步态异常、肢体无力为主要症状,22例(66.7%)以肌酶、肝酶异常升高为首发症状;2例(6.1%)有智力低下,2例(6.1%)有家族史,其中1例是舅舅有类似病史,另1例弟弟也发病。15例(45.4%)Gowers症阳性;22例(66.7%)双侧腓肠肌肥大,3例(9.1%)有鸭步态,2例(6.1%)有翼状肩;33例患者中部分已有不同程度双下肢肌力下降,1例(3.0%)2级,2例(6.1%)3级,1例(3.0%)4级,2例(6.1%)5级,27例(81.8%)正常。
2.2 辅助检查
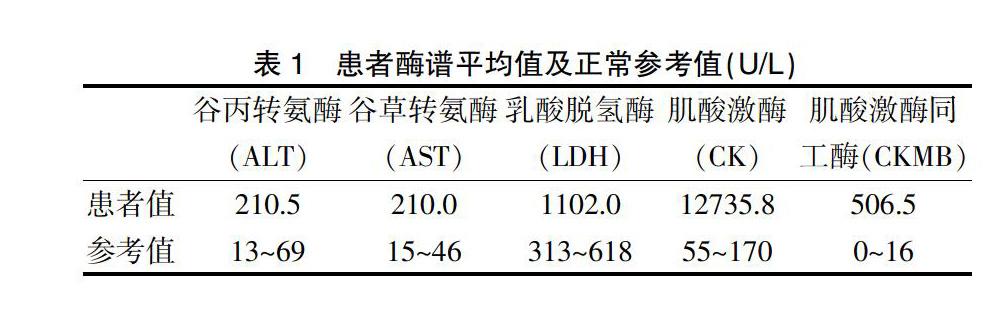
2.2.1 酶谱检测 33例中谷丙转氨酶、谷草转氨酶、乳酸脱氢酶、肌酸激酶、肌酸激酶同工酶均明显升高,数值以平均数(x)表示。见表1。
2.2.2 肌电图 其中25例(75.8%)行肌电图检查,有24例示肌源性损害,1例正常;4例拒绝检查,4例结果遗失。
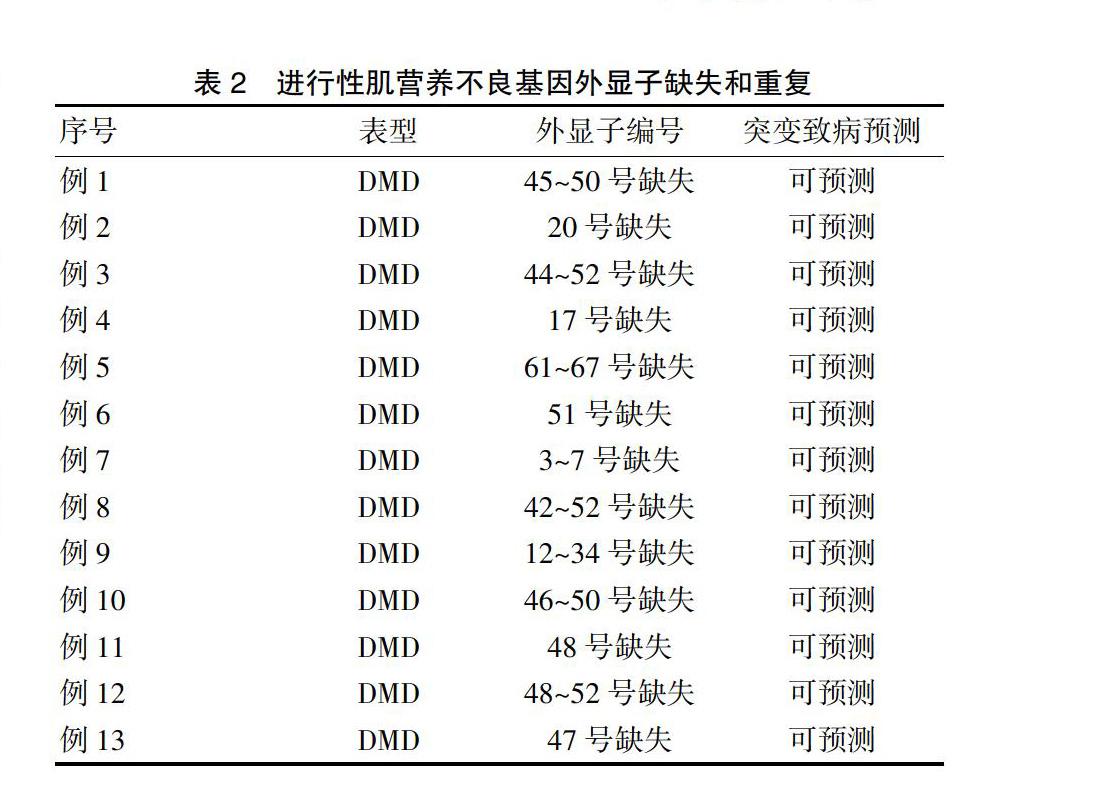
2.2.3 基因检测及肌肉活检 30例(90.9%)根据MLPA技术检测出其基因的外显子缺失或者重复,13例有记录明确突变的位点,其余部分患者资料遗失。其中3例(9.1%)未检测出异常结果,2例(6.1%)进一步行NGS提示异常,有3例(9.1%)行肌肉活检明确有肌细胞坏死、肌肉组织纤维变性。见表2。
2.2.4 心脏彩超及心电图 根据患者情况选择性进行心脏彩超及心电图检查,15例(45.5%)行心脏彩超,其中1例提示肺动脉内径轻度增宽,1例提示左右房内径稍增宽,1例左室前壁运动稍欠协调,左室射血分数稍下降(55%~57%)。17例行常规心电图,其中7例提示窦性心律不齐,4例提示左心室高电压,1例有窦房结-房下部游走性心律,1例有短阵加速性房性自主心律,1例有不完全右束支传导阻滞,V1~V2导联可疑异常Q波。
2.3 治疗
33例均予辅酶Q10或果糖二磷酸营养肌肉治疗,4例予小剂量激素治疗(0.5 mg/kg)[6],但疗效欠佳,病情仍进展。
2.4 随访
随访27例,6例失访,随访率达81%,随访时间3个月~6年不等,12例已不能行走,需卧床、坐轮椅,且其中5例已有肌肉萎缩、关节变形。8例出现行走困难,7例尚只有酶谱异常。
3 讨论
进行性肌营养不良是由抗肌萎缩蛋白基因突变引起,也称为抗肌萎缩蛋白病。由于肌纤维变性是主要的病理过程,故肌无力是主要的症状[7]。其患病率在活产男婴中约为1/5000,因近年随着基因检测的技术逐渐发展,该病的检出率升高[8]。
本研究纳入33例在我院确诊的进行性肌营养不良患儿,多为DMD型,且以男性为主,符合X连锁隐性遗传规律。2例患儿有家族史,同样为男性发病。该研究中有3例女性发病,可能其发病机制上存在X染色体偏移失活[9],女性患儿临床症状轻微,病情相对进展缓慢。发病年龄也具有一定特点,11例出现典型症状及体征的孩子,发病年龄多在3~4岁,22例发病时无肢体无力,行走困难,步态异常等表现,但随访患儿后,发现其部分患儿病情进展,逐渐不能行走。
33例患儿均发现明显的谷丙转氨酶、谷草转氨酶及肌酸肌酶升高,进行分析后发现肝脏酶谱升高在2~3倍以上,肌酸激酶及其同工酶升高在10倍以上,因Ckmb/CK小于10,故考虑肌肉来源的病变为主。研究发现在疾病未出现任何临床症状前,患者就有酶谱升高。本研究中大部分患儿心脏彩超未见明显异常,少数患儿有影响左室的运动及射血分数下降,部分患儿心电图中有左心室高电压,不完全右束支传导阻滞等,但没有特异性改变。考虑随着进行性肌营养不良的过程发展,部分患者出现心电图异常,因心肌纤维化有可能导致心电图的特征性变化,也有可能伴传导障碍,尤其心房内和心房间传导,从而导致多种心律失常(以室上性为主)[10]。此外,心脏线粒体功能障碍会加重,这也是其心脏病变的原因[11]。
目前研究已发现DMD的基因位于Xp21.1,在其中横跨大约230万个碱基,蛋白产量也非常大,分子量为427 kD。是人类已知的最大的基因,有79个外显子[12],所以遗传诊断是治疗的基础。本文有30例患者先进行MLPA技术检测,排查DMD基因缺失或重复,2例再行NGS测序应排除MLPA阴性样品。同时,聚合酶链反应(PCR)用于检测单外显子缺失,以排除点突变引起的MLPA中的假阳性[13]。发现其DMD基因缺失部位主要在2个区段,以45~54号及2~20号最为常见[14],但临床表现与缺失或者重复的片段部位无太大相关性,与表达的阅读框有很明显的相关,若阅读框的表达受影响,则临床的表现及体征明显。肌肉活检虽是诊断的金标准,但不是其适应证,且因其为创伤性检查,故临床的应用相對其他两种少[15]。
目前针对进行性肌营养不良没有特效药,本研究纳入的患儿均使用辅酶Q10或果糖二磷酸片营养肌肉,减缓病变,但病情仍进展。随访的部分患儿使用小剂量激素治疗,但效果欠佳。目前新的治疗方法仍在探索中,其中有针对无意义的突变治疗,是利用一种口服的生物小分子诱导核糖体无意义突变并部分恢复肌营养不良蛋白的产生。此外有框外缺失的反义寡核苷酸[16]、AAV基因疗法等[17],但疗效尚不明确。
目前纳入的病例数有限,随访时间未达到终点,尚需要更多的临床研究进一步探讨。
进行性肌营养不良有其典型的表型及基因突变特征,目前对于其治疗方案尚需要更多研究探讨,本病可以通过基因检测或者肌肉活检确诊,对二胎的产前诊断有益[18-19],进而降低该病的发生率及死亡率。
[参考文献]
[1] Bushby K,Finkel R,Birnkrant DJ,et al. Diagnosis and management of Duchenne muscular dystrophy,part 1:Diagnosis,and pharmacological and psychosocial man-agement[J].Lancet Neurology,2010,9(1):77-93.
[2] Kwon JM,Abdel-Hamid HZ,Al-Zaidy SA,et al.Clinical follow-up for duchenne muscular dystrophy newborn screening:A proposal[J]. Muscle Nerve,2016,54(2):186-191.
[3] Muntoni F,Torelli S,Ferlini A,et al. Dystrophin and mutations:One gene,several proteins,multiple phenotypes[J].Lancet Neurology,2003,2(12):731-740.
[4] 季苏琼,李悦,王琼,等.杜氏肌营养不良症的临床表现与基因表型的关联[J]. 神经损伤与功能重建,2016,11(1):31-34,45.
[5] Mirski KT,Crawford TO.Motor and cognitive delay in Duchenne muscular dystro-phy:Implication for early diagnosis[J].J Pediatr,2014,165(5):1008.
[6] 李婷婷,鄒丽萍.糖皮质激素治疗Duchenne肌营养不良的研究进展[J].中华神经医学杂志,2012,11(11):1182-1185.
[7] Okubo M,Goto K,Komaki H,et al.Comprehensive analysis for genetic diagnosis of dystrophinopathies in Japan[J].Orphanet Journal of Rare Diseases,2017,12(1):149.
[8] Parsons EP,Clarke AJ,Hood K,et al. Newborn screening for Duchenne musc-ular dystrophy:A psychosocial study[J].Archives of Disease in Childhood-Fetal and Neonatal Edition,2002,86(2):F91.
[9] 吴海荣,马祎楠,戚豫,等.携带DMD/BMD基因变异女性的X染色体失活研究[J].第九届全国遗传病诊断与产前诊断学术交流会暨产前诊断和医学遗传学新技术研讨会论文集,2014.
[10] Yoo WH,Cho MJ,Chun P,et al.The evolution of electrocardiographic changes in patients with duchenne muscular dystrophies[J]. Korean Journal of Pediatrics,2017,60(6):196-201.
[11] Gabriella Esposito,Antonella Carsana.Metabolic alterations in cardiomyocytes of patients with duchenne and becker muscular dystrophies[J].Clin Med,2019,8(12):21-51.
[12] Zhong J,Xu T,Chen G,et al.Genetic analysis of the dystrophin gene in children with duchenne and becker muscular dystrophies:Genetic analysis in DMD/BMD[J].Muscle & Nerve,2016,56(1):117-121.
[13] 白莹,李双,宗亚楠.杜氏/贝氏肌营养不良症433个家系的基因突变分析[J].中华医学杂志,2016,96(16):1261-1269.
[14] 贺影忠,韩凤,王纪文,等.Duchenne型进行性肌营养不良临床和基因变异97例分析[J].中国实用儿科杂志,2019,34(1):38-41.
[15] Taylor LE,Kaminoh YJ,Rodesch CK,et al.Flanigan quantification of dystrophin immunofluorescence in dystrophinopathy muscle specimens[J].Neuropathology and Applied Neurobiology,2012,38:591-601.
[16] Nakamura,Akinori.Moving towards successful exon-skipping therapy for duchenne muscular dystrophy[J].Journal of Human Genetics,2017,128:54-56.
[17] Eugenio Mercuri,Carsten G B?觟nnemann,Francesco Muntoni,et al.Muscular dystrophies[J].Lancet,2019,394:2025-2038.
[18] 赵炜,姜楠,李朔,等.假性肥大型肌营养不良症的遗传学分析及产前诊断[J].中华妇产科杂志,2019,54(4):226-231.
[19] 李焕铮,徐晨阳,毛义建,等.50个假肥大型肌营养不良家系的基因突变检测及产前诊断[J].中华医学遗传学杂志,2018,35(2):169-174.
(收稿日期:2020-02-18)
