结晶紫脱色菌ZTS-1的分离鉴定及脱色性能研究
2020-08-03唐豪陈荣清刘虹杉吴丽娜齐思博阎春兰
唐豪,陈荣清,刘虹杉,吴丽娜,齐思博,阎春兰
(中南民族大学 生命科学学院, 武汉 430074)
工业废水中的污染物种类繁多,成分复杂.其中合成染料对环境的影响极为恶劣,分子结构中多含有稳定性极强的苯环,难以在环境中自然降解,使得从工业废水中移除合成染料或使之脱色成为目前染料废水处理过程中面临的主要问题之一[1-3].三苯甲烷类染料是印染工业中应用最为广泛的一类染料,约占所有合成染料中的30%~40%[4].结晶紫是一类典型的三苯甲烷类染料,广泛应用于印染、生物和医学等各个领域.结晶紫分子结构稳定,难降解,具有高残留、高生物毒性和致癌、致畸、致突变作用.许多研究者尝试采用化学还原、物理沉淀或絮凝、光催化氧化、吸附、电化学处理、反渗透和生物降解等多种处理方法来移除废水中的结晶紫染料[5],其中生物解除法作为一种高效低耗、环境友好型处理方式越来越受到广泛关注[6,7].目前细菌降解结晶紫染料的研究相对较少.
本研究从湖北仙桃某皮革厂废水中分离纯化到一株结晶紫高效脱色菌株,对其形态特征、生理特性、脱色可能机制等进行研究,为该菌株在染料废水中的脱色应用奠定了基础.
1 材料与方法
1.1 菌种来源与培养基
菌种来自湖北仙桃某皮革厂废水. 无机盐培养基 (MSM培养基,pH值7.0):1 L 培养基中含有15.13 g Na2HPO4,3.0 g KH2PO4,0.5 g NaCl,1.0 g NH4Cl,0.491 g MgSO4·7H2O,0.026 g CaCl2·2H2O;牛肉膏蛋白胨培养基 (pH值7.4~7.6):1 L 培养基中含有3.0 g牛肉膏,10.0 g蛋白胨,5.0 g NaCl.
1.2 主要仪器与试剂
结晶紫(上海麦克林);dNTPs和Taq聚合酶(Takara),PCR产物及DNA凝胶回收试剂盒(博大泰克). 生化试剂均为分析纯.
Centrifuge5424离心机(Eppendorf);紫外可见光分光光度计(UV2600型,岛津);PCR仪 (T-personal 48,Biometra);自动凝胶图像分析仪(上海培清);引物序列 (表1),均由天一辉远公司合成.
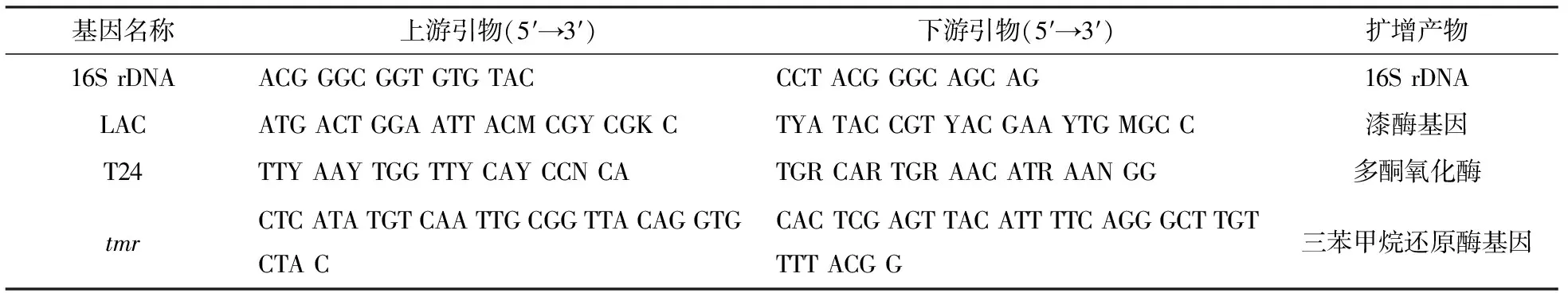
表1 PCR引物
1.3 实验方法
1.3.1 结晶紫脱色菌株的驯化、分离和纯化
取皮革厂废水按10 %的接种量接入加有10 mg/L结晶紫的牛肉膏蛋白胨液体培养基中,30 ℃、180 r/min恒温振荡器中培养一周后,吸取1 mL培养液转接至含20 mg/L结晶紫的牛肉膏蛋白胨液体培养基,连续驯化,转接多次至结晶紫的终浓度为100 mg/L. 取100 μL菌液在含结晶紫的牛肉膏蛋白胨平板上进行涂布检测,观察是否有菌株生长,以及对结晶紫的降解情况,之后在涂布平板上挑取不同形态特征的单菌落,重新转接至含结晶紫的牛肉膏蛋白胨平板上多次划线,直至分离获得单一形态的结晶紫脱色菌株的纯培养物.
1.3.2 菌株的16S rRNA基因的PCR扩增与序列分析
提取菌株的基因组DNA做为PCR模板,采用通用引物16S-F/16S-R进行16S rDNA扩增. PCR扩增条件参考文献[8]. PCR产物回收后送天一辉远测序. 利用Blast软件与该菌株的16S rDNA序列进行比较分析,构建系统进化树. 采用Mega 7.0程序对系统进化树进行分析[9].
1.3.3 菌株的生长实验
采用牛肉膏蛋白胨液体培养基,菌种接种量为5 %,在30 ℃,180 r/min下分别培养0、2、4、6、8、12、16、20、24 h,分光光度计测量OD600值,绘制生长曲线.
1.3.4 菌株的碳源与氮源利用实验[10]
采用MSM基本培养基,菌种接种量为5 %,探究碳源实验时,以0.1 % (W/V) 氯化铵为氮源,分别以葡萄糖、甘露醇、麦芽糖、淀粉、蔗糖、牛肉膏、酵母提取物、蛋白胨、碳酸氢钠作为碳源,加入量为0.5 % (W/V);探究氮源实验时,以0.5 % (W/V) 葡萄糖为碳源,分别以蛋白胨、亚硝酸钠、酵母提取物、硝酸钾、氯化铵作为氮源,加入量为0.1 % (W/V),在37 ℃,200 r/min下培养0、24、48、72 h,测量OD600值.
1.3.5 菌株的生理生化特性
IMViC试验,采用大肠杆菌IMViC生化鉴定试剂盒鉴定菌株的生化特征,其中包括吲哚试验、甲基红试验、伏-普试验和柠檬酸盐试验;
硫化氢试验,将菌株在醋酸铅试管培养基中做穿刺培养,37 ℃温箱培养48 h,观察培养基颜色变化.
淀粉水解试验,将菌株在淀粉培养基上划线接种,37 ℃温箱培养24 h,观察菌种生长情况,在平板上滴加碘液,观察是否出现无色透明圈.
油脂水解试验,将菌株在油脂培养基上划线接种,37 ℃温箱培养24 h,观察菌苔颜色.
尿素试验,将菌株在尿素培养基上划线接种,35 ℃温箱培养48 h,观察培养基颜色变化.
1.3.6 菌株的脱色影响因素研究
(1)培养时间 以牛肉膏蛋白胨为培养基,加入终浓度为20 mg/L的结晶紫,菌液接种量为5 %,30 ℃,180 r/min恒温振荡器培养0、1、2、3、4、5、6、7 d,研究不同时间下菌株的脱色效果.
(2)培养温度 分别设定培养温度为20、25、30、37、40 ℃.
(3)培养基初始pH值 用1.0 mol/L的HCl或NaOH调节培养基的初始pH值至2、4、5、6、7、8、9、10.
(4)接种量 按1 %、2 %、3 %、5 %、7 %、10 %的接种量分别接种到加有终浓度为20 mg/L结晶紫的牛肉膏蛋白胨培养基中.
(5)碳氮源 将供试碳源 (葡萄糖、甘露醇、麦芽糖、淀粉、蔗糖、牛肉膏、酵母提取物、蛋白胨、碳酸氢钠) 分别添加到MSM培养基中,使其终浓度为0.5 % (W/V),以0.1 % (W/V) 氯化铵为氮源;将供试氮源 (蛋白胨、亚硝酸钠、酵母提取物、硝酸钾、氯化铵) 分别添加到MSM培养基中,以0.5 % (W/V) 葡萄糖为碳源.
(2)~(5)接种和培养方法同 (1). 所有的实验均重复3组以上,并同时设置不加菌液的培养基为对照.
1.3.7 菌株脱色前后的紫外-可见光光谱扫描分析
在牛肉膏蛋白胨培养基中添加结晶紫至终浓度为20 mg/L,接种菌株后于30 ℃培养3 d,培养液10000 r/min离心10 min,取上清液,以未接种的含结晶紫的溶液离心后的上清液为对照,进行紫外-可见光光谱扫描.
1.4 脱色率计算[3]
混合培养物在10000 r/min离心10 min后,上清液用分光光度计在580 nm处 (结晶紫的最大吸收峰) 测定吸光度,对照组为同等条件下不接菌组.脱色率通过以下的公式进行计算:
脱色率= (A0-AC)/A0×100 %
(A0:未接种菌液的染料培养基吸光度,AC:接入菌液培养一段时间后的染料培养基的吸光度)
1.5 菌株脱色机理的初步研究
根据菌株16S rDNA分子鉴定的菌株结果,合成简并引物,对菌株中可能与结晶紫脱色相关的基因如三苯甲烷还原酶、漆酶等基因进行PCR验证,并对扩增成功的基因进行回收,测序(天一辉远),与Genbank中序列进行比对. 基因引物如表1所示.
2 结果与分析
2.1 ZTS-1菌株的分离鉴定
经过驯化、分离与纯化,从皮革厂废水中共分离得到6株细菌,经过对结晶紫脱色的初步分析,ZTS-1的脱色效果最好,该菌株为杆菌,G-,菌长在0.8~2.5 μm左右,宽在0.5 μm左右,菌落呈乳白色,边缘圆整,稍隆起,菌落较小,湿润.
将ZTS-1菌株的16S rDNA序列与GenBank中的序列进行比对,发现该菌株与Ochrobactrum属中的多株细菌的相似性均在99%以上;选取同源性高的菌株用于系统发育树的构建,结果如图1所示.从图中可以看出,ZTS-1菌与Ochrobactrum属的多种菌株,如O.intermediumL3、O.intermediumL22、O.intermediumC1 等均聚在一起,细菌序列高度吻合,因此可以鉴定ZTS-1细菌是苍白杆菌属细菌 (Ochrobactrum).
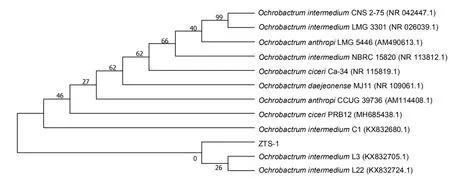
图1 ZTS-1菌株基于16S rDNA序列的系统发育树
2.2 ZTS-1菌株的生长及生理生化特征
从图2-A中可以看出,0~2 h为菌株生长的延滞期,2~16 h为菌株生长的指数期,菌株在此期间生长较为迅速,16 h后菌株进入稳定期.
ZTS-1菌株的碳源利用实验如图2-B所示,对于检测的碳源物质,ZTS-1 菌株不能利用麦芽糖、蔗糖、淀粉、甘露醇、葡萄糖、碳酸氢钠作为碳源物质,能够利用酵母提取物、牛肉膏、蛋白胨等作为碳源,其中以对酵母提取物利用效果最佳;在氮源利用实验(图2-C)中,ZTS-1菌株不能利用亚硝酸钠、硝酸钾和氯化铵作为氮源,可利用蛋白胨和酵母提取物,以对酵母提取物的利用效果最佳.
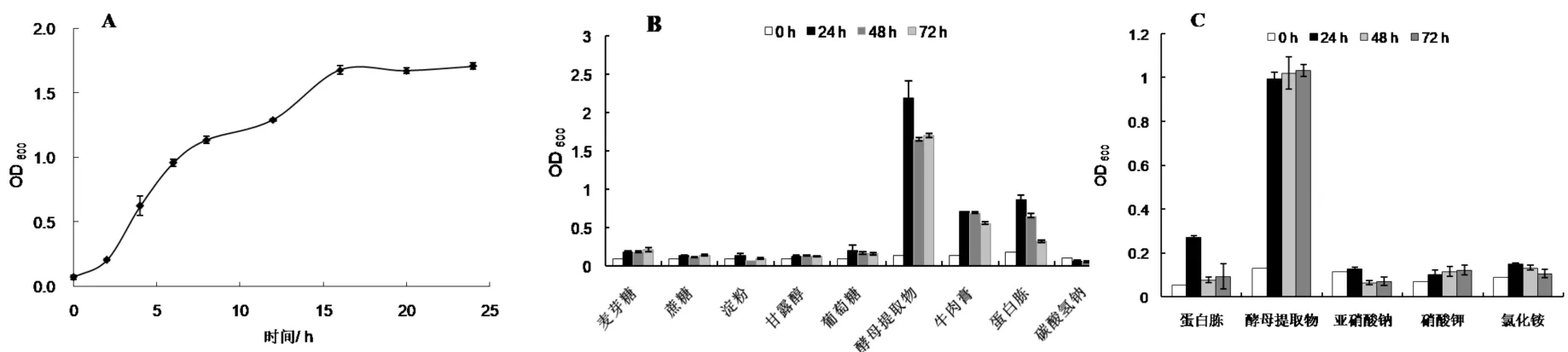
A)生长曲线;B)碳源;C)氮源
ZTS-1菌株的生理生化特征结果如表2所示.在IMViC试验中,吲哚试验结果为阴性,说明该菌株不具有色氨酸酶,不能利用色氨酸;甲基红试验和V.P.试验结果为阴性,说明该菌株在利用葡萄糖的过程中既不能进行混合酸发酵也不能进行丁二醇发酵;柠檬酸盐的结果显示该菌株不能利用柠檬酸盐.

表2 ZTS-1菌的生理生化实验结果
在大分子水解实验中,油脂水解试验结果为阳性,说明ZTS-1菌株可利用油脂,而淀粉水解试验、尿素和硫化氢试验结果均为阴性,说明该菌株不能利用淀粉,不能产生尿素酶,也不能利用含硫化合物产生硫化氢.
2.3 菌株ZTS-1对结晶紫的脱色特性
2.3.1 不同培养时间对脱色的影响
以牛肉膏蛋白胨为培养基,加入终浓度为20 mg/L的结晶紫,菌液接种量为5 %,30 ℃,180 r/min恒温振荡器培养0、1、2、3、4、5、6、7 d. 从图3中可以看出,随着培养时间的延长,菌株ZTS-1对结晶紫的脱色率增加,第5 d时的脱色率最高,达到了59.32%,但是第3 d到第7 d的脱色率之间不具有显著性差异 (P>0.05),即在菌株培养值第3 d就基本达到最大的脱色效果.
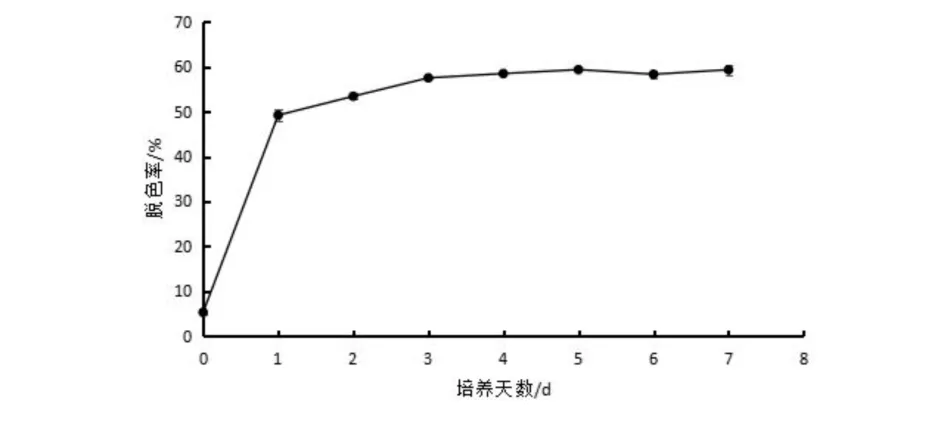
图3 不同培养时间对菌株降解结晶紫的影响
2.3.2 培养温度对脱色的影响
将菌株ZTS-1以5 %的接种量,接种到加有终浓度为20 mg/L的结晶紫的牛肉膏蛋白胨培养基中,培养温度为20、25、30、37、40 ℃,培养3 d后可以看出(图4),温度对菌株ZTS-1的脱色作用具有显著的影响,在20~37 ℃之间,脱色率随着温度的升高而升高,在37 ℃达到了最高的脱色率64.54%;当温度继续升高到40 ℃时,脱色率有所下降,但仍超过了60%,说明该菌株对结晶紫的脱色温度适应性较强.总体上,微生物的生长速率会随着温度的升高而增加,菌株对结晶紫的降解率也会随着温度的升高而升高,过低或过高的温度均会抑制细胞中酶的活性,进而使得结晶紫的脱色率降低[11,12].
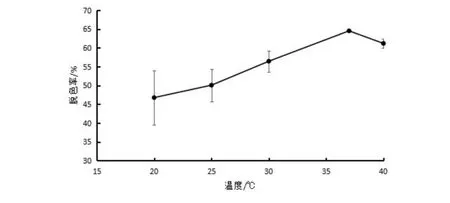
图4 温度对菌株降解结晶紫的影响
2.3.3 培养基初始pH值对脱色的影响
将菌株ZTS-1以5 %的接种量,接种到加有终浓度20 mg/L结晶紫的牛肉膏蛋白胨培养基中,温度为30 ℃,用1.0 mol/L的HCl或NaOH调节培养基的初始pH值至4、5、6、7、8、9、10,培养3 d,从图5中可以看出,pH从4.0增加到5.0时,脱色率呈上升趋势,在pH 5.0时,达到最大值56.90 %;之后随着pH值的上升,脱色率略呈下降趋势.结果表明,pH值在5.0~10.0之间时,菌株ZTS-1对结晶紫有较好的脱色效果,该菌株对菌株脱色的pH适应性较强,实际应用潜力较大.同时pH值偏酸性的环境下菌株的脱色率较高,最适pH值为5. 以往的研究表明,多个属菌株,如Bacillussp.[13]、嗜麦芽寡养单胞菌[14]等对结晶紫的降解或脱色时最适pH值为中性,偏酸或偏碱均会对脱色产生抑制作用. 菌株ZTS-1在偏酸或偏碱的条件下均有较好的脱色效果,pH值适应性较强,在实际应用中潜能较大.
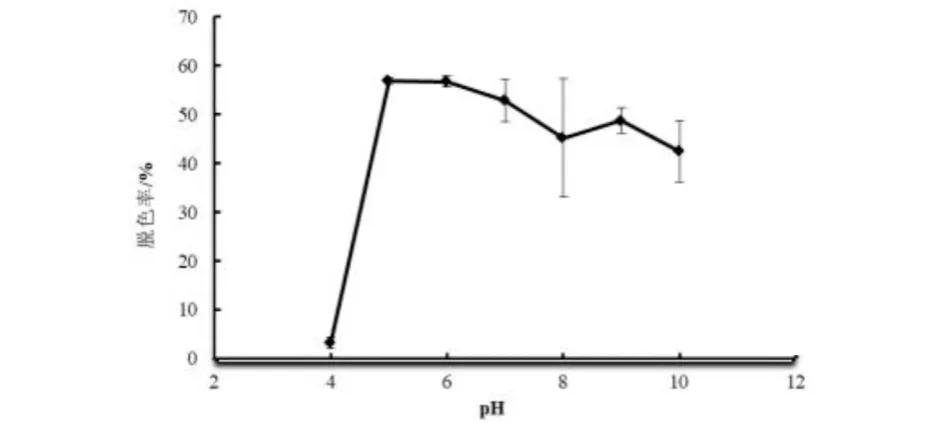
图5 培养基初始pH值对菌株降解结晶紫的影响
2.3.4 不同接种量对脱色的影响
将菌株ZTS-1分别以1 %、2 %、3 %、5 %、7 %、10 %的接种量,接种到终浓度20 mg/L结晶紫的牛肉膏蛋白胨培养基中,30 ℃,培养3 d后测定脱色率, 从图6可以看出,在接种量从1%增加到3%时,菌株对结晶紫的脱色率随着接种量的增加而增加,在接种量为3 %时,菌株的脱色率最高,达到58.40%.进一步增加接种量,不会增加菌株的脱色过程,反而会使菌株的脱色率有所下降,可能与菌体数量的增加,使得菌株对营养成分的竞争加剧,进而在一定程度上抑制了菌株对结晶紫的脱色作用[15];也可能是因为高浓度接种量使得在1~2 d即可能达到最大脱色率,而实验测定的是第3 d时的脱色率,没有体现出来.
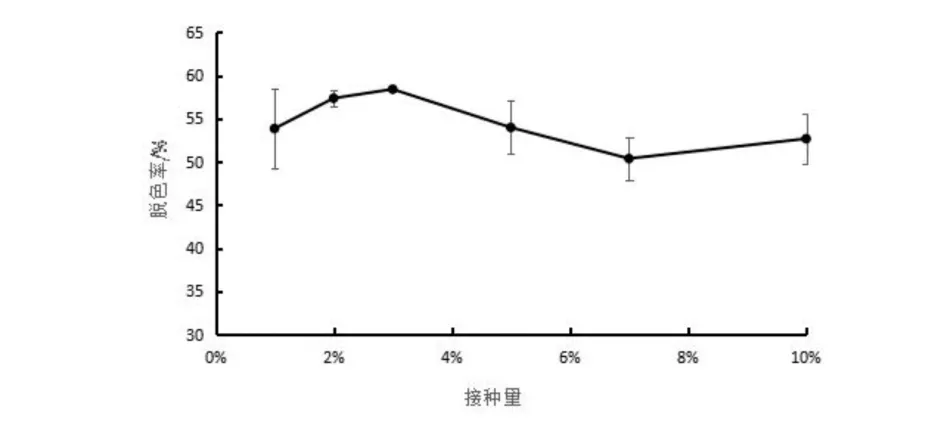
图6 接种量对菌株降解结晶紫的影响
2.3.5 碳氮源对脱色的影响
将菌株ZTS-1分别按5%的接种量,分别接种于含有终浓度为0.5% (W/V)的葡萄糖、甘露醇、麦芽糖、淀粉、蔗糖、牛肉膏、酵母提取物、蛋白胨、碳酸氢钠的MSM培养基中,以0.1% (W/V) 氯化铵为氮源,添加终浓度为20 mg/L的结晶紫,30 ℃培养3 d后测定脱色率,考察碳源对于菌株降解结晶紫的影响;接种于含有终浓度为0.1 % (W/V)的蛋白胨、亚硝酸钠、酵母提取物、硝酸钾、氯化铵的MSM培养基中,以0.5 % (W/V) 葡萄糖为碳源,添加终浓度为20 mg/L的结晶紫,30 ℃ 180 r/min恒温振荡器中培养3 d后测定脱色率,考察氮源对于菌株降解结晶紫的影响,结果如图7所示.
从图7-A可以看出,以酵母提取物为碳源时,菌株ZTS-1的脱色效果最佳,脱色率达到59.53 %,牛肉膏、蛋白胨、蔗糖次之,而以葡萄糖、麦芽糖、淀粉、甘露醇和碳酸氢钠为碳源时,菌株对于结晶紫没有脱色效果,说明碳源对该菌株脱色能力的影响较大;从7-B可以看出以葡萄糖为碳源时,以酵母菌提取物为氮源时脱色率最高,其次是蛋白胨和氯化铵,而以亚硝酸盐和硝酸钾为氮源时,菌株对结晶紫没有脱色效果.也说明外加氮源对菌株ZTS-1脱色能力影响较大.
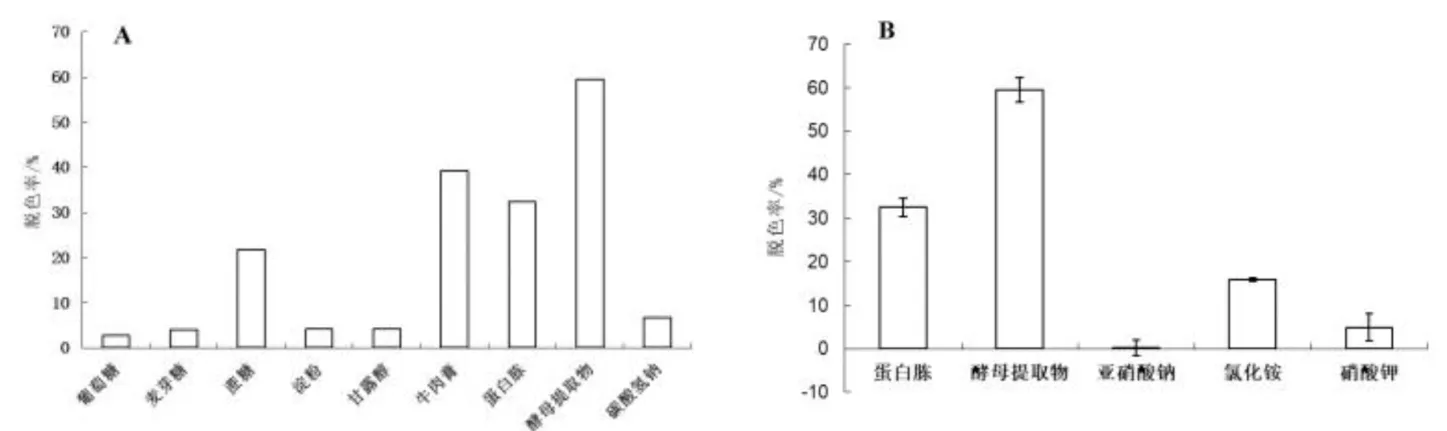
图7 碳源 (A) 和氮源 (B) 对菌株降解结晶紫的影响
综合以上实验条件,在酵母提取物作为碳氮源的MSM培养基中,接种量为3 %,培养基初始pH为5,培养温度为37 ℃,转速为180 r/min恒温振荡器中培养3 d后测定脱色率,发现菌株ZTS-1对于结晶紫的脱色率22.50 %;而牛肉膏蛋白胨培养基中,接种量为3 %,培养基初始pH为5,培养温度为37 ℃,转速为180 r/min恒温振荡器中培养3 d后测定脱色率,发现菌株ZTS-1对于结晶紫的脱色率可达到60.59 %.说明该菌株在对结晶紫脱色过程中对于碳氮源具有一定的依赖性.
除结晶紫外,本实验也测定了ZTS-1菌株对其他色素如果红、甲基红、溴酚蓝、孔雀绿等染料的脱色效果,发现该菌株在接种量为5%,30 ℃, 180 r/min培养3 d时,对20 mg/L的孔雀绿、刚果红也具有一定脱色效果,脱色率分别为81.16%和42.38%,而对于甲基红和溴酚蓝则没有脱色效果.
2.4 菌株ZTS-1的脱色机理分析
图8是菌株ZTS-1的生长细胞对20 mg/L结晶紫脱色前后的紫外-可见光光谱分析.结晶紫在580 nm处有一个特征吸收峰,从图8中可以看出,经过菌株ZTS-1脱色后,结晶紫在580 nm处的特征吸收峰降低,并且在紫外光谱区有新的吸收峰产生.
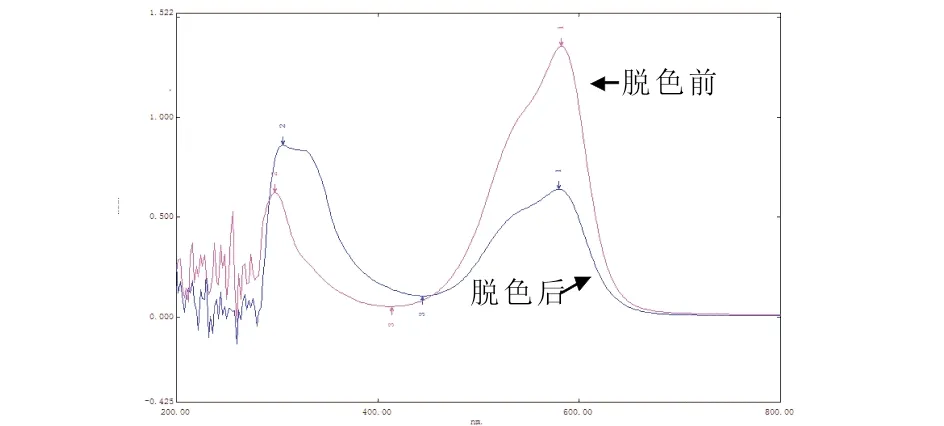
图8 菌株ZTS-1脱色前后的全光谱扫描
微生物对染料的脱色原因可能有两种,生物吸附(或富集)以及生物降解.若经脱色后,染料的特征吸收峰完全消失且产生新的产物吸收峰,则脱色是由生物降解引起;若经过脱色后,染料的全波长扫描图谱中的吸收峰相应降低,但并不产生新的吸收峰,则脱色是由生物富集或者吸附引起的[16,17].实验结果表明,ZTS-1对结晶紫的脱色可能是吸附和生物降解相结合的结果.
对菌株中可能的与结晶紫降解相关的基因,如三苯甲烷还原酶基因、多酮氧化酶、漆酶基因等进行PCR扩增,发现菌株ZTS-1的基因组中存在多铜氧化酶基因和漆酶基因 (图9),但是不存在三苯甲烷还原酶基因 (结果未显示).测序发现菌株ZTS-1中的漆酶蛋白与Ochrobactrumintermedium相似性为97%,与OchrobactrumanthropiATCC 49188 相似性为87 %. 染料微生物降解机理复杂多样,普遍认为是在多种酶的协同作用下完成的,漆酶是其中关键酶之一[18]. 菌株ZTS-1基因组中漆酶基因的存在,结合结晶紫脱色前后的紫外-可见光光谱分析,进一步证明ZTS-1对结晶紫的脱色可能是吸附和生物降解相结合的结果.
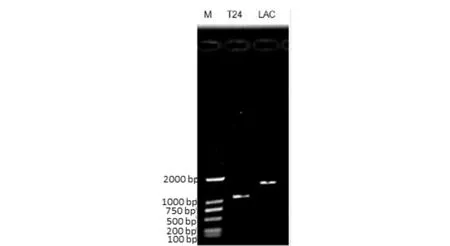
M) BM2000 maker;T24)多酮氧化酶基因;LAC)漆酶基因
3 结语
从湖北某皮革厂分离筛选得到一株结晶紫高效降解菌株ZTS-1,经鉴定属于苍白杆菌属细菌(Ochrobactrum). 该菌株对结晶紫脱色的pH值和温度的适应性范围较广,最适脱色pH为5.0,最适脱色温度为37 ℃,最佳接种量为3 %,供试碳源和氮源对菌株脱色能力影响较大,在最佳脱色条件下牛肉膏蛋白胨培养基中脱色3 d,该菌株对20 mg/L的结晶紫脱色率可达60 %. 经脱色前后的紫外-可见光光谱扫描分析和基因组中结晶紫降解相关酶基因显示该菌株的对结晶紫的脱色可能是吸附和生物降解共同作用的结果.
