一例非洲刺猬子宫内增生性病例的组织学诊断
2020-08-03王子煜张金花胡薛英谷长勤
王子煜 焦 哲 张金花 胡薛英 谷长勤
(华中农业大学动物医学院,武汉,430070)
子宫的增生性病变是人与动物中都较为常见的疾病。目前的组织学分类将子宫增生性病变分为上皮性肿瘤和间质肿瘤以及混合上皮和间质肿瘤[1]。
上皮性肿瘤包括子宫内膜增生、子宫内膜息肉、子宫内膜腺瘤与腺癌。在人类中,子宫内膜增生是一种非常重要的癌前病变。但是在家畜中这种观点不被认可,因为在家畜中,子宫内膜增生,尤其是囊性子宫内膜增生十分常见[2]。腺瘤非常罕见,它由大量增生的腺体构成,与腺癌、子宫内膜息肉和子宫腺肌症的病灶非常难以区分[3]。除家兔外,子宫内膜腺癌在家畜中并不多见[4-5]。但人的子宫内膜腺癌却普遍存在[3]。家畜的子宫内膜腺癌最常发生于年龄大的奶牛。偶尔在雌性的羊(Capra)、马(Equus)、猪(Sus)、狗(Canis)和猫(Felis)中也有报道[6-12]。子宫内膜息肉常见于犬和猫,是由子宫内膜腺和间质成分的局灶性增生组成,可为单个或多个,通常以有蒂或无蒂的方式向子宫内突出,但是子宫内膜息肉并不被当作任何一种癌前病变[13-14]。在大多数动物生殖道肿瘤中,以平滑肌瘤最为常见。子宫的肿瘤多为间质性肿瘤,其中平滑肌瘤占85%—90%,平滑肌肉瘤占10%,纤维瘤、纤维肉瘤和脂肪瘤则较为罕见[10,15-17]。
本病例记录了1只来源于非洲刺猬(Atelerixalbiventris)的子宫内多发性的增生性病变,组织学诊断并分析其发病特点,现将组织学诊断结果报告如下,旨为哺乳动物纤维肉瘤的诊断提供新的依据,为哺乳动物子宫增生性病变丰富资料。
1 材料与方法
2018年1月华中农业大学兽医院送检1例非洲刺猬子宫角赘生物至病理实验室进行诊断,该刺猬年龄4岁,雌性。就诊时发现其阴道内有血性分泌物,手术摘除卵巢及子宫。
主要试剂:鼠抗人PCK单克隆抗体、鼠抗人α-SMA单克隆抗体,封闭液(30%山羊血清)和显色液(DAB)购于武汉博士德生物技术有限公司;鼠抗人Ki-67单克隆抗体及配套免疫组化抗原修复缓冲液及HRP标记的羊抗鼠/兔IgG,购于基因科技(上海)股份有限公司。
组织切片的制作:组织经4%多聚甲醛固定,切取多个肿块,乙醇梯度脱水,常规石蜡包埋,4 μm连续切片,分别进行H.E.染色及免疫组织化学染色。
免疫组化染色步骤:将切好备用的4 μm石蜡切片烤片备用,切片经二甲苯、乙醇梯度脱蜡至水,滴加内源性过氧化物酶阻断剂,封闭内源性过氧化氢酶,0.01M PBS洗涤2次;将PCK、α-SMA玻片放入枸橼酸盐缓冲液中,Ki-67玻片放入稀释的抗原修复缓冲液中,蒸汽热修复,在100℃保持30 min,取出自然冷却;滴加山羊(Caprahircus)血清白蛋白封闭非特异抗原抗体,封闭30 min后甩掉封闭液,滴加配好的一抗(PCK、α-SMA、Ki-67),以PBS代替一抗作为阴性对照,4℃过夜;次日,PBS洗涤2次后滴加HRP标记的二抗室温作用30 min;PBS洗涤后DAB显色,苏木素衬染,中性树胶封片。使用Nikon 80i生物光学显微镜与图像采集系统观察采集图像并分析。
免疫组化阳性率分析:当阳性染色出现在细胞核中,无论强度大小,均考虑为阳性反应。通过对组织切片的整体观察进行评估,取阳性较强且均匀的多块区域拍摄400倍照片,计算所选视野1 000个以上瘤细胞中阳性细胞核的比例。
2 结果
2.1 大体病变
肿块充满一侧子宫角,子宫角扩张肿胀,内含有大量黑红色血液(图1A)。肿块淡黄色,体积约2 cm×1 cm×1 cm,表面可见丰富的血管,肿块通过纤细的蒂部与子宫角黏膜相连,连接处的浆膜面可见有一隆起(图1B)。
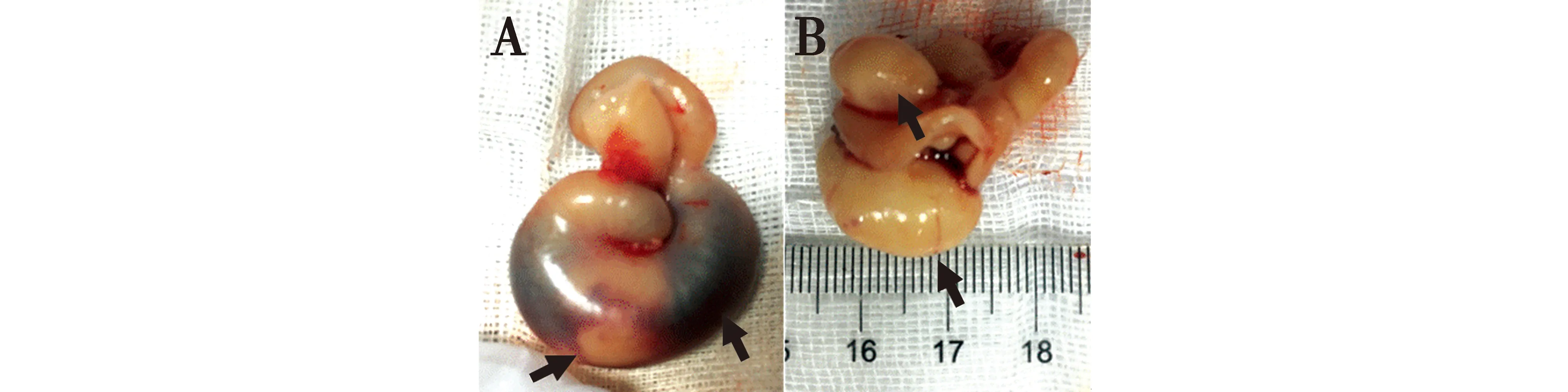
图1 子宫肿块的大体病变Fig.1 The gross lesion of uterine mass
2.2 组织学观察
H.E.染色结果显示肿块有一层厚厚的包膜,包膜由嗜酸性强,排列密集的梭形细胞构成,该细胞分化良好无明显异型性,最外层附着有红细胞。包膜内瘤组织由大量梭形细胞构成,细胞呈旋涡状、人字形排列,瘤细胞排列较疏松,细胞核大,深染,核仁不明显。并含有大量的脂肪细胞,胶原纤维的数量在组织内高度可变,瘤组织含有丰富的血管,部分血管壁增厚,并在组织内发现大量肌样团块(图2A,图2B)。免疫组织化学α-SMA染色发现,包膜由平滑肌细胞构成,且肌样团块与增生的血管壁均由平滑肌细胞构成(图2C)。

图2 子宫内肿块的诊断Fig.2 Diagnosis of intrauterine mass
显微镜下观察结果显示,在浆膜面隆起的部分,肿块位于子宫角肌层,结构上是一个巨大的空腔,空腔有一肿块,该空腔的腔壁由柱状上皮细胞构成,肿块的最外层同样由柱状上皮覆盖,肿块内子宫内膜腺大量增生,部分子宫内膜腺出现明显的囊性扩张。在肿块内还发现了多个纤维团块,由旋涡状排列的成纤维细胞样细胞与稀疏的胶原纤维构成(图3A)。免疫组织化学PCK染色示子宫内膜腺上皮阳性(图3B)。
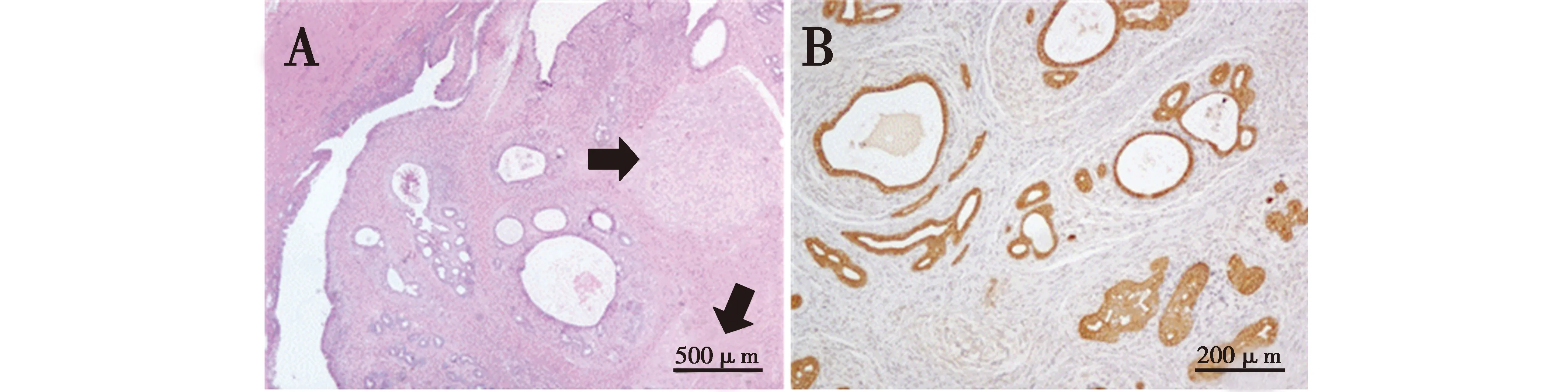
图3 子宫壁肿块的诊断Fig.3 Diagnosis of uterine wall mass
子宫角内肿块免疫组织化学Ki-67阳性率为33.3%(图4A),PCNA阳性率为61.5%(图4B),表达量均较高,表示细胞增殖速度较快。
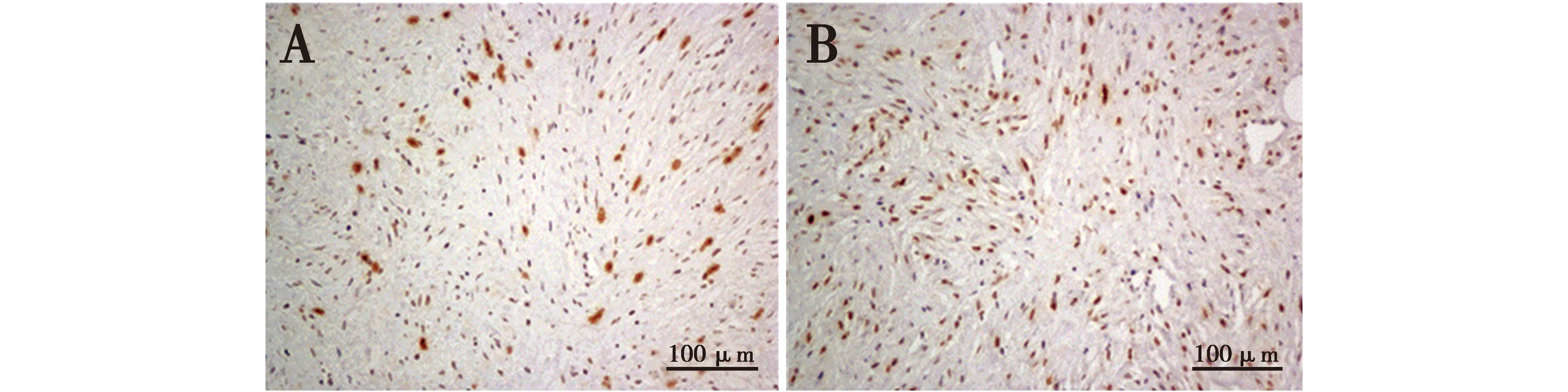
图4 免疫组织化学Ki-67与PCNA染色Fig.4 Immunohistochemistry Ki-67 and PCNA staining
3 讨论
近年来,非洲刺猬逐渐成为一种受欢迎的家庭宠物,子宫肿瘤在这种动物中很常见[2]。
在本病例中,肿瘤本身具有纤维肉瘤常见特征,通过免疫组化对平滑肌肌动蛋白的染色,排除平滑肌肉瘤的干扰即可确诊。肿块边缘是由一层较厚的平滑肌形成的包膜,并且有平滑肌构成的蒂部与子宫壁相连,可推测肿瘤发生于子宫的肌层。在肌层内,出现了一个子宫内膜间质息肉,与一般的子宫内膜间质息肉不同的是,它没有向子宫内凸起,而是局限在肌层内。对于刺猬这种动物而言,子宫内同时存在多种成分的增生性病变是常见的,在一项对15只非洲雌性刺猬的子宫增生性病变研究中发现,这些刺猬的发病年龄在3—5岁,所有的病例均伴有阴道出血的症状,其中8例是多发性病变,包含多个成分[18],且在本病例中发病年龄与症状也与文献中一致。
我们发现息肉所在的位置正位于子宫内肿块蒂部的下方。因此我们推测纤维肉瘤的发生早于息肉,纤维肉瘤膨胀性的生长模式,使得其填满了整个子宫角,而位于其下方形成的息肉则因无法向子宫内脱出而在肌层局限性地生长。且在息肉的间质内,发现了纤维肉瘤团块,与子宫内纤维肉瘤结构相同,这也说明了2个增生性的病变起源于同一位置,或是纤维肉瘤向息肉内发生了转移。
在对纤维肉瘤的诊断中,为了加强其恶性程度的判断,我们采用免疫组化Ki-67与PCNA的染色进行分析,结果显示Ki-67与PCNA表达量均较高,说明其恶性程度高。Ki-67是一个重要的细胞增殖标记物,对很多常见的肿瘤疾病的诊断及预测有重要的帮助,目前广泛地应用于预测各种肿瘤疾病的病情进展[19],Ki-67表达于所有活跃的细胞周期阶段,在细胞核内的定位复杂又有特异性,并随细胞周期改变而改变[20]。在细胞周期的G1期及S期早期,Ki-67的表达水平较低,在S期及G2期其表达急剧增加,在M期表达水平达到峰值,随后在细胞分裂后期和末期其表达量迅速下降。Ki-67单克隆抗体标记G1后期S期和G2期M期细胞核抗原,而G0期G1早期的细胞核不被标记,且Ki-67抗原半衰期短,细胞脱离增殖周期后迅速降解这些特点使Ki-67成为优质的细胞增殖标记物[21]。PCNA是真核细胞DNA合成所必需的一种核蛋白,它在G1期PCNA的表达逐渐增加,S期达最高峰,而G2/M期则减少,PCNA的表达可能是DNA多倍体形式表达的一个标记,也成为肿瘤细胞失调状态下的一个标记[22-23],检测PCNA可以客观评价肿瘤细胞增殖状态。
在本病例的纤维肉瘤中,我们发现许多肌样的区域,并且发现了许多血管,这些血管的管壁明显增厚。通过免疫组化SMA的染色,显示这些肌样区域属于平滑肌,以及血管增厚的管壁同样属于平滑肌。这与一种隆突性皮肤纤维肉瘤中的肌样型非常相似,肌样型是隆突性皮肤纤维肉瘤的一种亚型[24-27]。但是对于这种肌样区域的来源却颇有争议,有的文献中认为,肌样区域来源于肿瘤细胞,是纤维母细胞向肌纤维母细胞分化而形成的,属于肿瘤的成分[25]。而另外有文献显示,肌样区域来源于血管的平滑肌细胞的增生,因为它们在肌样区域中发现了狭窄的血管腔隙[26-27]。在国内一篇文献中对15例肌样型隆突性皮肤纤维肉瘤进行了研究,该研究发现了肌样区域形成的过程,由早期的血管平滑肌细胞增生,到肌样团块的形成。研究结果也表明了肌样区域来源于血管的平滑肌细胞[28]。本病例中相同的发现,也说明肌样型的纤维肉瘤不仅仅出现于人皮肤纤维肉瘤中,在动物的子宫内纤维肉瘤也会出现这种变化。这种变化或许可以成为纤维肉瘤诊断的一个证据。
