白凤菜总黄酮对急性髓系白血病Kasumi-1 细胞株增殖和凋亡的影响
2020-07-29刘慧丽阙文忠林燕燕林泽燕徐文鑫蔡阳艳
刘慧丽,阙文忠,林燕燕*,林泽燕,徐文鑫,蔡阳艳
(1. 漳州卫生职业学院医学技术系转化医学检测应用技术协同创新中心,福建 漳州 363000;2. 福建医科大学附属南平第一医院风湿免疫科;3. 漳州卫生职业学院药学系)
急性髓系白血病(acute myeloid leukemia,AML)是一类髓系造血干/祖细胞恶性疾病,以骨髓与外周血中原始和幼稚髓性细胞异常增生为主要特征。尽管治疗方法和新技术不断优化和发展,绝大多数患者预后仍不理想[1-2]。因此,迫切需要新的药物来辅助治疗、提高疗效。从植物中开发出低毒、高效甚至高度特异性的靶向药物一直是临床热点之一。植物总黄酮(TFG)具有抗氧化、抗肿瘤等多种活性,尤其在抗肿瘤的开发中具有潜在的价值。有文献报道其在乳腺癌、肺癌、食管癌等实体瘤细胞体外实验均有诱导凋亡的作用[3-6],但对血液系统的肿瘤研究鲜见报道。本课题组从白凤菜(Gynura formosanaKitam.)中提取了TFG,旨在体外观察 TFG 对 AML Kasumi-1 细胞的增殖及凋亡的影响。
1 材料与方法
1.1 主要试剂与仪器 Kasumi-1 细胞由福建医科大学天然药物药理学重点实验室惠赠;RPMI 1640培养液、磷酸盐缓冲液和胎牛血清购于美国Gibco公司;噻唑蓝(MTT)细胞凋亡试剂盒、Annexin V-FITC/PI 凋亡试剂盒、线粒体膜电位试剂盒、细胞周期试剂盒购自上海碧云天公司;荧光显微镜、多功能酶标仪购自美国Thermo Scientific 公司;流式细胞仪购自美国BD 公司;倒置显微镜购自日本Olympus 公司。
1.2 方法
1.2.1 TFG 的制备 白凤菜由台湾引种,TFG 的制备参见文献[7]。根据亚硝酸钠-硝酸铝-氢氧化钠比色法使样液显色,测定吸光度[8],计算样液中的 TFG 含量为 2.76 mg/ml。
1.2.2 细胞培养 将Kasumi-1 细胞接种于含10%胎牛血清的RPMI 1640 培养液中,37 ℃、5%CO2、湿度饱和的恒温培养箱中培养,每 1 ~2 d 传代1 次,取对数生长期细胞为实验对象。
1.2.3 细胞抑制率检测 使用MTT 法检测细胞体外增殖。以5×103个/孔的密度将细胞接种于96 孔板 100 μl 的培养基中,设 4 个重复孔,利用高压灭菌的蒸馏水稀释TFG,使各组TFG 至终质量浓度分别为 0、6.25、12.5、25、50、100 μg/ml 并分别培养24、48 h。空白对照为无细胞培养基,有Kasumi-1 细胞而未添加TFG 的孔为阴性对照组(100 μl)。随后,在每个孔中加入 10 μl MTT 溶液(5 mg/μl 溶解于 PBS),将其放回细胞培养箱中继续孵育 4 h。每孔加入 100 μl Formazan 溶解液,适当混匀,在细胞培养箱内继续孵育 3 h,直至Formazan 全部溶解。随后酶标仪在570 nm 测定吸光度,重复3 次,计算细胞存活率和抑制率。细胞存活率 =(A实验- A空白)/(A对照- A空白)×100%;抑制率=1-细胞存活率。
1.2.4 细胞形态学观察 收集对数生长期细胞,以5×105个/孔接种于6 孔板,设置各实验组TFG终质量浓度为 0、6.25、12.5 和 25 μg/ml,于37 ℃、5% CO2培养箱中孵育24 h,随后在倒置显微镜下进行细胞形态学观察并拍照。
1.2.5 线粒体膜电位检测 将Kasumi-1 细胞用TFG 终质量浓度为 0、6.25、12.5 和 25 μg/ml 作用 24 h 后,1 000 r/mim 离心 5 min,弃上清,收集细胞,用PBS 轻轻重悬细胞并计数。取1×105重悬的细胞,1 000 r/mim 离心 5 min,弃上清,加入188 μl Annexin V-FITC 结合液轻轻重悬细胞。加入 2 μl Mito-Tracker Red CMXRos 染色液、5 μl Annexin V-FITC,轻轻混匀。室温避光孵育20~30 min,孵育过程中重悬细胞2~3 次,随后置于冰浴20 min,1 000 r/mim 离心 5 min,收集细胞,用100 μl Annexin V-FITC 结合液轻轻重悬细胞,荧光显微镜下随机选择视野拍照。
1.2.6 细胞凋亡检测 取处于对数生长期的Kasumi-1细胞,以 5×104个/ml 接种 3 ml/孔于 6孔板,培养箱中孵育过夜。各组分别用0、6.25、12.5 和 25 μg/ml 的 TFG 作用于细胞 24 h 后各自收集培养体系内全部细胞,1 200 r/min 离心 5 min,弃上清,加入 195 μl Annexin V-FITC 结合液轻轻重悬细胞,依次加入 5 μl Annexin V-FITC、10 μl 碘化丙啶(PI)染色液,轻轻混匀。室温(20~25 ℃)避光孵育 10 ~20 min,随后置于冰浴中,随后充分混匀入流式细胞仪检测。
1.2.7 细胞周期检测 取处于对数生长期的Kasumi-1细胞,制备细胞悬液 5×104个/ml,接种3 ml/孔于 6 孔板,各组分别用 0、6.25、12.5 和25 μg/ml 的 TFG 作用于细胞,培养箱中孵育 24 h。随后收集各培养体系中全部细胞,1 000 r/min 离心5 min,弃上清,加入1 ml 预冷 PBS 重悬细胞,离心收集细胞,加入1 ml 冰浴预冷70%乙醇,吹打混匀,4 ℃ 固定 2 h,随后 1 000 r/min 离心 3 min,弃上清,预冷 PBS 洗涤 2 次,每管细胞样品中加入0.5 ml PI 染色液,缓慢并充分重悬细胞沉淀,37 ℃避光温浴 30 min。充分混匀后,进样于流式细胞仪检测计算 G0/G1、S、G2/M 期所占百分比。
1.3 统计学方法 采用SPSS 21.0 软件进行统计学分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析、t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 TFG 对Kasumi-1 细胞体外增殖抑制的影响与对照组比较,TFG 作用 24 h 后 12.5 μg/ml 及以上浓度实验组,TFG 作用 48 h 后 6.25 μg/ml 及以上浓度实验组,Kasumi-1 细胞抑制率呈现出显著差异(P<0.05),呈浓度依赖效应。分别以24和48 h 的抑制率对TFG 浓度绘制生长抑制曲线,可得 TFG 对 Kasumi-1 作用 24 h 和 48 h 的 IC50分别为 18.80 μg/ml 和 7.9 μg/ml。见图 1。

图1 TFG 对Kasumi-1 细胞体外的生长抑制率
2.2 TFG 对Kasumi-1 细胞形态的影响 Kasumi-1细胞易成团生长;随着 TFG 质量浓度的升高,Kasumi-1细胞团数量减少,形态皱缩,边缘粗糙,胞体缩小,胞体折光度减小,内含物减少。见图2。
2.3 细胞荧光凋亡检测 对照组中细胞核排列相对紧密,核染色质分布均匀,发出红色荧光,未见绿色凋亡荧光细胞;6.5 μg/ml TFG 实验组中细胞数量、排列及荧光与对照组比较无明显差异,可见散在绿色凋亡荧光细胞;与对照组比较,12.5 μg/ml TFG 实验组中细胞数量减少,较多细胞出现明亮绿色荧光细胞,表明部分细胞的细胞膜受损;25 μg/ml TFG 实验组中细胞数量下降明显,细胞胞体不均一,部分发生染色质凝集和细胞膜破损,出现较多明亮绿色荧光细胞。见图3。
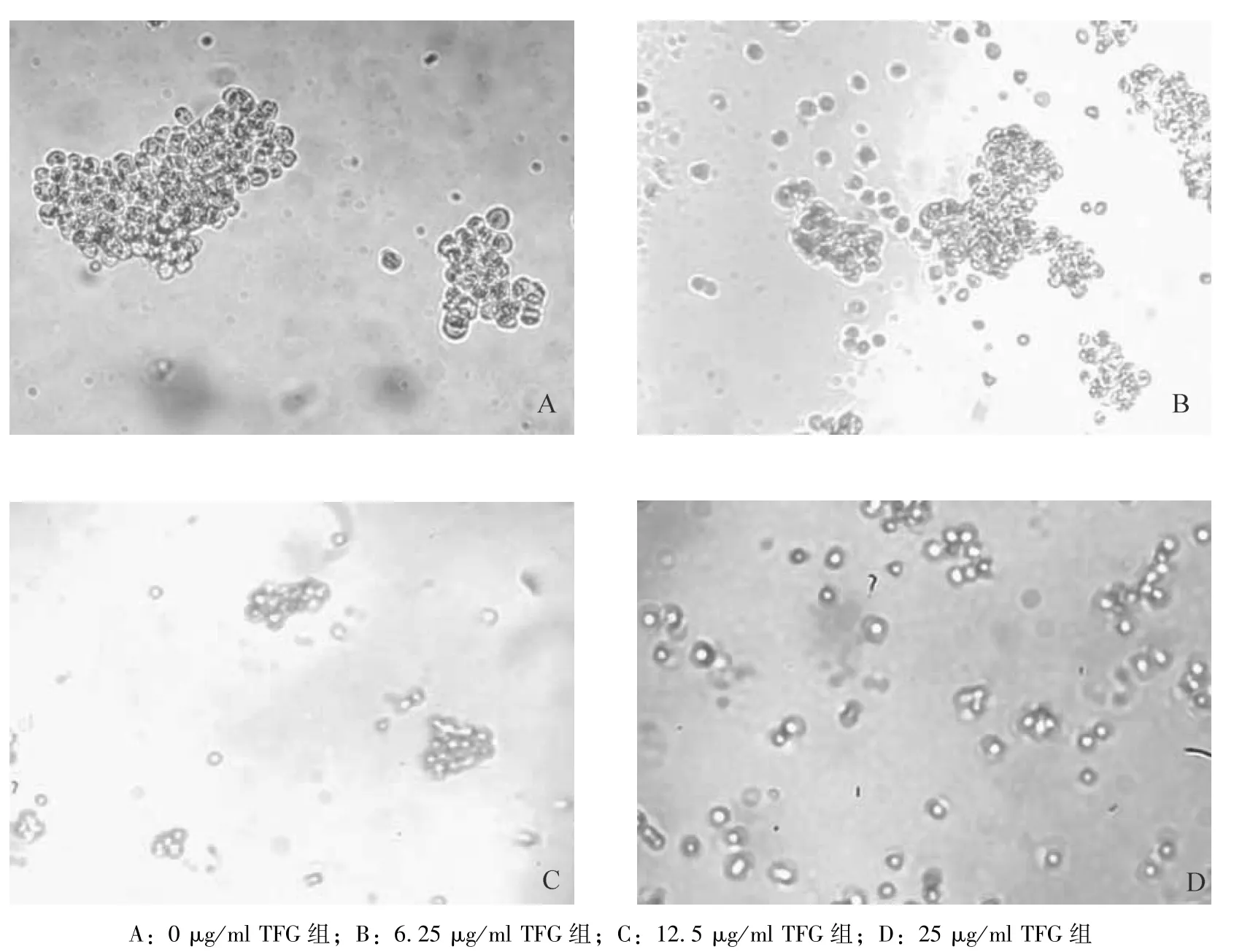
图2 倒置显微镜下观察Kasumi-1 细胞经TFG 处理24 h 后细胞形态的变化(×100)
2.4 TFG 对Kasumi-1 细胞凋亡的检测 Kasumi-1细胞经 TFG 处理 24 h 后,0、6.25、12.5 和 25 μg/ml TFG 组细胞凋亡率分别为(2.2±0.2)%、(38.7±1.9)%、(50.6±3.7)%和(93.0±8.2)%;与对照组比较,随着TFG 质量浓度的升高,细胞凋亡比例逐渐增加(P<0.05)。见图4。
2.5 TFG 对Kasumi-1 细胞周期分布的影响 TFG处理 24 h 后,6.25、12.5 μg/ml TFG 实验组与对照组S 期、G2/M 期细胞比例比较差异无统计学意义;但 25 μg/ml TFG 实验组的 S 期细胞比例高于对照组,G2/M 期细胞比例低于对照组(P<0.05)。见图 5。

图3 荧光显微镜下观察Kasumi-1 细胞经TFG 处理24 h 后细胞形态的变化(×100)

图4 Kasumi-1 细胞经TFG 处理24 h 后细胞凋亡情况
3 讨论
自然来源的营养素能有效消除癌症细胞,探索天然、高效和低毒的药物进行长期的辅助抗癌具有重要意义。在本课题组前期研究中已经证实TFG 对肝癌HepG2 细胞亦有明显的诱导凋亡作用[7],TFG 作用 24 h 及 48 h 的 IC50分别为 190.80 μg/ml 和 125.96 μg/ml。而本研究结果显示 TFG作用 Kasumi-1 细胞 24 h 及 48 h 的 IC50分别为18.80 μg/ml 和 7.9 μg/ml。在线粒体膜电位荧光凋亡检测中显示,随着TFG 的浓度升高,磷酯酰丝氨酸(phosphatidylserine,PS)从质膜的内部外翻到细胞表面即细胞膜外侧,从而使PS 暴露于细胞外部,与带有绿色荧光的FITC 标记的Annexin V 染色,结果显示绿色荧光细胞随药物作用的浓度增加细胞凋亡明显。流式凋亡检测结果与线粒体膜电位检测结果一致。细胞周期检测表明TFG可影响Kasumi-1 细胞周期分布,使细胞周期阻滞于 S 期。
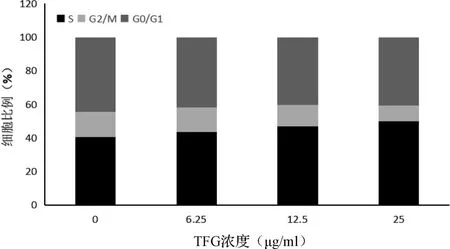
图5 Kasumi-1 细胞经TFG 处理24 h 后细胞周期的变化
综上所述,一定质量浓度的TFG 可抑制Kasumi-1 细胞活性并诱导其凋亡,待进一步研究作用机制及动物实验后,为研究和开发 TFG 作为抗AML 的天然药物提供理论基础。
