超声微泡介导肿瘤免疫治疗的机制及其应用
2020-07-27谢茜刘小慧刘朝奇刘蓉赵云
谢茜 刘小慧 刘朝奇 刘蓉 赵云
1三峡大学医学院(湖北宜昌443002);2宜昌市中心人民医院超声科(湖北宜昌443002)
肿瘤的发病率和死亡率很高,是全球第2 大死亡原因,据2018年统计全球约有960 万人死于肿瘤[1]。肿瘤的常规治疗方法有:手术治疗、放疗和化疗,临床应用均取得了较好实效且治疗水平在不断提高,但肿瘤复发、全身不良反应和耐药性仍然是现阶段影响治疗效果的的主要因素[2]。因此,寻找新的肿瘤治疗方法仍是目前的研究热点。肿瘤细胞在生长过程中,常通过不同机制来抑制人体的免疫系统,介导肿瘤免疫逃逸,产生免疫耐受。肿瘤免疫治疗就是通过重新启动并维持肿瘤-免疫循环,恢复机体正常的抗肿瘤免疫反应,达到抑制或杀灭肿瘤细胞的目的。与其他治疗策略相比,肿瘤免疫治疗具有对肿瘤细胞高度特异性而不损害正常细胞的独特优势,因此,可以减少放、化疗引起的不良反应[3]。在免疫治疗过程中,患者的免疫系统通过使用具有长期治疗效果的免疫刺激物质而被激活和增强。此外,免疫疗法可以诱导宿主免疫系统的记忆效应,从而预防复发[4]。然而,免疫治疗的有效性往往受到向肿瘤细胞传递分子不足和积累低的限制,但若盲目加大系统给药浓度,又容易引起一系列的自身免疫性疾病。
超声微泡是一种靶向性、非侵入性、高效、新颖的基因/药物递送系统,其中微泡可作为基因/药物载体或基因/药物递送增强剂。可以增加细胞膜通透性、短暂打开紧密连接的血脑屏障、血-肿瘤屏障,并促进细胞内吞作用,从而为免疫治疗药物、基因和其他大分子进入内皮细胞和跨生物膜的药物递送提供了瞬时且可逆的通道,药物、基因、抗体和细胞因子可以直接输送到靶组织中,从而增强免疫反应,因此超声微泡介导肿瘤治疗具有广阔的应用前景[5]。本文主要就超声微泡介导肿瘤免疫治疗的机制及其应用进行综述。
1 肿瘤免疫治疗
在肿瘤微环境中,肿瘤细胞可通过不同的方式逃避免疫系统的监视,同时抑制人体免疫系统,介导肿瘤免疫逃逸,使肿瘤细胞得以生存。肿瘤免疫治疗通过传递免疫刺激分子,激活了人体的抗肿瘤免疫反应,使其能够直接攻击肿瘤细胞,但不伤害正常细胞。肿瘤免疫治疗可以分为两种类型:主动免疫治疗和被动免疫治疗。主动免疫治疗是指免疫反应是由抗原(如肿瘤疫苗)产生的,而被动免疫治疗是指特定的免疫物质,如抗体或致敏的淋巴细胞,重新注射到宿主体内,在没有任何抗原的情况下获得特定的免疫反应。肿瘤免疫治疗可通过不同的方式介导,如:肿瘤疫苗;单克隆抗体,免疫检查点抑制剂:抗程序性死亡蛋白1(programmed death 1,PD-1)抗体等;传递细胞因子:白细胞介素(interleukin,IL)、调节性T 细胞等;以及过继细胞转移,包括自然杀伤细胞(natural killer cell,NK)和嵌合抗原受体T 细胞(chimeric antigen receptor T-cell,CAR-T)等[6]。近年来,免疫疗法取得了很大进展,在临床试验中提高了晚期肺癌、转移性黑色素瘤、淋巴瘤等患者的总体生存率[7]。检查点抑制剂,如抗PD-1 抗体,已被证明在非小细胞肺癌临床应用中非常有效[8]。树突状细胞(dendritic cells,DC)疫苗也被美国食品药品监督管理局批准用于治疗去势抵抗的前列腺癌[9]。此外,随着抗原特异性T 细胞受体基因和嵌合抗原受体基因转导淋巴细胞技术的发展,过继T 细胞转移也在不断发展[10]。然而肿瘤免疫治疗仍然存在以下不足:重组蛋白和核酸容易被血液或靶组织中存在的酶降解;治疗物质难以通过生物屏障(即血管内皮、质膜等);以及不易在间质组织中扩散。
2 超声微泡
超声微泡作为一种新的药物载体,它是由外周静脉注射,然后经过肺循环进入人体组织,具有非侵入性,安全性高;近年来微泡装载基因成为研究热点。首先利用基因工程技术将基因负载到载体DNA 上,然后带正电荷的超声微泡通过静电吸附作用装载重组质粒,避免基因在血液循环中的降解,提高了肿瘤部位的药物浓度以及减少了全身毒副作用;超声辐照将随血液循环到达病变部位的微泡击破,使药物局部释放于靶组织或靶器官,具有被动靶向性,同时,以生物素链霉亲和素为桥梁,可将肿瘤特异性抗体结合在微泡表面,携带肿瘤特异性抗体的微泡可主动靶向于肿瘤部位。超声微泡载药作为一种有效的非侵入性、靶向给药和基因递送技术,其在肿瘤免疫调节物质递送方面的应用比较广泛。超声微泡外壳由具有稳定性的脂质、聚合物、糖或蛋白质物质等材料构成,可以降低表面张力和毛细血管压力,且不易被体内的酶所降解,有利于其通过血液循环进入细胞并避免其包裹的药物和基因等在血液循环中的降解。其内部由SAFE,C3F8,C4F10 等惰性气体构成,降低了其在血液中的溶解度,延长了使用寿命[11]。临床批准的微泡尺寸<10 μm,此范围内的微泡可以进入血管系统[12]。超声微泡可穿透生物屏障,包括血管内皮、间质、细胞膜、血脑屏障/血-肿瘤屏障,并促进治疗成分在间质组织中的扩散[13]。
3 超声微泡介导肿瘤免疫治疗机制
3.1 空化效应在超声辐射下,微泡可产生线性震荡和非线性震荡两种效应,这两种效应又称为非惯性空化和惯性空化。惯性空化是空化的关键机制,惯性空化的特征是微泡突然膨胀,然后微束使气体微泡迅速塌陷,微束在微管表面产生剪切力,使微泡变形甚至破裂,从而使微泡周围产生一种称为微流的液体流动的振荡现象。由微泡破坏引起的能量可以引起各种生物效应,例如细胞膜上的暂时开放,促使增强机体免疫的药物和基因进入细胞,随后增强宿主体内的抗肿瘤免疫反应[14]。空化效应也能使细胞膜内的抗原暴露,诱导树突状细胞将抗原信息呈递给淋巴组织中未成熟的T 细胞使其活化,发挥抗肿瘤免疫反应。微泡的空化效应可以触发许多细胞生物效应,尤其是增强细胞内吞作用,使分子量较大的免疫佐剂进入细胞。根据最近的一项研究表明,细胞内Ca2+增加可以立即激发内吞作用以重新封闭细胞膜[15]。FAN 等[16]发现,随着空化效应的发生,细胞内Ca2+浓度会升高,并在大约100 s 内逐渐恢复到正常水平。
3.2 声辐射力在声波的作用下,微气泡向声波的传播方向移动,即声辐射力。声辐射力可使细胞间隙疏松,影响血管壁的稳定性。研究[17]表明,在声辐射力的作用下,微泡的黏附率可以增加60 ~80 倍,提高微泡对靶组织的靶向性,减少全身毒副作用。同时声辐射力影响脂质双分子层的流动性,扩大内皮细胞间隙,增加毛细血管的通透性,将免疫调节物质高效传递于肿瘤组织。声辐射力可增强基因转染,辅助肿瘤免疫细胞进入肿瘤组织[18]。
3.3 热效应超声辐照可使肿瘤组织温度在短时间内增加到100 ℃左右,使肿瘤组织发生不可逆性坏死,坏死的肿瘤碎片具有抗原性,形成原位疫苗,诱导T 细胞活化和细胞因子的产生。同时热效应可诱导热休克蛋白的产生,热休克蛋白在免疫调节中发挥重要作用,可激活由CD91 受体介导的特异性免疫应答。此外还可引起Th1 细胞介导的细胞免疫反应。MOYER 等[19]在高强度聚焦超声(high-intensity focused ultrasound,HIFU)消融大鼠肝脏的实验过程中,证实了超声微泡可增强肝脏表面的局部热效应。
3.4 声学液滴蒸发效应与传统的充气剂相比,由液体全氟化碳组成的液滴在循环中的存活时间更长。在足够的负压下,液滴可以蒸发成纳米级微气泡,这种现象通常被称为声学液滴蒸发效应[20]。将液滴转化为气态微泡所需的压力取决于液滴的大小和使用的全氟化碳的类型,以及介质中的压力和温度[21]。一般来说,连续的微血管结构和致密的正常内皮细胞间隙使免疫药物递送受到阻碍。相比之下,肿瘤组织周围的渗漏血管表现出不均匀的高通透性,导致高分子物质穿透并滞留在肿瘤组织中,即增强渗透和滞留(enhanced permeation and retention,EPR)效应(图1)。研究表明直径<200 nm 的纳米颗粒由于EPR 效应,更易渗透于肿瘤组织[22]。因此依赖于声学液滴蒸发效应的纳米液滴更易穿透于肿瘤组织的狭小空间,提高组织药物浓度,延长药物半衰期,在药物输送中的应用受到了广泛关注。研究[23]表明携带miRNA-134 的纳米液滴显著增加了IFN-γ和TNF-α的表达,抑制CD86 的表达,从而增强抗肿瘤免疫反应。
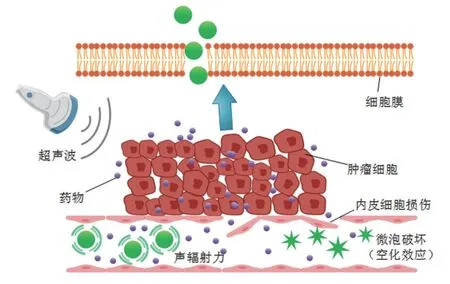
图1 微泡的作用机制Fig.1 Mechanism of microbubble
4 超声微泡介导肿瘤免疫治疗的应用
超声微泡已被广泛应用于增强免疫调节物质的传递,如肿瘤疫苗、单克隆抗体、细胞因子和过继细胞,从而增强免疫治疗的效果(表1)。
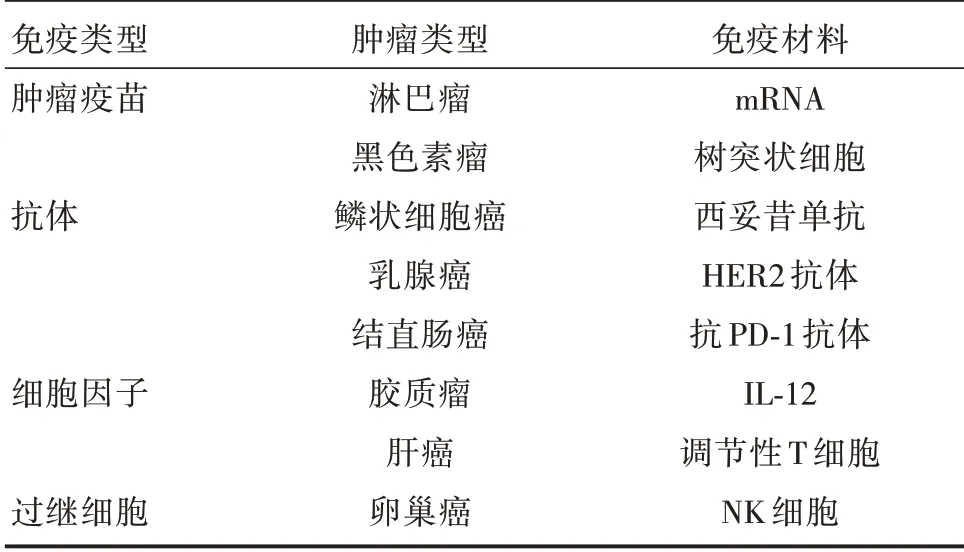
表1 超声微泡介导肿瘤免疫治疗应用总结Tab.1 Application summary of ultrasound microbubble mediated tumor immunotherapy
4.1 超声微泡介导的肿瘤疫苗肿瘤疫苗的有效原因是因为高效率的肿瘤相关抗原进入宿主抗原提呈细胞(antigen presenting cells,APCs),APCs 表达特异性受体,CD80,CD40 等,同时APCs 在趋化因子的作用下游走于淋巴组织,活化T 淋巴细胞。肿瘤疫苗的主要优点是毒性小,产生高度特异的适应性免疫反应,并建立免疫记忆。肿瘤疫苗可分为以下类型:肿瘤多肽类疫苗、全细胞疫苗[肿瘤细胞疫苗和树突状细胞(dendritic cell,DC)疫苗]、基因工程疫苗等。其中,DC疫苗最常用于肿瘤免疫治疗,其具有高效的抗原提呈效应,激活细胞毒性T 淋巴细胞。在DC 疫苗治疗过程中,DC 负载肿瘤抗原并激活机体的DC 至关重要。研究[24]表明超声微泡可增强转染,有利于肿瘤细胞中提取的抗原导入DC,且可促进DC 分化成熟。ODA等[25]使用超声微泡将肿瘤抗原导入DC,结果表明,超声微泡处理的DC 预防性免疫可使黑色素瘤肺转移的发生率降低4 倍。近年来编码肿瘤抗原的mRNA 作为肿瘤疫苗成为热点,已进入临床研究,包括非小细胞肺癌、黑色素瘤等。mRNA 疫苗不必进入细胞核,可以在未分裂的细胞(如树突状细胞)中进行mRNA 转染,从而获得快速和瞬时的蛋白表达,且行使过功能的mRNA 可以降解,减少了毒副作用,此外,使用mRNA不需要整合到宿主基因组。WANG 等[26]在侵袭性淋巴瘤模型中,静脉注射装载有编码卵白蛋白(ovalbumin,OVA)mRNA微泡,可引起强烈的特异性免疫反应,并减缓肿瘤生长。
4.2 超声微泡介导的抗体免疫治疗超声微泡介导的抗体免疫治疗可分为以下两类:抗肿瘤抗体和检查点抑制剂。抗体除了靶向于肿瘤组织,抑制肿瘤细胞增殖外,还能阻断免疫抑制信号,通过抗体依赖的细胞毒性作用引导NK 细胞杀伤靶细胞,诱导免疫细胞对靶细胞的破坏。然而,以抗体为基础的免疫治疗在实体肿瘤中的效率较低,因为抗体很难富集于肿瘤内,生物利用度很低。超声微泡可携带抗体,避免其在血液循环中降解。西妥昔单抗是一种特异性靶向人表皮生长因子受体的单克隆抗体,NARIHIRA 等[27]在口腔部鳞状细胞癌的实验中,证实了超声微泡载西妥昔单抗对口腔部鳞状细胞癌的抑制作用较单独给药增加了5 倍。CENTELLES 等[28]发现短时间的超声辐照可快速增加HER2 抗体在阳性乳腺癌脑转移的聚集,并显著抑制了它的生长速度。除了直接针对肿瘤表达分子的抗体之外,阻止检查点介导的抑制T 细胞反应的抗体在肿瘤治疗领域的作用日益突出。抗PD-1 抗体(anti-PD-1 antibody,aPD-1)是一种重要的检查点抑制剂,可以阻断PD-1 与其细胞毒性T 细胞上的配体的结合,解除免疫耐受。BULNER 等[29]发现与单一治疗相比,aPD-1 与超声微泡的结合显示出显著肿瘤抑制和延长动物生存时间的潜力。
4.3 超声微泡介导的细胞因子免疫治疗细胞因子免疫治疗的目的是将细胞因子高浓度输送到肿瘤,诱导强大的抗肿瘤免疫反应。IL 可以作为免疫刺激分子,触发抗肿瘤免疫反应,且已被批准用于临床。然而,系统给药时的细胞毒性和一过性自身免疫,限制了其临床应用。IL-12 是由DC 和巨噬细胞产生的蛋白,在免疫调节和抑制肿瘤血管生成中起着最重要的作用。CICCHELERO 等[30]通过超声微泡联合IL-12 治疗9 只患有自发性肿瘤的犬,然后连续进行免疫学、抗血管生成和临床疗效评价。发现超声微泡联合IL-12 使肿瘤的相对血流量和血流速度与基线相比显著降低。CHEN等[31]应用聚焦超声诱导血脑屏障的暂时性开放和随后IL-12 的安全释放,发现该方法诱导了T 细胞依赖的免疫反应,激活了局部免疫反应。调节性T细胞(regulatory T cells,Treg)对肿瘤相关的APCs具有抑制作用,如使DC 失去刺激配体,导致T 细胞无法激活,介导免疫耐受。SHI 等[32]证实超声和微泡在促进Treg 增殖方面具有协同抑制效应,并且在10%微泡,超声指数为1.4 的情况下,超声照射150/180 s 获得了最佳的Treg 转移率。
4.4 超声微泡介导的过继细胞免疫疗法过继细胞疗法是将人工合成免疫细胞注入患者体内,增强肿瘤微环境中免疫反应。但是大量的过继细胞注入体内会导致不可预知的副作用,如发热和过敏反应。且运送到靶区的细胞数量太少,不能起到有效杀灭肿瘤细胞的作用。超声波可打开生物屏障,为促进过继细胞运送到肿瘤部位提供了一种新的方法。超声微泡介导过继细胞中使用最广泛的免疫细胞是NK 细胞。NK 细胞是一种细胞毒性T 淋巴细胞,在天然免疫系统中发挥着强大的抗肿瘤作用。此外,NK 细胞可以通过抗原依赖的方式诱导肿瘤细胞凋亡。YANG 等[33]证实了超声微泡可以改善NK 细胞在卵巢肿瘤中的过继浸润。且通过实时PCR 证实其是通过趋化因子配体1 进入肿瘤细胞。
5 总结与展望
超声微泡介导的肿瘤免疫治疗为肿瘤治疗提供了一种新颖的有效治疗方式。超声微泡输送免疫刺激物质,实现了抗肿瘤免疫反应。但微泡在体内的半衰期较短,导致超声触发能力较差。此外,基因和药物载体的低系统细胞毒性、高特异性和持久性,以及良好的生物利用度,对优化给药技术具有临床挑战性。超声微泡引发生物效应的许多潜在机制还没有完全了解,还需要进一步的研究来阐明其机制。且超声微泡介导的肿瘤免疫治疗仍处于基础实验阶段,需进一步深入研究。
