己糖修饰的糖基化卵清蛋白产物及其致敏性分析
2020-07-26毛积华涂宗财钟比真
毛积华 王 辉 涂宗财 钟比真
(1. 南昌大学食品科学与技术国家重点实验室,江西 南昌 330047;2. 江西师范大学功能有机小分子教育部重点实验室,江西 南昌 330022)
食物过敏是由于食物的特定成分(通常是蛋白质,也可能是化学半抗原)被人体免疫细胞识别并引发特异性免疫反应导致的过敏症状,其机理可分为免疫球蛋白E (IgE) 介导、非IgE介导和混合型介导[1]。目前大部分食物过敏为IgE介导的,在食物摄入后的1 h内产生过敏症状,但也有免疫球蛋白G (IgG) 介导的案例[2]。目前,引起过敏的食物至少有160种,其中90%以上的食物过敏都是由鸡蛋、牛奶、鱼、贝类、花生、其他坚果、大豆和含麸质的谷类食品造成的[3]。
卵清蛋白(ovalbumin, OVA) 是蛋清中含量最高的蛋白[4],是一种由385个氨基酸组成的水溶性蛋白,等电点为4.5,分子量为45 kDa,具有免疫调节等生物活性[5]。此外,OVA同时含有的疏水基团和亲水基团赋予其优良的乳化性、起泡性和凝胶性,故一直被用作乳化剂、起泡剂和胶凝剂等[6-7]。
糖基化是美拉德反应的前期阶段,是食品加工中经常发生的反应。糖基化反应能改变食物过敏原的功能特性[8]和过敏特性。Li等[9]研究表明,以乳清分离蛋白与麦芽糖质量比1.04∶1,于60.8 ℃反应54.3 h时,乳清分离蛋白显现出最低的抗原性。研究[10-11]表明,当温度为40~80 ℃,相对湿度为60%~85%时,糖基化反应的接枝效果最好。试验拟以OVA和不同己糖(果糖、葡萄糖、半乳糖)为原料,在相对湿度74%、65 ℃反应3 h,采用理化分析和光谱分析等方法研究糖基化OVA自由氨基含量、表面疏水性、紫外吸收光谱、内源和同步荧光光谱以及IgG/IgE结合力的变化规律,探究不同己糖在最适糖基化修饰条件下对OVA糖基化反应及其IgG/IgE结合能力的影响,旨在为OVA的致敏性降低提供一定方法参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
卵清蛋白:GradeⅤ,美国Aldrich-sigma公司;
L-赖氨酸:Vetec优级纯,美国Aldrich-sigma公司;
葡萄糖(≥98%)、果糖(≥99%)、半乳糖(≥99%):上海阿拉丁生化科技股份有限公司;
大耳兔:雄性,3月龄,重量2 kg左右,南昌龙平兔业有限公司;
IgE所用一抗:6个鸡蛋过敏病人血清(其相关信息见表1),美国Plasmalab公司;

表1 鸡蛋过敏病人信息
其他试剂均为国产分析纯。
1.1.2 主要仪器设备
电子天平:ML 104/02型,梅特勒—托利多仪器(上海)有限公司;
数显恒温水浴锅:HH-4型,常州爱华仪器制造有限公司;
pH计:PHS 25型,上海仪电科学仪器股份有限公司;
酶标仪:Synergy H1型,美国伯腾仪器有限公司;
紫外分光光度计:U-2910型,日本日立高新技术公司;
荧光分光光度计:F-7000型,日本日立高新技术公司。
1.2 方法
1.2.1 样品制备 OVA分别与葡萄糖、半乳糖、果糖以质量比2∶1溶解于PBS溶液(0.1 mol/L,pH 8.0),冻干,于65 ℃,相对湿度74%的糖基化反应模型中反应3 h,冰浴30 min,透析,将样品浓度调至1 mg/mL,于-20 ℃冰箱备用。葡萄糖、半乳糖、果糖糖基化产物分别命名为O-glc、O-gal、O-fru。
1.2.2 接枝度的测定 参照Nielsen等[12]的方法并略作修改。准确称取7.62 g硼砂、0.2 g SDS和176 mg DTT溶解于150 mL蒸馏水中,0.16 g OPA溶于4 mL无水乙醇中,混匀,定容至200 mL。取50 μL质量浓度为4 mg/mL的样品与1 mL OPA混合,避光反应2 min,测定340 nm处吸光值。按式(1)计算接枝度。
(1)
式中:
DG——接枝度,%;
A0——未糖基化的OVA吸光度值;
A1——糖基化OVA吸光度值。
1.2.3 表面疏水性的测定 参照Xiang等[13]的方法并略有修改。用PBS(10 mmol/L, pH 7.4) 将样品稀释至0.125,0.250,0.500 mg/mL,取4 mL样品与20 μL ANS溶液 (8 μmol/L) 混合,于荧光风光光度计中扫描。激发波长370 nm,狭缝宽度5 nm,发射波长400~600 nm,扫描速度600 nm/min,将荧光强度对蛋白浓度作图进行拟合,其斜率即表面疏水性。
1.2.4 紫外光谱扫描 样品稀释至1 mg/mL,狭缝宽度1.5 nm,扫描速度1 200 nm/min,扫描波长250~350 nm。
1.2.5 荧光光谱扫描 样品稀释至1 mg/mL,内源荧光扫描条件为激发波长290 nm,扫描速度1 200 nm/min,狭缝宽度5 nm,扫描波长250~450 nm;同步荧光扫描条件为扫描速度1 200 nm/min,狭缝宽度5 nm,激发波长275~350 nm或230~350 nm,激发与发射波长间隔(λ) 15 nm或60 nm。
1.2.6 兔抗OVA血清的制备 将4只大耳兔平均分成两组,分别命名为空白对照组(1号和2号兔)和抗原注射组(3号和4号兔),喂养5 d无异常后开始免疫。采用静脉注射,注射所用试剂和耗材均为无菌级。具体步骤为:用10 mmol/L,pH 7.4的PBS溶液将99%的OVA稀释至3 mg/mL,第一次免疫加等体积弗氏完全佐剂进行乳化,并按1 mg/只的量沿兔耳缘静脉注射进行免疫。初次免疫后的第2,4,6周分别使用等量的弗氏不完全佐剂乳化OVA,按0.5 mg/只进行加强免疫3次。第7周时沿兔耳缘静脉采血1 mL,参照李雪[14]的方法测量兔血清效价。效价>10 000,表明抗体水平较高,可停止继续免疫,从心脏大量采血[15]。将采集到的全血倾斜于37 ℃烘箱中平衡0.5 h,然后于4 ℃冰箱过夜,6 000 r/min离心10 min,用已灭菌的离心管分装于-40 ℃冰箱备用[16]。
1.2.7 IgG/IgE结合能力的测定 参照Yang等[17]的方法并稍有修改。IgG所用一抗为实验室自制兔抗OVA血清。将100 μL 4 μg/mL的OVA加入酶标板中,37 ℃孵育2 h,用PBST洗板3次,每次5 min。再加入250 μL 1%鱼明胶,37 ℃封闭2 h。同时将等量的兔抗OVA血清(PBST稀释至1∶60万)与样品(PBST稀释至2 μg/mL)于离心管中混匀,37 ℃预孵育1 h。封闭结束后洗板,再将100 μL预孵育的样品与血清混合液加入酶标板中,37 ℃孵育1 h,洗涤。将100 μL辣根过氧化物酶标记的羊抗兔IgG酶标二抗(PBST稀释至1∶5 000)加入酶标板,37 ℃孵育1 h,洗板,加入100 μL TMB显色液,37 ℃孵育15 min,最后加入100 μL的2 mol/L硫酸,测定450 nm处吸光度。
IgE结合能力测定与IgG的相似,不同之处在于IgE所用封闭液为5%脱脂奶粉,样品、一抗人血清与羊抗人IgE酶标二抗分别用封闭液稀释至1 μg/mL、1∶20和1∶400。IgG和IgE结合能力用抑制率表示,并按式(2)计算。
(2)
式中:
In——抑制率,%;
A、A0——分别表示含有样品的吸光度和阳性对照孔(用抗体稀释液代替样品)的吸光度。
1.2.8 统计学分析 采用SPSS 25.0对试验数据进行统计学分析,采用GraphPad Prism 8进行绘图分析,所有试验均重复3次。
2 结果与分析
2.1 接枝度
由图1可知,O-fru的接枝度仅为1.1%,O-glc与O-gal的接枝度分别为34.2%,37.7%,与O-fru的差异显著,3种己糖在干热条件下与OVA发生糖基化修饰反应的活性程度为半乳糖>葡萄糖>果糖。半乳糖、葡萄糖分子中含有醛基,而果糖含有酮基,醛基中的羰基碳比酮基中的更亲电,更易发生亲电取代反应[18],因此,含醛基的半乳糖、葡萄糖比含酮基的果糖发生糖基化修饰反应的活性更高。Chen等[19]发现在等湿度β-lg糖基化系统中,葡萄糖发生糖基化反应的活性大于果糖,与试验结果一致。
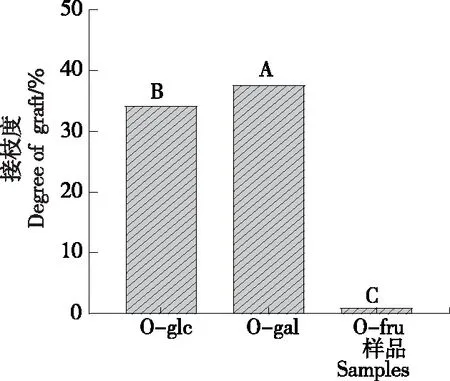
字母不同表示差异显著(P<0.05)
2.2 表面疏水性
由图2可知,与OVA相比,糖基化OVA的表面疏水性明显降低,可能是OVA在糖基化过程中由于加热而解折叠,然后通过疏水相互作用聚集,使其表面疏水性降低[20],或者是因为糖基化过程中己糖分子对赖氨酸和精氨酸的封闭作用,阻断了疏水氨基酸和ANS探针间的连接。其中,相比于O-fru和O-glc,O-gal的表面疏水性下降得最少,可能是半乳糖C4碳原子的L构型抑制了OVA的疏水相互作用,使表面疏水性下降的趋势减弱。
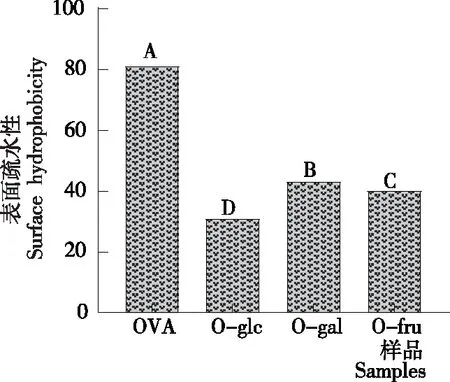
字母不同表示差异显著(P<0.05)
2.3 紫外吸收光谱
由图3可知,还原糖修饰的OVA的最大吸收峰出现在278 nm附近,吸光度主要取决于色氨酸和酪氨酸残基。与OVA相比,糖基化OVA的紫外吸光度值都有不同程度的上升,由OVA的0.591上升至O-gal的0.818,可能是因为反应过程中己糖分子的接入,蛋白质分子部分展开,引起构象变化,色氨酸与酪氨酸残基在糖基化反应过程中逐渐暴露于蛋白分子表面,从而增加了糖基化产物的吸光度值,与Liu等[21]的结果一致。3种不同还原糖修饰的反应物中,O-glc的吸光值略高于O-fru,O-gal的吸光值最高,表明在相同的反应条件下,半乳糖修饰的OVA的紫外吸收增强较多,可能是半乳糖诱导的糖基化反应更剧烈,对构象破坏较大,解折叠过程中更多芳香族氨基酸被释放,导致紫外吸收增多。
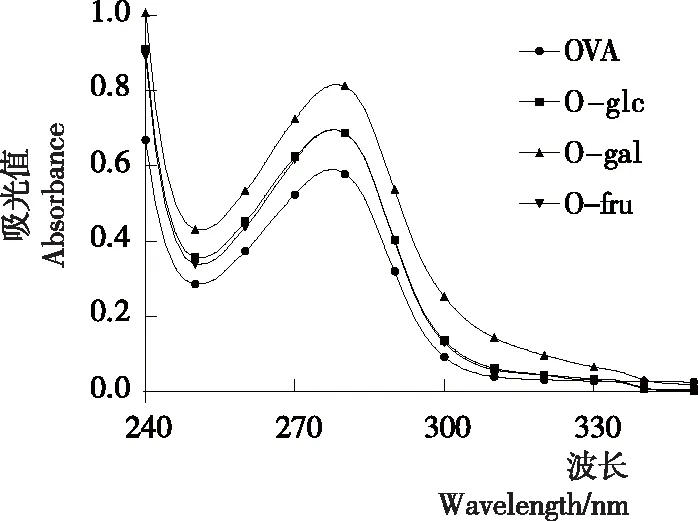
图3 己糖修饰的卵清蛋白紫外吸收光谱
2.4 荧光光谱
由图4可知,与OVA相比,糖基化OVA的荧光强度峰值逐渐降低,从OVA的319.3降低至O-gal的249.2,可能是OVA构象被糖基化反应逐渐改变的过程中,OVA荧光发色团被暴露在极性环境中,与极性溶剂水发生了荧光猝灭,导致荧光强度降低[22]。O-fru的荧光强度高于O-glc和O-gal,表明果糖在糖基化过程中对OVA构象改变不大,可能是因为相比于醛糖,酮糖的反应趋势更缓和,对构象造成的影响较小。O-gal的荧光强度低于O-flc,表明半乳糖对OVA构象的影响强于葡萄糖,可能是半乳糖诱导的反应中释放出了更多芳香族氨基酸,与极性溶剂水接触导致荧光猝灭。
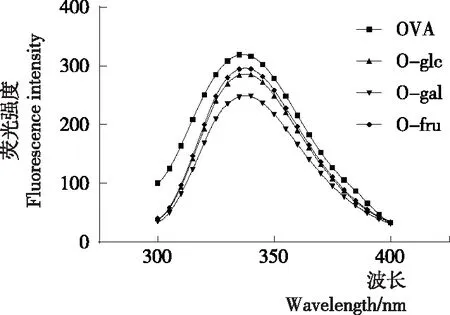
图4 己糖修饰的卵清蛋白内源荧光光谱
同步荧光光谱可反映出反应过程中特定氨基酸的分子微环境,是表征特异性氨基酸的重要指标,其中λ为15 nm时同步荧光光谱表征的是酪氨酸,λ为60 nm时则是色氨酸[23-24]。由图5可知,与未糖基化的OVA相比,糖基化的OVA同步荧光强度显著降低,由未糖基化时的90.03分别下降至O-gal的71.05、O-glc的78.74和O-fru的81.81,表明在糖基化反应改变OVA的构象结构时,酪氨酸所处的微环境逐渐由疏水环境变为亲水环境[25]。其中,O-gal的荧光强度下降程度最高,可能是半乳糖对OVA构象结构更剧烈的破坏所导致的。色氨酸表现出与酪氨酸相一致的趋势。
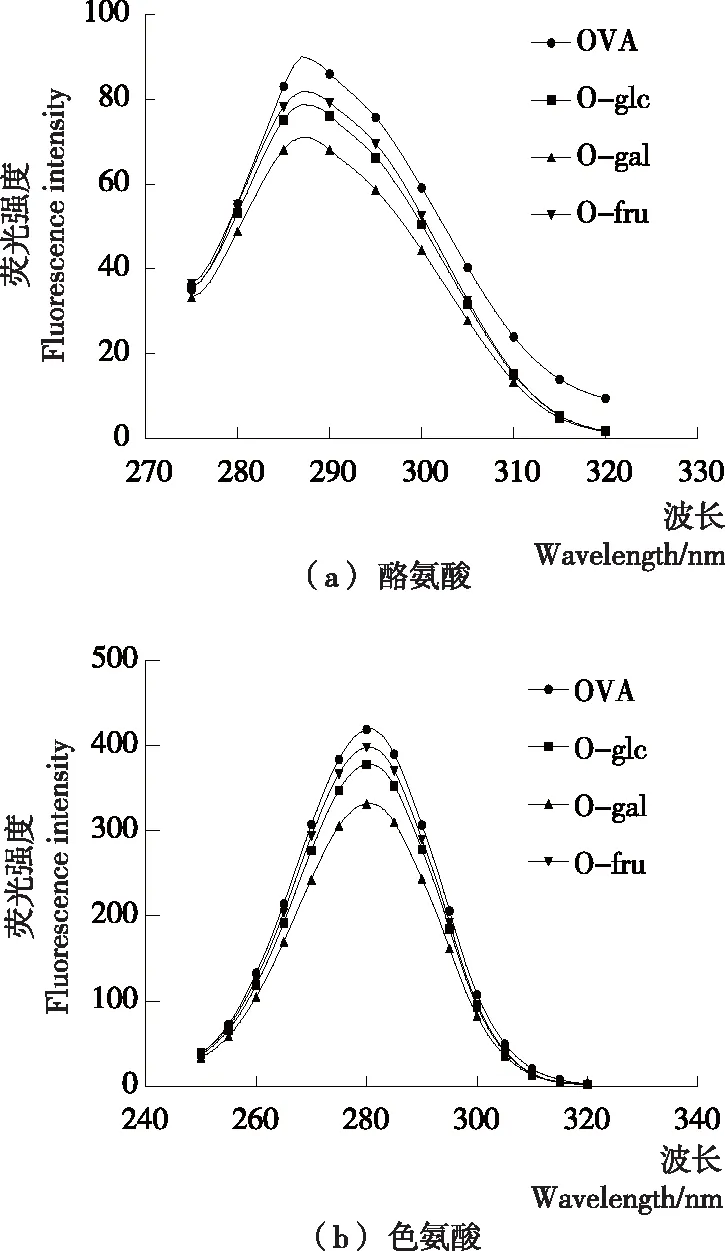
图5 己糖修饰的卵清蛋白同步荧光光谱
2.5 IgG/IgE结合能力
由图6可知,与天然OVA相比,糖基化样品的IgG/IgE结合力均显著下降,OVA的IgG/IgE结合能力从73.8%,52.8%降低至O-gal的48.1%,35.6%,而O-fru的IgG/IgE结合能力无明显变化,可能是葡萄糖和半乳糖对OVA的糖基化修饰程度高,糖基化过程中OVA分子结构展开,其构象表位遭到破坏,以及还原糖分子的共价结合阻碍了抗体对OVA分子的抗原表位识别[26-28],而果糖对OVA的糖基化修饰程度较低,OVA的分子结构比较完整,其构象表位并未遭到较大破坏。3种己糖中,果糖的糖基化反应活性最低,对OVA的IgG/IgE结合能力降低效果最差;半乳糖的糖基化程度高于葡萄糖的,而半乳糖和葡萄糖修饰的OVA的IgG/IgE结合能力比较接近一致,可能是碳水化合物和蛋白质过敏位点的结合能力不同所致[29]。
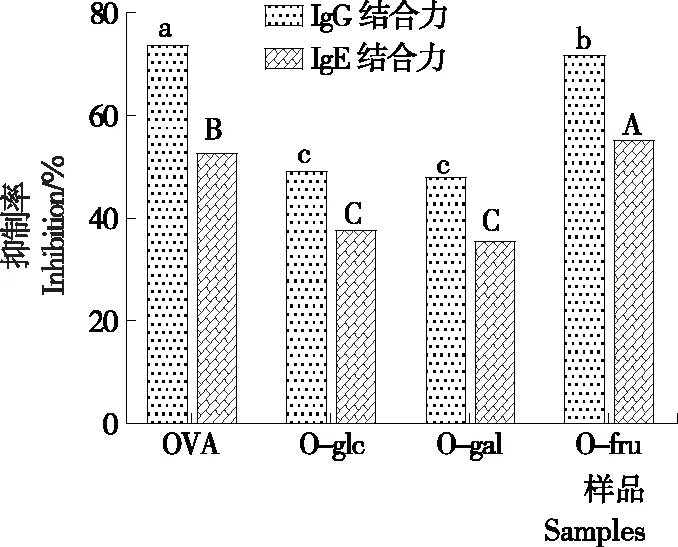
小写字母不同表示样品的IgG结合的差异显著(P<0.05);大写字母不同表示样品的IgE结合的差异显著(P<0.05)
3 结论
研究了不同己糖(葡萄糖、半乳糖、果糖)修饰后的OVA在结构性和IgG/IgE结合力上的变化。结果表明,半乳糖修饰的OVA的糖基化程度最高,而果糖修饰的最低。反应过程中,OVA由于加热而解折叠,然后通过疏水相互作用聚集,使其表面疏水性降低。糖基化过程中的热处理以及分子基团的改变破坏了OVA的原有构象,芳香族氨基酸外露,紫外吸收增强,荧光强度降低。糖基化反应使OVA的致敏性降低,但果糖修饰的OVA的IgG/IgE结合力下降轻微,远低于半乳糖和葡萄糖的。3种己糖中,果糖为酮糖,半乳糖和葡萄糖均为醛糖,醛糖修饰的糖基化程度和改变蛋白质空间布局的能力高于酮糖,因此半乳糖和葡萄糖能显著降低OVA的致敏性。试验探究了构象的变化对OVA致敏性的影响,但OVA构象是如何变化,其变化又如何影响OVA致敏性还有待深入探究。后续应利用圆二色光谱仪、生物质谱、分子对接等技术,研究糖基化反应对OVA的二级结构变化、糖基化位点及OVA与糖分子的相互作用。
