骨外尤文肉瘤/外周原始神经外胚层肿瘤的CT及MRI表现
2020-07-25冯瑶杰瞿姣危春容张梦梅杨亚英李德艳
冯瑶杰,瞿姣,危春容,张梦梅,杨亚英,李德艳
骨外尤文肉瘤(extraskeletal Ewing's sarcoma,EES)及外周原始神经外胚层肿瘤(peripheral primitive neuroectodermal tumor,pPNET)是一组高度恶性的小圆细胞肿瘤,具有不同程度的神经外胚层分化,二者在细胞形态、免疫组化、细胞遗传学和分子遗传学上具有相似性,均属于尤文肉瘤家族[1]。EES占软组织恶性肿瘤的1.1%,pPNET占软组织肿瘤的4%。国内外多为个案报道,因病变少见,该病误诊率较高。笔者搜集本院经病理证实的12例EES及pPNET患者的临床及影像学资料并复习相关文献,旨在提高对该病的认识。
材料与方法
1.一般资料
回顾性分析本院2013年8月-2019年4月经病理证实的12例EES/pPNET患者的临床、影像及病理资料。其中男8例,女4例,年龄8~65岁,中位年龄33.5岁。所有患者均经取材活检或手术获得病理组织学及免疫组化结果。
2.检查方法
4例同时行CT及MRI平扫+增强检查,5例行CT平扫+增强检查,3例行MRI平扫+增强检查。采用Siemens definition FLASH 64排螺旋CT或Siemens definition AS 64排螺旋CT机扫描,管电压100~120 kV,管电流250 mAs,层厚5~8 mm,1 mm薄层重建。增强扫描采用对比剂碘海醇(370 mg I/mL),剂量1.5 mL/kg体重,注射流率3 mL/s。采用Philips Achieva 3.0T或 Philips Achieva 1.5T MR扫描仪,头颈联合线圈或8通道体部线圈行磁共振平扫+增强检查:平扫采用TSE,获得横轴面、冠状面T2WI、冠状面压脂T2WI及横轴面T1WI,增强扫描采用对比剂Gd-DTPA(0.2 mmol/kg)经肘静脉静脉注入,注射流率2 mL/s,层厚6~7 mm。3例行DWI扫描,b值取0,800~1000 s/mm2,层厚6~7 mm。
3.图像分析
由两名高年资放射科医师进行独立阅片,回顾性分析所有病例的CT及MRI图像,意见有分歧时讨论达成一致。观察内容包括病灶的部位、大小、密度或信号、强化特点、病灶边界、周围组织侵犯情况、占位效应、淋巴结转移情况。形态:边缘光滑呈类圆形为形态规则,边缘分叶状或不整齐为形态不规则;周围浸润:肿瘤直接侵犯邻近脏器或肿瘤与邻近器官之间的脂肪间隙模糊[2];病灶强化程度:增强扫描后CT值增加小于20 HU为轻度强化,CT值增加20~40 HU为中等强化,CT值增加40 HU以上为明显强化。
结 果
本组12例,其中9例发生于头颈部,2例发生于胸部,1例发生于腹部。除1例表现为鼻咽部软组织增厚外,其余病灶均表现为规则或不规则软组织肿块,病灶直径3.2~14.2 cm。CT平扫6例病灶实性部分呈等密度,CT值41~67 HU,3例呈稍低密度,CT值35~38 HU,MRI平扫6例实性部分T1WI呈等信号,1例呈稍高信号,7例T2WI均呈高信号,3例DWI高b值扩散受限呈混杂高信号,ADC图为低信号。平扫11例密度或信号不均匀,增强扫描12例均呈不均匀强化,强化程度不一,4例轻度强化,2例中度强化,6例明显强化。9例(9/12,75%)形态不规则,12例(12/12,100%)可见坏死囊变(图1~3),其中1例为囊实混杂占位。5例(5/12,41.7%)病灶周围或内部见血管影(图3~4),MRI检查2例伴病灶内或周围见流空血管影;5例(5/12,41.7%)伴邻近骨质溶骨性骨质破坏(图5~6);9例(9/12,75%)伴周围结构侵犯;12例(12/12,100%)可见占位效应,表现为邻近结构受压移位;2例(2/12,16.7%)伴钙化,1例为中心不规则的团簇状钙化,1例为囊壁点状钙化;3例发生于胸腹部的病变均见胸腔/腹腔积液。
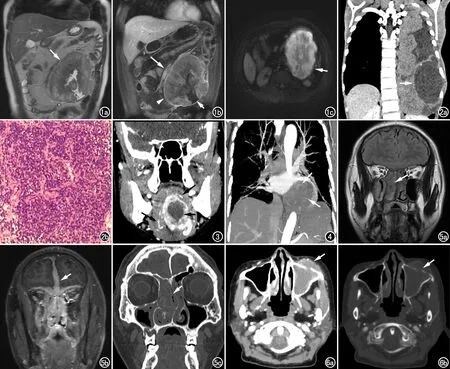
图1 男,31岁,空肠EES。a)冠状面T2WI示左中下腹椭圆形混杂稍高信号肿块(箭);b)冠状面T1WI增强示肿块不均匀强化,边缘见假包膜(箭头),其内见片状无强化坏死区(短箭),邻近血管受压移位(长箭);c)DWI示肿块扩散受限呈混杂高信号(箭)。 图2 女,8岁,左侧胸腔EES。a)冠状面CT增强示左侧胸腔不规则囊实混杂密度肿块(箭),实性部分中度强化,囊性部分无强化;b)光镜下见弥漫分布的小圆细胞,核分裂相多见,胞质稀少、核仁不明显(HE,×40)。 图3 女,26岁,舌EES。冠状面CT增强示舌左份明显强化肿块,其内片状无强化囊变坏死区(短箭),边缘多发迂曲小血管影(长箭)。 图4 男,65岁,左侧胸腔EES。冠状面CT增强MIP图示左侧胸腔内不规则肿块,边界不清,病灶内部多发迂曲小血管影(箭)。 图5 男,47岁,鼻窦EES。a)冠状面FLAIR T2WI平扫示双侧鼻腔、筛窦弥漫性稍高信号影,边界不清(箭);b)冠状面T1WI增强示病灶明显强化,前颅窝脑膜明显增厚强化(箭);c)冠状面CT骨窗示鼻中隔、双侧筛窦及鼻甲骨质吸收破坏,骨质轮廓可见(箭)。 图6 女,52岁,左侧上颌窦EES。a)横轴面CT增强扫描示左侧上颌窦不均匀强化软组织肿块,突破上颌窦前壁(箭);b)横轴面CT骨窗示上颌窦前壁骨质吸收破坏(箭)。
讨 论
尤文肉瘤(Ewing's sarcoma,ES)占原发恶性肿瘤的6%[3],分为骨内型与骨外型,骨内型多见,而骨外型少见,EES仅占ES的15%~20%[4],由Tefft等[5]于1969年首先提出,1975年由Angervall[6]命名。文献报道的EES发病年龄为1~66岁[7],男性稍多于女性,成人多于儿童[8-10],本组男性8例,女性4例,年龄8~65岁,与文献报道基本相符。EES可发生于全身各处,好发于脊柱旁、躯干、腹膜后、四肢,也可发生于头颈部及实质脏器。
光镜下可见肿瘤由大量形态一致的小圆细胞组成,细胞排列紧密,巢状或呈叶状分布,核浆比高,染色质细腻,核分裂相多见,胞质内含糖原颗粒,部分瘤细胞围绕血管环状排列,形成典型的Homer-Wright菊形团,瘤间散在薄壁毛细血管,远离血管的瘤细胞常坏死,部分区域间质纤维化,分隔成巢团结构[11]。免疫组织化学几乎均表达CD99、FLI-1及波形蛋白,不同程度表达神经内分泌标记NSE及突触素Syn等,其中MIC基因的产物CD99是ES家族一种相对特异的抗体[11],90%的EES具有特征性染色体异位t(11;22)(q24;q12)并产生EWS-FL1融合基因[4,7],同时EWS-FL1也是治疗EES的理想靶点[1];此外有研究发现bmi-1基因在ES家族发病机制中有重要作用[12]。目前已有EES免疫治疗、基因治疗等方面的实验研究,将有望运用于临床[13]。EES治疗主要采取术前化疗、手术及术后放疗,局部复发及远处转移很常见[8,9],转移部位依次为肺、骨、淋巴结等[4,8]。成人EES往往预后不良,Weshi等[14]报道5年生存率仅为35%,预后与年龄、发病时肿瘤的大小、分期、手术切缘、乳酸脱氢酶升高情况及化疗后坏死率等相关[10,14,15]。
结合本组病变影像特点并复习相关文献发现:EES多表现为浸润性生长的软组织肿块,体积较大且形态不规则,部分病例表现为软组织不规则增厚。CT平扫呈类似于肌肉组织的等或稍低密度(等密度为主),MRI平扫T1WI表现为等或稍低信号(等信号为主),T2WI多呈高信号,密度或信号不均匀,囊变坏死多见,钙化少见,可出现假包膜;增强扫描强化不均匀且强化程度不一。有研究显示,EES强化是否均匀与肿瘤的分化程度有关,分化程度越高则强化越均匀[15]。肿瘤占位效应明显,表现为推压周围组织,易侵犯周围结构,可伴溶骨性骨质破坏。本组12例,除1例表现为软组织增厚外,其余11例均表现为相应部位的软组织肿块,100%伴点片状坏死,肿瘤越大出现坏死的频率越高,且坏死的范围越大,这与组织学上EES多伴囊变、坏死相符[14],可能与肿瘤生长迅速、供血动脉缺乏有关。所有病例均伴明显的占位效应,75%伴邻近结构侵犯,Huh等[2]认为即使EES边界较清,也容易侵犯邻近器官,特别是位于胸腹部及盆腔者,本组1例空肠EES,边界较清且有假包膜,但手术病理提示病灶仍伴十二指肠及升结肠侵犯。本组中5例伴骨质破坏,均未出现骨膜反应。41.7%的病灶增强扫描时内部或边缘见多发小血管影,这与病理组织学上肿瘤内富含小血管相符合[11],2例MRI表现为病灶内部或边缘的血管流空信号,Murphey等[15]认为该征象常提示为EES。本组中,1例CT及MRI平扫脑膜未见异常,增强扫描脑膜明显强化,提示肿瘤侵犯脑膜,最终,术中所见及术后病理结果均证实;另外1例MRI平扫时信号尚均匀,而增强呈不均匀强化并见无强化坏死区;说明CT或MRI增强扫描有助于显示病灶周围组织侵犯情况及病灶内的坏死囊变区。文献报道25%的EES伴有钙化,可能与肿瘤细胞坏死钙盐沉积相关[14],本组中2例伴钙化。本组3例发生淋巴结转移,未见发现远处转移。骨ES和EES虽然病理组织特征相似,但影像表现却不尽相同:骨ES以长骨干骺端多见,表现为边界不清的溶骨性骨质破坏伴葱皮样骨膜反应(病理基础是肿瘤沿骨髓腔及哈弗氏小管浸润),当肿瘤突破骨皮质时形成软组织肿块,横轴面扫描长骨病灶可见较为特征的“"同心圆”征[16];而EES可发生于全身各部位,影像上常表现为较大的软组织肿块,伴或不伴溶骨性骨质破坏,骨质破坏程度较轻且无骨膜反应。
除此之外,根据病变发生部位不同,病变的形态有一定差异,头颈部EES表现为软组织肿块或软组织增厚,填充并占据相应的窦、腔[17]。影像上,鼻咽及颈部EES应与鳞癌、神经源性肿瘤相鉴别:鳞癌好发于中老年,易侵犯咽旁间隙,淋巴结转移常见;神经源性肿瘤好发于青中年,多位于颈动脉间隙,边界清楚,可见包膜。鼻窦EES应与其他鼻窦恶性肿瘤如腺样囊性癌、嗅神经母细胞瘤鉴别:腺样囊性癌易沿神经侵犯,筛样变较具特征性[18];嗅神经母细胞瘤好发于11~20岁及51~60岁,多起源于嗅神经分布区如鼻腔上部及筛窦顶部,易侵犯前颅底。胸腔内EES常表现为较大的囊实性肿块[19-20],容易侵犯心包及邻近肋骨,易导致邻近肺组织受压不张,应与胸内甲状腺肿、畸胎瘤等相鉴别:胸内甲状腺肿好发于女性,与颈部甲状腺相连,常伴钙化,增强实性部分明显强化;畸胎瘤常伴脂肪、钙化、骨骼、软组织密度,影像表现较典型。腹部EES表现为较大的软组织肿块伴中心坏死[21],应与胃肠道间质瘤、横纹肌肉瘤相鉴别:胃肠道间质瘤发病年龄大,40岁以下少见,多见于胃大弯及体部,外生性生长,边界较清,增强扫描呈明显强化;横纹肌肉瘤儿童多见,表现为边界不清的软组织肿块,增强扫描为明显强化,易包饶血管及浸润性骨质破坏。
局限性及不足:本组病例数较少,未进行统计学分析;病变部位分散,未对每个部位的EES进行单独讨论,将在以后的工作中继续搜集更多病例研究。
综上所述,EES可发生于全身各处,CT平扫为等或稍低密度,MRI平扫T1WI多表现为等或稍低信号、T2WI表现为高信号,多伴有囊变坏死,病灶内部或周围见多发血管影较具特征性。当年轻男性患者,CT或MRI表现为体积较大的软组织肿块,伴有囊变坏死,占位效应明显且易侵犯周围组织,钙化少见时,应考虑到EES的可能。EES临床诊断困难,病变体积大、易坏死囊变并侵犯周围组织、骨质破坏等影像表现可提示为恶性肿瘤,影像学检查可显示肿瘤的浸润范围,识别远处转移,预测可切除性等,为临床治疗方案的制定及预后判断提供依据,但最终确诊仍需依靠病理。