SWI诊断脑微出血对缺血性脑卒中临床随访价值研究
2020-07-25高科艾松涛罗禹何文辉周永明孟令磊
高科,艾松涛,罗禹,何文辉,周永明,孟令磊
脑卒中是最常见的脑血管疾病之一,目前脑卒中是世界第二大死亡和致残因素,已成为我国居民第一大死亡原因[1]。在脑卒中患者中,高达70%的脑卒中病例归因于急性缺血性脑卒中[2]。急性缺血性脑卒中可造成包括中枢神经损伤、肢体残疾、情绪失常、认知障碍等多种后遗症,对患者本身、家庭及社会都带来了沉重的负担。
随着影像技术的发展,急性缺血性卒中的诊断已不再困难。在急性缺血性卒中的影像检查中,特别是磁敏感加权成像(susceptibility weighted imaging,SWI)广泛应用后,我们发现很多急性缺血性卒中的患者常伴发脑微出血(cerebral microbleeds,CMBs)。因为SWI可以更加敏感的显示脑内的顺磁性物质,在显示脑微出血等方面都具有很高的价值[3]。CMBs指脑内微小血管的病变,导致脑实质以小血管周围少量出血及小血管周围含铁血黄素沉积为主要特征的亚临床损害[4],多无明确的神经系统体征。CMBs对急性缺血性卒中患者的预后是否有影响,现在国内外还没有很广泛的研究。
本研究通过分析有无微出血灶的两组急性缺血性脑卒中患者治疗前后的磁敏感加权成像和灌注加权成像,比较两组患者治疗前后脑灌注情况的改变及卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分的改变有无差别以及发生出血转化的比例,评估SWI诊断颅内微出血灶对急性缺血性卒中做早期预后判断的临床价值。
材料与方法
1.研究对象
搜集2016年1月-2018年12月本院收治的发病在24 h内急性缺血性脑卒中患者,所有患者到院30 min内完成头颅CT平扫检查,1 h内完成首次磁共振检查,按照中国缺血性卒中治疗规范标准化治疗7~10 d后复查MRI,取得患者完整临床资料,包括性别、年龄、血管危险因素、实验室检查、治疗方法、NIHSS评分等。该研究获得了本院医学伦理委员会批准同意。
入选标准:①神经系统症状发现至到达医院就诊在24 h以内;②MRI检查存在急性脑内梗塞病灶,且位于单一责任动脉区内;③按照中国缺血性脑卒中治疗规范标准化治疗至少一周。
排除标准:①发病时间大于24 h;②头颅CT检查发现活动出血性疾病;③MRI检查脑内梗塞灶为亚急性或慢性期,或多个梗死灶位于多个责任动脉区;④各种原因未能完成全部MRI检查;⑤各种原因未能进行标准化治疗。
2.影像学检查方法
采用Siemens 1.5T Avanto超导磁共振扫描仪,分别于患者到院1 h内及治疗后7~10 d行MRI检查,成像序列包括扩散加权成像(diffusion weighted imaging,DWI)、灌注加权成像(perfusion weighted imaging,PWI)、SWI以及常规T1WI、T2WI和FLAIR序列,DWI采取b值0,1000 s/mm2,计算ADC值,PWI采用静脉快速团注Gd-DTPA对比增强灌注成像方法。
3.图像评估方法
图像后处理:SWI通过Siemens磁共振影像工作站后处理得到Mag-Images、Phase-Images、MIP以及SWIM四个参数图。通过RAPID软件分析PWI图像得到四个灌注参数图:最大峰值时间(time to maximum,Tmax)、MTT、rCBV以及rCBF。
CMBs的诊断和分组:CMBs诊断标准:SWI MIP图像上直径2~10 mm的小类圆形低信号,同时Phase-Images为高信号及DWI(b=0)为低信号,并通过CT和T2WI分别排除钙化及血管流空信号。根据首次MRI检查SWI图像是否存在CMBs将患者分为两组:CMBs阳性组和CMBs阴性组。
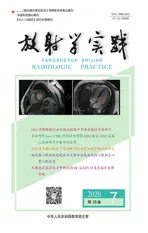
对脑内灌注情况的评估:通过iSchema View RAPID软件定量分析PWI图像,以Tmax>4 s为基线定义缺血低灌注的脑容积,以 Tmax>6 s为基线定义明显缺血低灌注的脑容积,得到Tmax延迟的脑容积定量分析图(图1)。
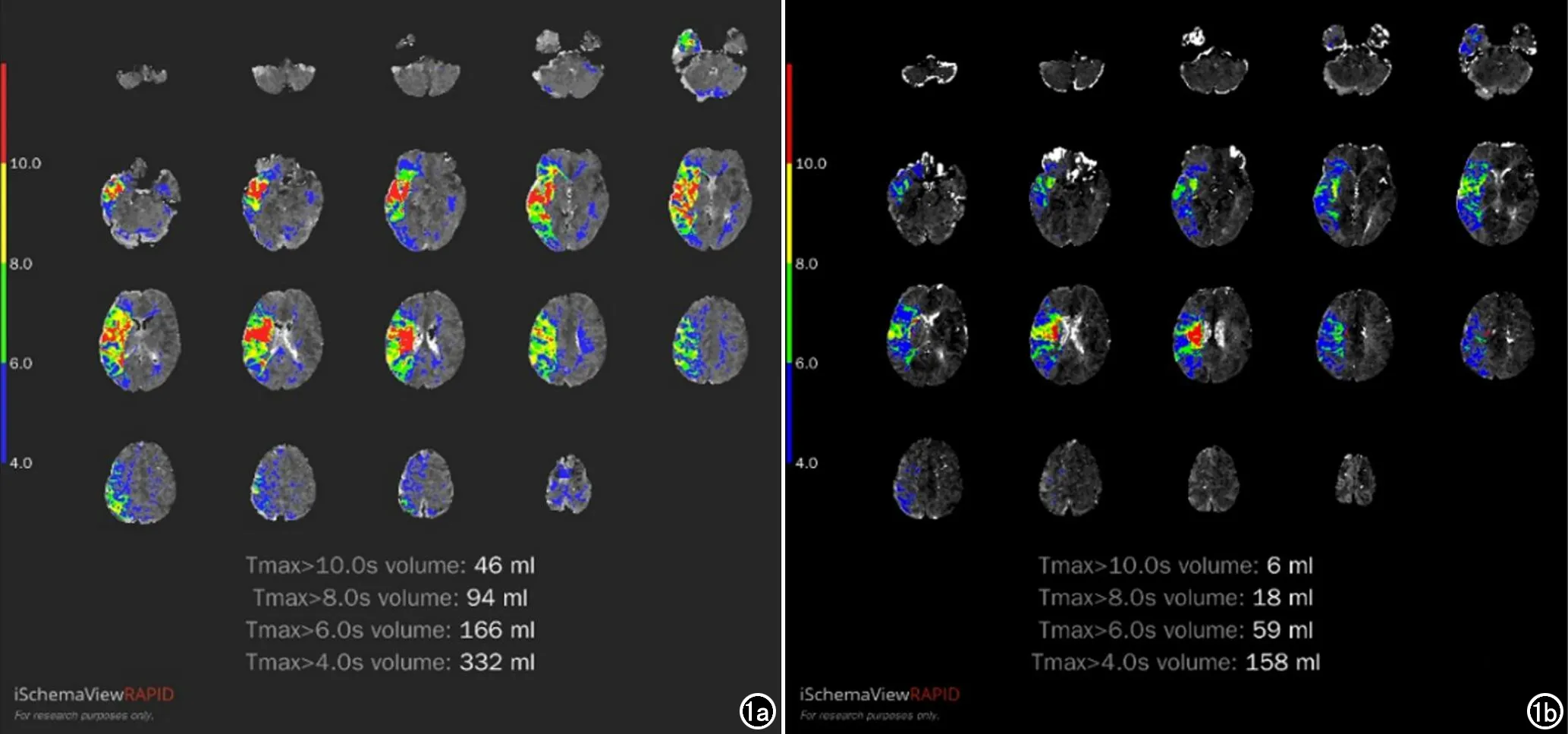
图1 男,65岁,发现左侧肢体无力伴口齿不清6 h入院。RAPID软件定量分析脑灌注情况。a)入院首次检查PWI图像,Tmax>4 s的脑容积为332 mL,Tmax>6 s的脑容积为166 mL;b)为内科治疗9 d后复查PWI图像,Tmax>4 s的脑容积减少为158 mL,Tmax>6 s的脑容积减少为59 mL。
出血转化(hemorrhage transformation,HT)的判定:对比治疗前后的SWI MIP图及相位图,诊断是否发生梗塞后出血,如新发出点状或团片状顺磁性信号,结合CT即诊断为HT(图2)。
图2 男,58岁,右侧肢体无力3 h,治疗后发生出血转化。a)入院头颅CT未见活动性出血;b、c)DWI及ADC图示左侧侧脑室旁急性脑梗塞(箭);d)SWI示梗塞区未见明显出血;e)静脉溶栓治疗24 h后复查头颅CT梗塞区密度不均匀;f、g、h)一周后复查CT及SWI示梗塞区出血(箭)。
以上所有影像图像均由两名执业年限10年以上的放射科医师进行诊断评估。
4.统计学方法
采用IBM SPSS Statistics V25.0进行统计学分析。服从正态分布的计量资料以“均数±标准差”表示,组间比较采用两独立样本t检验;非正态分布的计量资料以“中位数(四分位差)”表示,组间比较采用Mann WhitneyU秩和检验;分类计数资料以“频数(百分比)”表示,组间比较采用卡方检验或Fisher精确检验。所有检验均为双侧检验,以P<0.05为差异具有统计学意义。
结 果
1.患者基本资料
共纳入100位符合标准的患者,其中男72例,女28例,平均年龄(68.17±9.06)岁。CMBs阳性患者54例,CMBs阴性患者46例,两组患者年龄、性别差异无统计学意义(P>0.05)。急性缺血性卒中的主要危险因素包括高血压、糖尿病、高血脂、房颤、吸烟、饮酒在两组间的差异没有统计学意义(P>0.05)。两组患者发病至入院时、梗塞区域和治疗方式的差异也没有统计学意义(P>0.05,表1)。
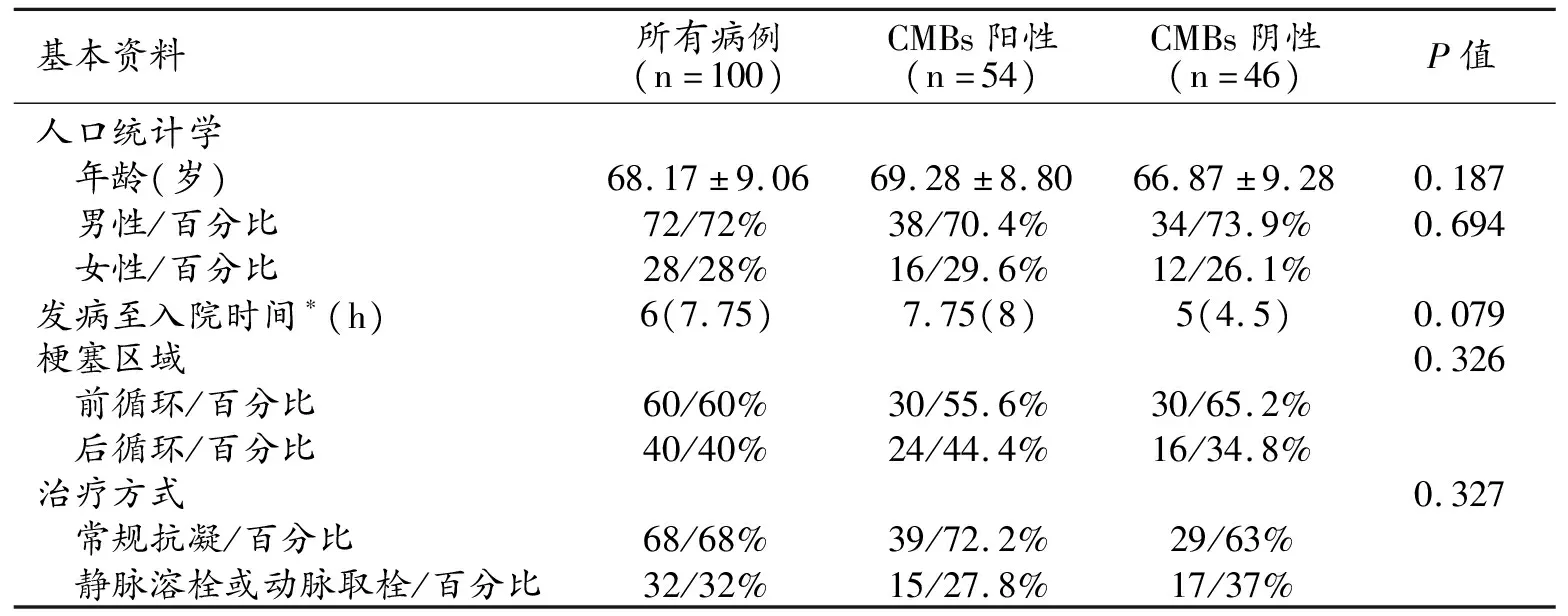
表1 研究对象的基本资料 (例)
2.CMBs阳性组和CMBs阴性组治疗前后脑灌注变化情况的比较
在4.5 h内的急性缺血性卒中患者如无绝对禁忌症,可采用静脉溶栓或动脉取栓治疗[2]。本研究中常规抗凝治疗的患者为68例,采取静脉溶栓或动脉取栓的患者为32例。
治疗前首次MRI检查:100患者Tmax>4 s脑容积最多804 mL,最低3 mL,Tmax>6 s脑容积最多509 mL,最低3 mL;CMBs阳性组和CMBs阴性组Tmax>4 s脑容积和Tmax>6 s脑容积的差异无统计学意义(P>0.05,表2)。
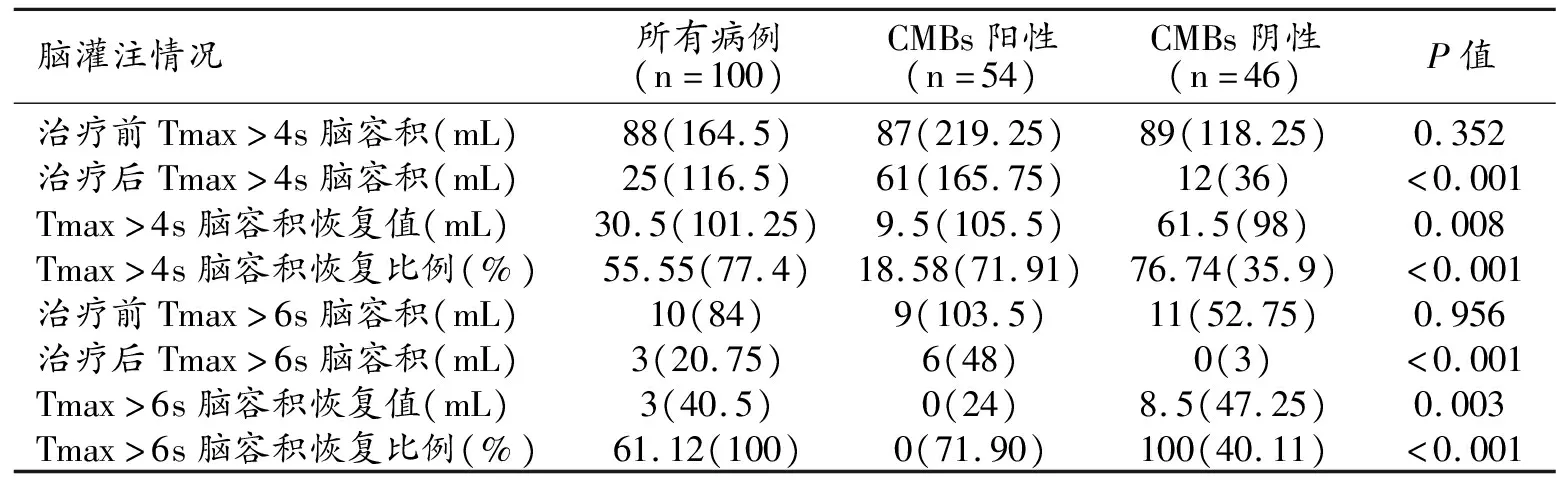
表2 CMBs阳性组和CMBs阴性组患者治疗前后脑灌注情况*
治疗后7~10 d复查MRI:100例患者Tmax>4 s脑容积最多531 mL,最低0 mL,其中79例Tmax>4 s脑容积减少,Tmax>6 s脑容积最多208 mL,最低0 mL,其中67例Tmax>6 s脑容积减少;CMBs阳性组和阴性组间Tmax>4 s脑容积、Tmax>6 s脑容积差异有统计学意义(P<0.05),Tmax>4 s及Tmax>6 s脑容积恢复的容积和比例均差异有统计学意义(P<0.05,表2)。
3.CMBs阳性组和CMBs阴性组治疗前后NIHSS评分变化情况的比较
治疗前100例患者NIHSS评分最高25分,最低0分;CMBs阳性组NIHSS评分最高为25分,最低0分,CMBs阴性组NIHSS评分最高为17分,最低为0分;两组间差异无统计学意义(P>0.05,表3)。
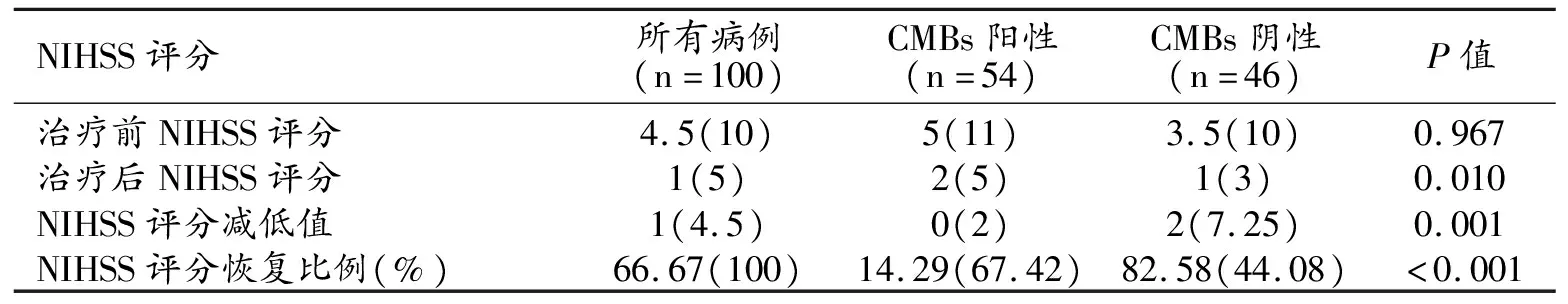
表3 CMBs阳性组和CMBs阴性组患者治疗前后NIHSS评分变化情况
治疗后100例患者死亡3例,剩余97例患者NIHSS评分最高25分,最低0分,其中61例NIHSS评分降低;CMBs阳性组NIHSS评分最高25分,最低0分,CMBs阴性组NIHSS评分最高22分,最低0分,两组间差异有统计学意义(P<0.05)。两组患者治疗前后NIHSS降低的值和比例差异均有统计学意义(P<0.05,表3)。
4.CMBs阳性组和阴性组治疗后发生HT的情况比较
100例患者治疗后发生梗塞区出血14例,其中CMBs阳性组7例,CMBs阴性组7例,两组间发生HT的比例差异无统计学意义(P=0.746,表4)。
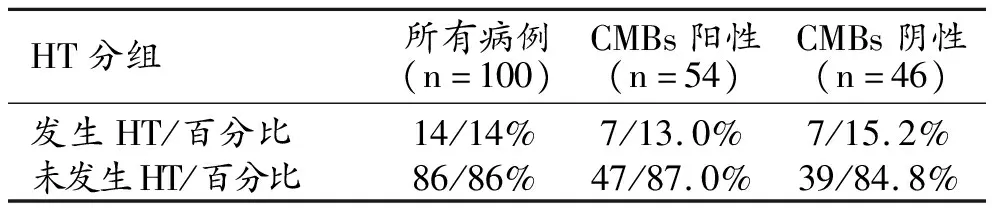
表4 CMBs阳性组和阴性组治疗后发生HT的病例 (例)
讨 论
CMBs最早发表于1995年奥地利的一项卒中预防研究中,约6%的44~79岁的老年人群发现有脑微出血[5],随着MR设备的进步和新检查序列如SWI的发明,检出率逐步提高。CMBs一般没有临床症状,通常在头颅CT图像上无法检出。而在MR检查中,因为CMBs病灶主要为血管周围的顺磁性含铁血黄素沉积,在梯度回波序列(T2*weighted gradient recalled echo,T2*-GRE)和SWI表现为小类圆形信号缺损,边界清晰,周围没有水肿[6]。CMBs的主要病理生理改变因分布的区域不同而不同,通常位于深部如基底节区的脑微出血是由高血压脑血管病(hypertensive cerebral vascular disease,HV)引起的微小动脉脂质透明样变性,而位于脑叶皮髓质交界区的脑微出血通常是由于脑淀粉样变血管病(cerebral amyloid angiopathy,CAA)引起的淀粉样蛋白血管壁沉积[7]。因此,脑微出血可以认为是小血管壁异常脆弱的一种标志。很多临床研究证实发现脑微出血对原发性脑出血(primary intracerebral hemorrhage,PICH)的重要性,在PICH病例中发现较高比例的脑微出血(54%~71%),这些研究也表明脑微出血可能预示高血压脑病引起的自发性脑出血[8-11]。
虽然CMBs没有明确的临床症状,但有学者研究认为CMBs可能会影响认知功能,特别是额叶的CMBs。研究表明卒中后发生认知障碍的患者,其额叶和基底节的微出血灶要明显多于对照组,这可能是由于CMBs破坏了额叶的神经回路[12-13]。在一项阿尔茨海默病的研究中亦表明微出血可能导致血管性痴呆患者的认知障碍[14]。
而CMBs在急性缺血性卒中的临床意义尚未得到充分认识。目前认为急性缺血性卒中的危险因素主要是年龄、高血压、糖尿病、高胆固醇血症、心房颤动等[15]。CMBs既然反映了颅内小血管的病变程度,其能否反映急性缺血性卒中患者治疗后脑灌注的情况尚不明确。有研究表明多发的CMBs可能是急性缺血性脑卒中发生早期神经功能恶化(early neurological deterioration,END)的预测因素,而与卒中的病因无关[16]。本研究的结果也显示,两组基本状况如年龄、性别、血压、血糖、血脂、发病至入院时间、NIHSS评分、脑灌注情况差异均无统计学意义的急性缺血性卒中患者,不伴有CMBs的患者治疗后脑灌注恢复情况和NIHSS评分均要好于伴有CMBs的患者。而发生早期神经功能障碍的急性缺血性卒中患者,即使经过积极治疗,其神经功能也可发生渐进性的损害,进而造成持久和严重的功能障碍[17]。在本研究中即使是发病时间在4.5 h内的患者,早期进行积极干预,如经静脉溶栓或介入动脉取栓治疗,CMBs阴性的患者治疗后灌注改善情况及NIHSS评分改善也要好于CMBs阳性患者。这可能是由于伴有CMBs的患者颅内微小血管壁透明样变及淀粉样物质沉积,加重了血管病变病的程度,导致血栓形成和远端的动脉血流减少[18],CMBs也可能会改变自身免疫力和血管内皮不稳定性[19],这些因素都可能会影响微小动脉再通和侧支循环的形成,导致卒中治疗后脑灌注恢复情况的差异,而与CMBs的发生机制和发生部位无关[20]。脑灌注不足可能对缺血性卒中患者早期神经功能恶化起关键作用,进而形成渐进而持久的功能障碍,增加了功能性残疾的风险,患者治疗后NIHSS评分升高[21],预后不良。
急性缺血性卒中患者另一项导致预后不良的因素即是HT的发生。HT的发生机制是血-脑屏障发生破坏,即由内皮细胞紧密连接及细胞外基质蛋白构成的基底膜的破坏导致[22]。早期有学者认为CMBs增加了急性缺血性卒中患者溶栓治疗后发生HT的风险,多发CMBs是缺血性卒中患者溶栓后出血的危险因素[23],但近几年国内外研究和荟萃分析提示对CMBs阳性的急性缺血性卒中患者是否应该在时间窗内溶栓治疗存在争议[22,24], AHA/ASA不推荐在静脉溶栓治疗前常规进行MRI检查除外脑微出血[25],我国将脑微出血作为静脉溶栓治疗的相对禁忌症[2]。本研究表明CMBs阳性和CMBs阴性的急性缺血性卒中患者发生HT的比例并没有显著差异。CMBs阳性组经静脉溶栓或动脉取栓后的患者发生HT的比例要高于经常规内科抗凝治疗的患者,虽然两者差异并没有统计学意义,但CMBs阳性组经静脉溶栓或者动脉取栓治疗后发生HT的3例患者中2例死亡,CMBs阳性有可能会增加溶栓治疗或者动脉介入取栓治疗后预后不良的风险,需要更大样本量的前瞻性研究去证实。
本研究存在局限性。首先,本研究采用回顾性设计,并非随机对照试验。其次,本研究仅纳入了单一机构中的少数患者,研究结果的有效性和选择性偏倚无法得到有效证实。最后,本研究所有患者仅接受了1.5T MR检查,3.0T MR可能会提高CMBs的检出率。以上不足需要进行多中心前瞻性研究,包括样本量足够的多模态神经影像成像研究。
CMBs阴性的急性缺血性脑卒中患者的脑内灌注恢复及NIHSS评分恢复均要好于CMBs阳性的患者,SWI诊断显示CMBs有助于对急性缺血性卒中早期预后做出有效的初步判断,对急性缺血性脑卒中的治疗临床指导意义。