麻黄非生物碱部位抗过敏性哮喘活性组分的化学成分分析
2020-07-23靳京妹于大永侯滔张秀莉史丽颖
靳京妹 于大永 侯滔 张秀莉 史丽颖
中图分类号 R284.1 文献标志码 A 文章编号 1001-0408(2020)09-1068-06
DOI 10.6039/j.issn.1001-0408.2020.09.09
摘 要 目的:为阐明麻黄非生物碱部位抗过敏性哮喘的药效物质基础提供参考。方法:麻黄用85%乙醇提取、正庚烷萃取后经固相萃取(填料为AC18)前处理,对麻黄提取物进行非生物碱部位富集,并采用高效液相色谱法经Unitary C18柱和Eclipse XDB-C18色谱柱进行麻黄非生物碱类组分制备。以HT-29细胞中高表达的G蛋白偶联受体35(GPR35受体)为靶标、GPR35受体激动剂敏喘宁(1 μmol/L)为阳性对照、动态质量重置(DMR)响应值为检测指标,通过无标记细胞整合药理学方法考察各组分(质量浓度均为100 μg/mL)对GPR35受体的激动活性和脱敏活性,以筛选抗过敏性哮喘的活性组分。应用高效液相色谱-四极杆飞行时间质谱(HPLC-Q-TOF-MS)技术对活性组分的化学成分进行鉴定。结果:麻黄非生物碱部位主要分为固相萃取前处理的沉淀部分和95%甲醇洗脱部分,从上述两部分中共富集得到了20个组分。其中,沉淀部分中组分F1.5~F1.10及95%甲醇洗脱部分中组分F2.5~F2.10对GPR35受体有较强的激动活性,同时对GPR35受体激动剂敏喘宁显示出了较强的脱敏活性;并且沉淀部分中组分F1.5~F1.10在HT-29细胞上引起的DMR响应信号强度甚至超过了阳性对照药敏喘宁。经HPLC-Q-TOF-MS分析,共从活性组分中鉴定出了24個化合物,其中黄酮类14个、挥发油类2个、有机羧酸类7个、蒽醌类1个。结论:麻黄非生物碱部位主要以黄酮类成分为主,其具有一定的抗过敏性哮喘活性。
关键词 麻黄;非生物碱部位;G蛋白偶联受体35;过敏性哮喘;化学成分;鉴定
Analysis of Chemical Components of Anti-allergic Asthma Active Fractions in Alkaloids-free Part of Ephedrae Herba
JIN Jingmei1,YU Dayong1,HOU Tao2,ZHANG Xiuli2,SHI Liying1(1.School of Life Sciences and Biotechnology, Dalian University, Liaoning Dalian 116622, China;2.Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Liaoning Dalian 116023, China)
ABSTRACT OBJECTIVE: To provide reference for elucidating the anti-allergic asthma constituents in alkaloids-free part of Ephedrae Herba. METHODS: Ephedrae Herba was extracted with 85% ethanol and n-heptane, and then subjected to solid-phase extraction (filler AC18) for pretreatment to enrich alkaloids-free part from the extract of Ephedrae Herba. HPLC method was adopted, and alkaloids-free fractions of Ephedrae Herba were performed on Unitary C18 column and Eclipse XDB-C18 column. Using high expression G protein coupled-receptor 35 (GPR35 receptor) in HT-29 cell as target, GPR35 receptor agonist zaprinast (1 μmol/L) as positive control, DMR response value as the detection index, the agonistic and desensitizing activity of each fraction (100 μg/mL) on GPR35 receptor was screened by label-free integrated pharmacological method, so as to screen active anti-allergic asthma fraction. HPLC-Q-TOF-MS method was used to identify the chemical composition of the selected active fractions. RESULTS: The alkaloids-free part of Ephedrae Herba was divided into two parts, involving the precipitated part before solid phase extraction and the 95% methanol elution part; from them, 20 fractions were screened. Among them, the precipitated fraction F1.5-F1.10 and 95% methanol eluted fraction F2.5-F2.10 had a strong agonistic activity on GPR35 receptor; at the same time, GPR35 receptor agonist zaprinast showed a relatively strong desensitization activity. The signal intensity of DMR induced by F1.5-F1.10 in the precipitated part of HT-29 cells was even higher than that of reference drug zaprinast. By HPLC-Q-TOF-MS analysis, 24 chemical components were identified from active fractions, involving 14 flavonoids, 2 volatile oils, 7 organic carboxylic acids, 1 anthraquinones. CONCLUSIONS: The alkaloid-free part of Ephedrae Herba is mainly flavonoids and has anti-allergic asthma activity.
KEYWORDS Ephedrae Herba; Alkaloids-free part; G protein coupled-receptor 35; Allergic asthma; Chemical component; Indentification
麻黄为草麻黄(Ephedra sinica Stapf)、中麻黄(Eph- edra intermedia Schrenk et C.A.Mey.)或木贼麻黄(Ephedra equisetina Bge.)的干燥草质茎,具有宣肺平喘、发汗解表、利水消肿等功效[1-2]。研究表明,麻黄中主要含有生物碱类、黄酮类、挥发油类、有机酚酸类和糖类等成分[3-6]。目前普遍认为麻黄生物碱类成分是其平喘的活性成分,其中的麻黄碱和伪麻黄碱可兴奋支气管平滑肌上的β2受体,从而达到平喘作用[7-8]。然而,麻黄生物碱类成分已报道的副作用也较多,比如可引起高血压、心肌梗死、震颤、痉挛、中风等[9]。近年来,关于麻黄中非生物碱类成分的研究引起了人们的重视。日本学者的最新研究表明,去除了生物碱的麻黄提取物与麻黄总提取物相比,前者镇痛、抗流感、抑制肿瘤转移等作用并无明显变化,同时还消除了麻黄生物碱引起的失眠、心律失常等典型副作用[10-11]。在前期研究中,本课题组通过大鼠实验对麻黄非生物碱类组分的抗过敏性哮喘作用进行了考察,结果表明这类组分具有显著降低致敏大鼠血清中免疫球蛋白E(IgE)和白三烯(LT)含量、显著减少全血和肺泡灌洗液中嗜酸性粒细胞(EOS)数量以及显著缩小肺组织炎症面积的作用(专利申请号:201711011998.5),这提示非生物碱类成分也可能是麻黄平喘的有效成分。
无标记细胞整合药理学技术(Cellular label-free integrative pharmacology,CLIP)是经谐振波导光栅生物传感器将细胞受药物刺激产生的动态质量重置(Dynamic mass redistribution,DMR)响应信号记录为可视化谱线[12],从而反映药物作用靶点和通路的技术。本课题组前期通过CLIP技术研究发现,麻黄非生物碱类成分草质素具有较强的激动G蛋白偶联受体35(GPR35)受体的活性[13],而GPR35受体被认为是哮喘治疗的新靶标[14-15]。因此,本研究拟通过对麻黄提取物进行非生物碱类组分富集和制备、活性组分筛选以及其化学成分质谱表征,进一步探讨麻黄非生物碱部位抗过敏性哮喘的有效成分及作用靶点,为阐明麻黄抗过敏性哮喘的药效物质基础提供理论依据。
1 材料
1.1 仪器
1290型高效液相色谱仪、6540型高分辨质谱仪(德国Agilent公司);LC-20A型半制备型高效液相色谱仪(日本Shimadzu公司);Milli-Q型去离子水发生器(美国Millipore公司);CX23型光学显微镜(日本Olympus公司);5415R型高速离心机(德国Eppendorf公司);Heracell 240i型CO2恒温培养箱(美国Thermo Fisher Scientific公司);Epic? 384孔生物感应器微型板、Epic?系统(美国Corning公司)。
1.2 药品与试剂
麻黄药材于2016年8月30日采自内蒙古地区,原植物经沈阳药科大学中药学院路金才教授鉴定为草麻黄(E. sinica Stapf)的干燥草质茎,标本保存于大连大学生命科学与技术学院标本室(标本号:20160830);敏喘寧标准品(美国Sigma-Aldrich公司,批号:Z0878,纯度:≥98%);二甲基亚砜(DMSO)溶液(美国Bio Basic公司,规格:500 mL);汉克斯平衡盐溶液(HBSS)和Mc Coys 5A培养液(美国Gibco公司);甲醇、甲酸为色谱纯,其他试剂均为分析纯,水为去离子水。
1.3 细胞
人直肠癌HT-29细胞购自中国科学院上海细胞生物学研究所细胞库。
2 方法与结果
2.1 麻黄非生物碱类组分的富集和制备
取麻黄干燥草质茎1 kg,用5倍量的85%乙醇(L/kg)在80 ℃回流提取3次,每次2 h;合并3次提取液,过滤后减压浓缩,得浓缩液250 mL(质量浓度为600 mg/mL,以提取物计,下同)。取该浓缩液50 mL,加500 mL甲醇,充分溶解;用相同体积正庚烷萃取3次,回收溶剂,得甲醇层提取物(128 g)和正庚烷层提取物。取甲醇层提取物1.25 g,分散于25 mL甲醇-水-甲酸(25 ∶ 75 ∶ 0.1,V/V/V)溶液中,离心(8 000 r/min)10 min,得到上清液部分25 mL(质量浓度为44 mg/mL)和沉淀部分135 mg。取该上清液0.5 mL,上样AC18 SPE柱(dp=60 μm,6 mL)[柱子用8 mL甲醇活化,8 mL甲酸-水(0.1 ∶ 100, V/V)溶液平衡],抽干SPE柱,弃去上样流出液;用8 mL 甲酸-水(0.1 ∶ 100,V/V)溶液淋洗AC18 SPE柱并抽干,收集淋洗液,即得淋洗液部分;再用8 mL甲醇-水-甲酸(5 ∶ 95 ∶ 0.1,V/V/V)溶液洗脱,收集洗脱液,即得5%甲醇酸水洗脱部分;最后用8 mL甲醇-水(95 ∶ 5,V/V)溶液洗脱,收集洗脱液,即得95%甲醇洗脱部分。其中,沉淀部分和95%甲醇洗脱部分为富集后的非生物碱部位,将这两部分用旋转蒸发仪蒸干,待用。
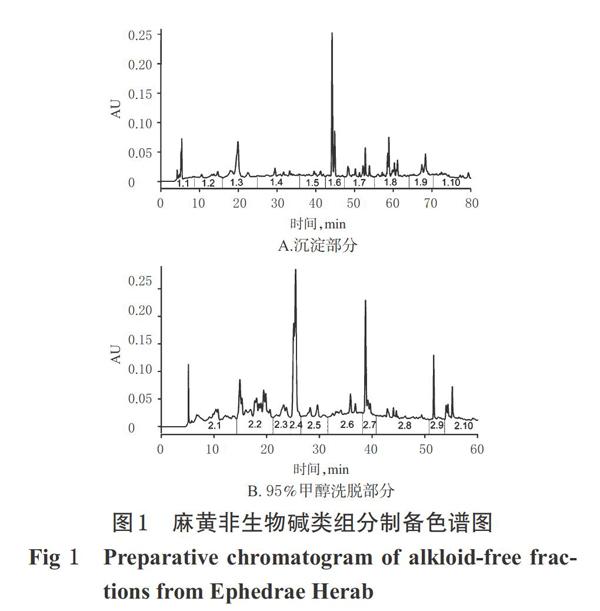
取上述沉淀部分样品,用甲醇-水(70 ∶ 30,V/V)溶解后,上样Unitary C18色谱柱(250 mm×4.6 mm,5 ?m)。设置色谱条件:流动相为甲醇(A)-0.1%甲酸-水(B),梯度洗脱(0~60 min,40%A→95%A;60~80 min,95%A);流速为0.5 mL/min;检测波长为315 nm;进样量为50 ?L。上样后按色谱峰进行流分收集。结果,共收集得到10个流分,记为F1.1~F1.10,结果详见图1A。
取上述95%甲醇洗脱部分样品,用甲醇-水(50 ∶ 50,V/V)溶液溶解后,上样Eclipse XDB-C18半制备型色谱柱(250 mm×9.4 mm,5 ?m)。设置色谱条件:流动相为甲醇(A)-0.1%甲酸-水(B),梯度洗脱(0~25 min,30%A→50%A; 25~50 min,50%A→95%A);流速为2 mL/min;检测波长为254 nm;进样量为50 ?L。上样后按色谱峰进行流分收集。结果,共得到10个流分,记为F2.1~F2.10,结果详见图1B。
2.2 麻黄非生物碱部位抗过敏性哮喘活性组分的筛选
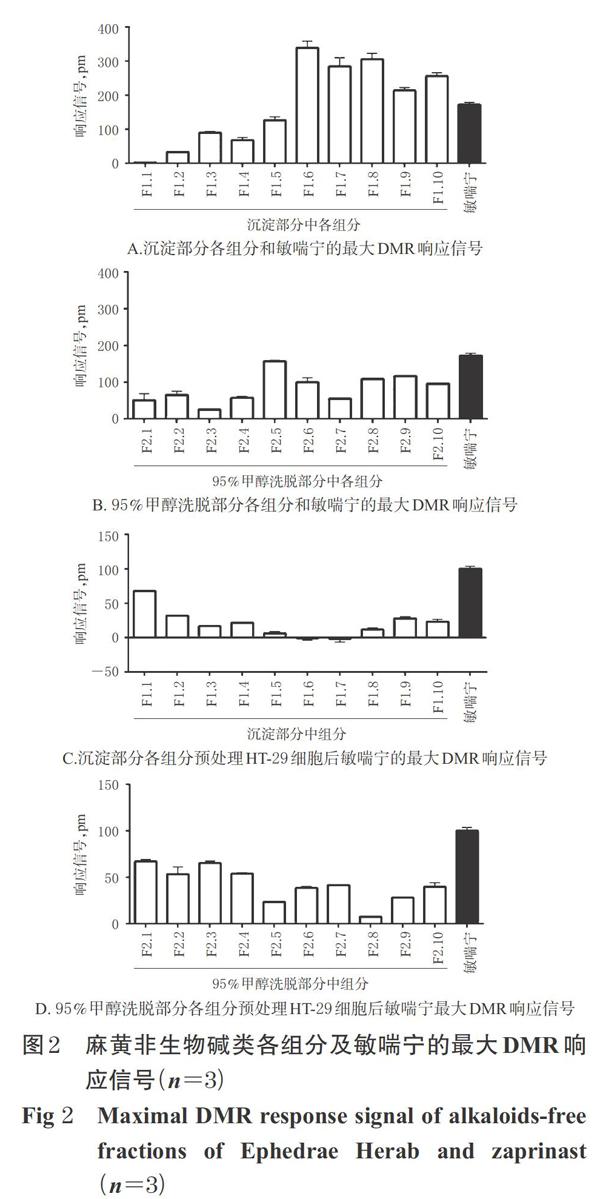
参考文献方法[13,16]进行试验。将处于对数生长期的HT-29细胞按3.0×104个/孔的密度接种到Epic?384孔生物感应器微型板中,置于5%CO2、37 ℃恒温培养箱中培养22~24 h。在检测之前将Epic?384孔板中的培养液弃掉,换上HBSS(30 ?L/孔),然后置于 Epic?系统上平衡孵育1 h后,分别进行激动试验和脱敏试验。(1)激动试验:在Epic?系统上建立一个2 min的基线,然后将待测组分(组分F1.1~F1.10和F2.1~F2.10,质量浓度均为100 μg/mL,均以含0.1%DMSO的HBSS溶解)按10 ?L/孔的量加入培养HT-29细胞的Epic? 384孔生物感应器微型板中,继续监测1 h。通过监测各组分引起的DMR响应信号来评价各组分对细胞内源性GPR35受体的激动活性。同时,以GPR35受体激动剂敏喘宁(1 μmol/L,10 ?L/孔)作为阳性对照。每个样品平行设置3个复孔。(2)脱敏试验:在Epic?系统上建立一个2 min的基线,然后将待测组分(组分F1.1~F1.10和组分F2.1~F2.10,质量浓度均为100 μg/mL)或等量含0.1%DMSO的HBSS(即阳性对照,考察无脱敏情况下敏喘宁引起的DMR信号强度),按10 ?L/孔的量加入培养HT-29细胞的Epic? 384孔生物感应器微型板中,预处理HT-29细胞1 h,然后加入敏喘宁(1 ?mol/L,10 ?L/孔)继续处理1 h。通过监测各组分预处理后敏喘宁引起的DMR响应信号来评价各组分对敏喘宁的脱敏作用。每个样品平行设置3个复孔。DMR数据由Epic Imager软件记录,并经Imager Beta 3.7软件处理。采用Microsoft Excel 2010和GraphPad Prism 6软件进行统计分析。所有的DMR信号均经空白校正得到。测定结果详见图2。
结果显示,沉淀部分中组分F1.1~F1.10(100 μg/mL)在激动试验中引起了HT-29细胞不同程度的DMR响应信号(见图2A)。其中以组分F1.5~F1.10引起的DMR响应信号最强(强度均大于200 pm),甚至超过了敏喘宁(1 μmol/L)在细胞上引起的DMR响应信号,且在脱敏试验中其均可明显地抑制敏喘宁在HT-29细胞上引起的DMR响应信号(见图2C),这说明沉淀部分中组分F1.5~F1.10可能具有GPR35受体激动活性。95%甲醇洗脱部分中组分F2.1~F2.10在激动试验中也引起了HT-29细胞不同程度的DMR响应信号(见图2B)。其中以组分F2.5~F2.10引起的DMR响应信号最强,且在脱敏试验中其可不同程度地抑制敏喘宁(1 μmol/L)在细胞上引起的DMR响应信号(见图2D),这说明95%甲醇洗脱部分中组分F2.5~F2.10可能具有GPR35受体激动活性。但从整体情况而言,沉淀部分中组分F1.5~F1.10对GPR35受体的激动活性较95%甲醇洗脱部分中组分F2.5~F2.10更强。
2.3 麻黄非生物碱类抗过敏性哮喘活性组分的成分鉴定
采用高效液相色譜-四极杆飞行时间质谱(HPLC- Q-TOF-MS)技术进行成分鉴定。
2.3.1 色谱条件 色谱柱:C18ME反相色谱柱(150 mm×2.1 mm,5 ?m);流动相:A相为甲醇,B相为0.1%甲酸水溶液;流速:0.2 mL/min;柱温:30 ℃;洗脱条件:组分F1.5(0~40 min,40%A→90%A;40~50 min,90%A),组分F1.6(0~40 min,40%A→95%A;40~50 min,95%A),组分F1.7、F1.8(0~40 min,70%A→90%A;40~50 min,90%A),组分F1.9(0~20 min,40%A→90%A;20~50 min,90%A),组分F1.10(0~40 min,40%A→90%A;40~50 min,90%A),组分F2.5(0~30 min,25%A→60%A;30~30.1 min,90%A→95%A;30.1~40 min,95%A),组分F2.6、F2.7(0~30 min,40%A→90%A;30~40 min,90%A),组分F2.8(0~30 min,40%A→90%A;30~30.1 min,90%A→95%A;30.1~40 min,95%A),组分F2.9、F2.10(0~20 min,20%A→90%A;20~20.1 min,90%A→95%A;20.1~40 min,95%A);进样量:20 μL。
2.3.2 质谱条件 在正、负离子模式下检测;离子源:双电喷雾离子源(Dual_ESI);电离电压:4.5 kV;雾化气压力:35 psi;气体温度:350 ℃;干燥器流速:8.0 L/min;检测模式:飞行时间全扫描质谱模式和二级质谱(MS/MS)模式;碰撞电压:3 500 V;MS-MS碰撞能量:30 eV;扫描范围:质荷比(m/z)100~1 000。
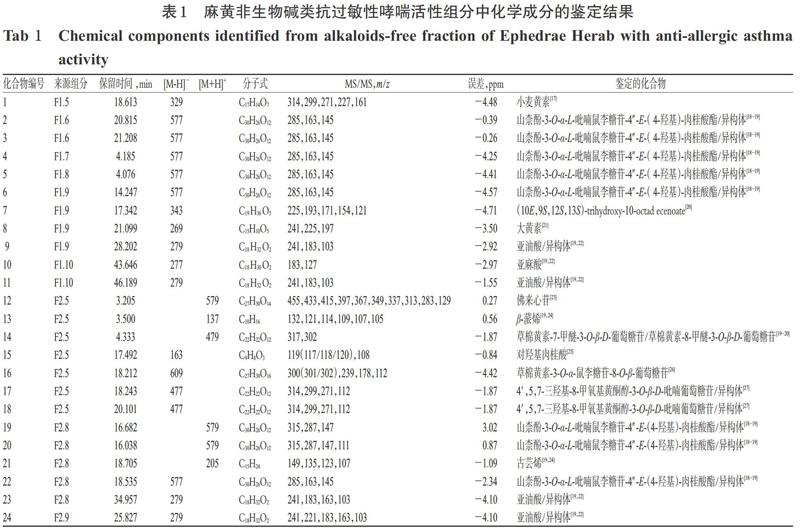
2.3.3 活性组分的成分鉴定 取沉淀部分中组分F1.5~F1.10和95%甲醇洗脱部分中组分F2.5~F2.10各适量,分别用甲醇-水-甲酸(70 ∶ 30 ∶ 0.1,V/V/V)和甲醇-水-甲酸(50 ∶ 50 ∶ 0.1,V/V/V)溶解,制成质量浓度均为100 ?g/mL的样品溶液。分别按“2.3.1”“2.3.2”项下条件进样测定,记录图谱。采用Qualitative Analysis B.04.00分析软件对质谱数据进行处理。通过查阅Chemspider、NIST和Mzcloud质谱数据库并结合相关文献,对化合物的二级碎片信息进行比对。结果,共鉴定出了24个化合物,其中黄酮类14个、挥发油类2个、有机羧酸类7个、蒽醌类1个。麻黄非生物碱类抗过敏性哮喘活性组分中化学成分的鉴定结果见表1。
2.3.4 化合物的裂解特征分析 從每类化合物中分别选取1个代表成分进行裂解特征分析。
(1)黄酮类代表成分——化合物2。化合物2的保留时间为20.815 min,ESI-模式下的准分子离子峰为 m/z 577[M-H]-,脱去1分子鼠李糖基m/z 163[Rha]-,再脱去1分子肉桂酸酯基m/z 145[C9H7O3]-后,形成山柰酚碎片离子峰m/z 285[M-H-Rha-C9H7O3]-。结合麻黄文献报道[18-19],推测该化合物为山柰酚-3-O-α-L-吡喃鼠李糖苷-4″-E-(4-羟基)-肉桂酸酯。化合物2的MS/MS图见图3。
(2)蒽醌类代表成分——化合物8。化合物8的保留时间为21.099 min,ESI-模式下准分子离子峰为m/z 269[M-H]-,脱去1分子一氧化碳形成m/z 241[M-H- CO]-,再脱去1分子氧形成m/z 225[M-H-CO-O]-。结合麻黄文献报道[21],推测该化合物为大黄素。化合物8的MS/MS图见图4。
(3)有机酸类代表成分——化合物15。化合物15的保留时间为17.492 min,ESI-模式下准分子离子峰为 m/z 163[M-H]-,脱去1分子二氧化碳形成m/z 119[M-H- CO2]-,再脱去1分子碳形成m/z 108[M-H-CO2-C]-。结合麻黄文献报道[25],推测此化合物为对羟基肉桂酸。化合物15的MS/MS图见图5。
(4)挥发油类代表成分——化合物13。化合物13的保留时间为3.500 min,ESI+模式下准分子离子峰为 m/z 137[M+H]+,然后一种方式是脱去1分子甲基形成 m/z 121[M+H-CH3]+,再脱去1分子亚甲基形成m/z 109[M+H-CH3-CH2]+;另一种方式是脱去2分子甲基直接形成m/z 107[M+H-2CH3]+。结合麻黄文献报道[19,24],推测该化合物为β-蒎烯。化合物13的MS/MS图见图6。
3 讨论
麻黄提取物中化学成分复杂,而本研究主要针对麻黄非生物碱部位进行分析研究,为减少生物碱部位对试验的干扰,在富集前应对样品进行一定的前处理。笔者前期参考相关文献[28-30]后考察了3种非生物碱类成分富集方法的富集效果,分别为液-液萃取法(萃取溶剂分别为二氯甲烷+乙醇和二氯甲烷+盐酸)、732型强酸性阳离子交换树脂法和固相萃取法(AC18SPE柱)。结果前2种方法存在回收率低、操作复杂等问题;而固相萃取法解决了上述问题,且富集速度较快、重现性良好。选定方法后,笔者又在文献报道[30]基础上[甲酸-水(0.1 ∶ 100, V/V)淋洗得到生物碱部位,甲醇洗脱得到非生物碱部位]进行条件优化,最终选定了以甲酸-水(0.1 ∶ 100,V/V)、甲醇-水-甲酸(5 ∶ 95 ∶ 0.1,V/V/V)和甲醇-水(95 ∶ 5,V/V)依次淋洗作为固相萃取条件。
在对沉淀部分进行组分制备时,本研究选用了分析型色谱柱而非制备型色谱柱,是考虑到试验过程中的样品用量很少,采用CLIP筛选活性组分以及利用高分辨质谱仪进行化学成分分析用的样品量均只需1 mg左右;其次,分析型色谱柱的柱效比制备型色谱柱高,可以得到更多流分,更有利于后期活性组分的筛选。但从制备化合物的角度讲,此方法有一定局限性。
在活性组分筛选试验中,选用的人直肠癌HT-29细胞能够高度表达GPR35受体。其中激动试验是为了评价各组分在HT-29细胞上引起的DMR响应信号;脱敏试验是为了验证组分在HT-29细胞上引起的DMR响应信号是特异性激活GPR35受体造成的。如果组分在HT-29细胞上引起了DMR响应信号,并且能降低GPR35受体激动剂敏喘宁的DMR响应信号,那么就可确定该组分是GPR35受体的激动剂。组分的DMR激动信号越强、对敏喘宁的DMR信号降低效果越强,则说明该组分的活性越好。通过本研究试验,初步筛选出了12个活性组分。查阅文献[13]发现,具有GPR35受体激动活性的天然化合物多为黄酮类成分,如草质素、槲皮素等。本研究从12个活性组分中共鉴定、表征出了24个化合物,包括黄酮类[如小麦黄素、山柰酚-3-O-α-L-吡喃鼠李糖苷-4″-E-(4-羟基)-肉桂酸酯、草棉黄素-3-O-α-鼠李糖苷-8-O-β-葡萄糖苷]、蒽醌类(如大黄素)、挥发油类(如β-蒎烯、古芸烯)和有机酚酸类(如对羟基肉桂酸)等天然成分。目前还没有相关文献报道这些成分是否具有抗过敏性哮喘活性,但是基于CLIP活性筛选试验,笔者推测已表征出的化合物可能具有抗过敏性哮喘的作用,但这需要进一步的验证。故后期笔者拟通过计算机辅助药物设计中的分子对接技术,去探究已表征出的天然化合物与GPR35受体蛋白靶点的作用方式,以期获得相关数据和理论支持。
综上,麻黄非生物碱类部位中主要以黄酮类成分为主,其具有一定的抗过敏性哮喘活性,这为阐明麻黄平喘的药效物质基础及临床应用提供了理论基础,也为麻黄这一重要药用植物资源的有效利用提供了实验参考。
参考文献
[ 1 ] 中国科学院植物研究所.中国植物志:第7卷[M].北京:科学出版社,1979:468.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版. 北京:中国医药科技出版社,2015:300.
[ 3 ] HONG H,CHEN HB,YANG DH,et al. Comparison of contents of five ephedrine alkaloids in three official origins of Ephedra Herba in China by high-performance liquid chromatography[J]. J Nat Med,2011,65(3/4):623-628.
[ 4 ] 孙兴姣,李红娇,刘婷,等.麻黄属植物化学成分及临床应用的研究进展[J].中国药事,2018,32(2):201-209.
[ 5 ] ZANG X,SHANG M,XU F,et al. A-type proanthocyanidins from the stems of Ephedra sinica (Ephedraceae) and their antimicrobial activities[J]. Molecules,2013,18(5):5172-5189.
[ 6 ] 李佳莲,方磊,张永清,等.麻黄的化学成分和药理活性的研究进展[J].中国现代中药,2012,14(7):21-27.
[ 7 ] VANSAL SS,FELLER DR. Direct effects of ephedrine isomers on human beta-adrenergic receptor subtypes[J]. Biochem Pharmacol,1999,58(5):807-810.
[ 8 ] 郑孟凯,陶雪芬,钱微微,等.不同地区市售麻黄药材中盐酸麻黄碱、盐酸伪麻黄碱和总生物碱的含量测定[J].中国药房,2015,26(12):1682-1685.
[ 9 ] Centers for Disease Control and Prevention. Adverse eve- nts associated with ephedrine-containing products-texas,December 1993-September 1995[J]. JAMA,1996,276(21):1711-1712.
[10] HYUGA S,HYUGA M,OSHIMA N,et al. Ephedrine alkaloids-free Ephedra Herb extract:a safer alternative to ephedra with comparable analgesic,anticancer,and anti-influenza activities[J]. J Nat Med,2016,70(3):571- 583.
[11] KOBAYASHI Y. Analgesic effects and side effects of Ephedra Herb extract and ephedrine alkaloids-free ephedra herb extract[J]. Yakugaku Zasshi,2017,137(2):187- 194.
[12] FANG Y. The development of label-free cellular assays for drug discovery[J]. Expert Opin Drug Discov,2011,6(12):1285-1298.
[13] 侯滔,史丽颖,何牮,等.两个黄酮类化合物对GPR35受体激动活性的研究[J].中国科学:生命科学,2016,46(2):192-198.
[14] YANG Y,LU JY,WU X,et al. G-protein-coupled receptor 35 is a target of the asthma drugs cromolyn disodium and nedocromil sodium[J]. Pharmacology,2010,86(1):1-5.
[15] ADAMS R,WORTH CL,GUENTHER S,et al. Binding sites in membrane proteins-diversity,druggability and prospects[J]. Eur J Cell Biol,2012,91(4):326-339.
[16] DENG H,HU H,LING S,et al. Discovery of natural phenols as G protein-coupled receptor-35 (GPR35) agonists[J]. ACS Med Chem Lett,2012,3(2):165-169.
[17] 芮雯,冯毅凡,刘守钾,等.毛茛黄酮类成分的UPLC HILIC/Q-TOF-MS分析[J].亚太传统医药,2011,7(8):18- 21.
[18] GARCEZ WS,YOSHIDA M,GOTTLIEB OR. Benzylisoquinoline alkaloids and flavonols from Ocotea vellosiana[J]. Phytochemistry,1995,39(4):815-816.
[19] 张丹.草麻黄表观型化学组成特征研究 柳叶白前化学成分的研究[D].北京:北京协和医学院,2014.
[20] 陶华明.麻黄根及羊齿天门冬化学成分研究[D].长春:吉林大学,2009.
[21] 雍潘,刘圆,吕露阳,等.基于UPLC-ESI-HRMSn技术的藏药塔黄的化学成分分析[J].中草药,2019,50(5):1066- 1074.
[22] 戚军超,周海梅,马锦琦,等.牡丹籽油化学成分GC-MS分析[J].粮食与油脂,2005,11(11):23-24.
[23] 李小栋.桂枝麻黄各半汤化学成分的液相色谱-质谱分析及其抗炎活性研究[D].杭州:浙江工业大学,2015.
[24] 李睿,曾岑,王平,等.基于GC-MS和UPLC-Q-TOF-MS的麻黃汤化学成分识别[J].中国中药杂志,2014,39(4):704-709.
[25] 冯美玲,王书芳,张兴贤.枸杞子的化学成分研究[J].中草药,2013,44(3):265-268.
[26] PUREV O,POSPISIL F,MOTL O. Flavonoids from Ephedra sinica stapf[J]. Collect Czech Chem Commun,1988,53(12):3193-3196.
[27] 周玲,吴德康,唐于平,等.麻黄中化学成分研究进展[J].南京中医药大学学报,2008,24(1):71-74.
[28] 范彦博.麻黄中非生物碱类成分活性研究[D].武汉:湖北中医药大学,2010.
[29] OSHIMA N. Efficient preparation of ephedrine alkaloids- free Ephedra Herb extract and its antitumor effect and putative marker compound[J]. Yakugaku Zasshi,2017,137(2):173-177.
[30] 史丽颖,陈瑶,卢轩,等.麻黄中生物碱类成分富集新方法及化学成分分析[J].中国实验方剂学杂志,2018,24(21):56-61.
(收稿日期:2019-11-20 修回日期:2020-03-20)
(编辑:林 静)
