对氨基苯甲酸合成实验的改进*
2020-07-22谢珺
谢 珺
(贵州医科大学药学院,贵州 贵阳 550004)
有机化学实验是化学学科重要的基础课,实验开设的目的是培养学生掌握有机化学的基本技能和基础知识,验证和加深有机化学的基础理论、有机化合物和有机反应的理解,培养学生正确选择有机化合物的合成、分离与鉴别的方法,培养学生的创新思维和能力,培养学生理论联系实际、实事求是、细致严谨的科学态度和良好的工作作风。药学专业毕业的大部分学生将进入制药行业,无论哪家制药企业都要求学生具有较强的实践能力和药学背景知识。学生在校期间获得较为系统的有机化学实验的培训,主要通过课堂教学来实现的,所以实验的内容和方法的改进对培养学生的实践能力和创新精神是很有帮助的。
对氨基苯甲酸的合成是大学有机化学的经典实验,对氨基苯甲酸是合成局部麻醉剂苯佐卡因的重要中间体,以对氨基苯胺为原料,经酰化、氧化、水解、酯化一系列的反应后可以的目标化合物。原料易得,操作方便,适合实验室的小量制备。以简单的原料合成复杂的分子是有机化合物最重要的任务之一,也是有机化学最有活力的领域,科研离不开合成,完成有机合成,除了制定合理的路线,娴熟的实验操作也是必不可少的条件。对氨基苯甲酸的实验一般是安排在实验课最后才开设的实验内容,学生掌握一些最基本的操作后,从原料开始,经过几步,合成复杂的分子,培养学生有机合成的基本功[1]。
有机合成中多步骤反应,各步反应对总产率都有累加的影响,对氨基苯甲酸的合成涉及三个反应。第一个反应是将对甲苯胺用乙酸酐处理转变为相应的酰胺,目的保护氨基;第二步是对甲基乙酰苯胺中的甲基用高锰酸钾氧化为相应的羧酸;最后一步是酰胺的水解,除去保护作用的乙酰基。对氨基苯甲酸的实验提供给学生将一个产物用于随后步骤的经验,从简单易得的原料合成有用的药物或中间体,其目的在于激发学生的兴趣,同时强调实验中的严谨的科学态度和良好的实验技能对获得目标产物的重要性。
1 实验原理
对氨基苯甲酸的合成路线如下:
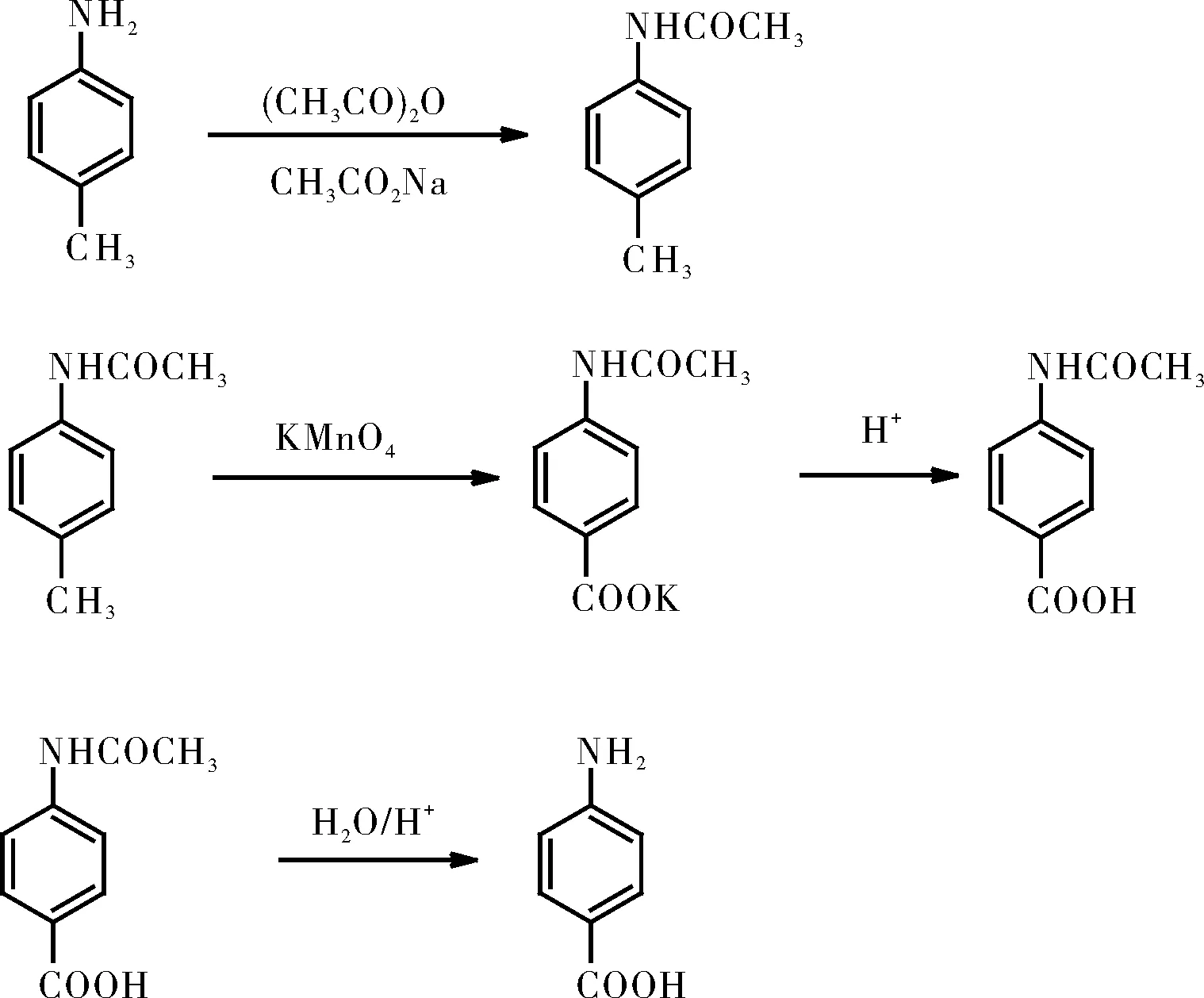
2 实验教学中存在的问题
在多年的教学的实践中,发现学生操作第二步甲基的氧化和第三步水解保护氨基的乙酰基反应存在很大的问题。
第二步甲基的氧化,实验教材中对氨基乙酰苯胺约3.5 g,高锰酸钾的用量是10.3 g,按照对甲基乙酰胺苯胺和高锰酸钾的摩尔比是1∶2计算,计算出高锰酸钾的用量6.3 g,实验教材中高锰酸钾的量是实际计算量的一倍,如果学生按教材的用量,就会发现在加完高锰酸钾后,搅拌15 min,反应液依然是紫色,按照实验教材的描述,需要加乙醇煮沸直至紫色消失,教材乙醇的用量是1~1.5 mL,但是仅仅加1.5 mL的乙醇是不够。因为高锰酸钾过量在学生实际操作的时候,剩余大量的高锰酸钾没有完成溶解,造成比较的浪费。高锰酸钾的还原产物二氧化锰在后处理的时候需要用滤纸抽滤,学生在这步操作为了得到无色滤液需要重复3~5次,滤纸的用量按实验教材的介绍用两层达不到抽滤的效果,因为二氧化锰的颗粒太细了,通常学生用五层,抽滤效果会比较理想。由于高锰酸钾的过量,导致了乙醇和滤纸的过量使用。
第三步水解保护氨基的乙酰基,实验教材是加盐酸回流后,“待反应液冷却后,加入15 mL冷水,然后加10%氨水中和,使反应液混合物对石蕊试纸恰成碱性,切勿使氨水过量。每30 mL最终液体加1 mL冰醋酸,充分摇振后置于冰浴中骤冷以引发结晶,必要时用玻璃棒摩擦瓶壁或者放人晶种引发结晶[1]。”按教材操作很多同学得不到最终产物,最主要的原因之一用石蕊试纸判断恰好到碱性,当石蕊试纸变蓝的时候,溶液的pH值已经过来对氨基苯甲酸的等电点,有的同学在操作中发现在滴加氨水的过程中,有白色固体出现,但石蕊试纸没有变蓝,于是继续滴加氨水,白色固体消失,继续滴加氨水直到石蕊试纸变蓝的时候,实际操作氨水已经过量了。再以每30 mL最终液体加1 mL冰醋酸,最后大部分同学很难结晶得到目标产物。分析原因有两方面,一方面石蕊试纸的变色从粉色到粉蓝色变化不是很明显不利于判断:另一方面同学的操作经常是氨水过量用酸调,酸过量又用氨水调反反复复,溶液太多很难结晶。
3 实验教学的改进
第二步甲基的氧化,在实际教学中,高锰酸钾的用量应该减半,因为学生在第一步对甲基乙酰苯胺的制备,由于多种原因不可能得到实验教材给的参考值3.5 g。高锰酸钾即使按教材量减半,也还有部分同学在抽滤时,滤液是紫色,说明同学在合成对氨基乙酰苯胺时,产率不高,消耗不了理论计算需要的高锰酸钾。另外在抽滤二氧化锰的时候滤纸可以增加到用五张滤纸,抽滤效果比较好,可以减少抽滤的重复操作,缩短实时间,提高效率。
第三步水解保护氨基的乙酰基,对氨基苯甲酸是既有羧基也有氨基的两性物质,其等电点PI=4.7~4.9[2],等电点是每一种氨基酸的特定常数,在等电点时,氨基酸的水溶性最小。对氨基苯甲酸在等电点时,溶解度最小,利用这一性质进行分离提纯。通过实验我们发现用pH试纸代替石蕊试纸,直接调pH=5,就可以有固体析出得到产物[2]。pH试纸的颜色变化明显,学生容易判断酸碱的变化,一般情况,当pH=5时,就会出现白色固体,如果没有固体生成,用玻璃棒摩擦烧杯内壁,也会出现白色固体,提高了实验的成功率。
4 实验步骤
(1)对氨基乙酸苯胺的合成
在250 mL烧杯中,加入3.8 g(0.035 mol)对甲苯胺,90 mL水和3.8 mL浓盐酸,水浴上溶解,加4.2 mL(0.043 mol)醋酸酐和6 g结晶醋酸钠的水溶液,充分搅拌后将混合物冷却,析出白色固体。抽滤,用少量冷水洗涤,干燥后称重。
(2)对乙酰氨基苯甲酸的合成
在250 mL烧杯中,加入对氨基乙酰苯胺约3.5 g、10 g七水合结晶硫酸镁和175 mL水,将化合物在水浴上加热到约85 ℃,同时将5 g高锰酸钾溶于20 mL沸水中。充分搅拌下,将热的高锰酸钾溶液在30 min内分批加到对氨基乙酰苯胺的混合物中,避免局部浓度过高破坏产物。
加完后,在85 ℃继续搅拌15 min,混合物颜色变深棕色,用五层滤纸趁热过滤,除去二氧化锰。若滤液呈紫色,需要加入乙醇煮沸,直至紫色消失。将滤液反复抽滤,直到滤液为无色。
无色滤液中加入20%硫酸酸化至溶液呈酸性,有白色固体生成,抽滤,压干,干燥,称重得白色固体约2 g。
(3)对氨基苯甲酸的合成
称量上步的产品对乙酰氨基苯甲酸,每克湿重产物用5 mL 18%盐酸水解。反应物置于圆底烧瓶中,电炉小火加热缓缓回流30 min,反应物冷却后,用氨水调到pH=5,白色固体析出。抽滤、干燥、称重、测熔点。
5 结 语
我们在开设2016级药学,2017级药学和2018级药学有机化学实验时,已经改变了实验方法。在2017级药学班我们尝试同一实验室的同学,部分学生按实验教材的方法实验,部分同学按改进后的方法。我们发现产率并没有太大的区别,但是避免高锰酸钾的浪费,最后的结晶直接用氨水调pH值的同学可以比较快的得到产品。
减少高锰酸钾的用量对实验室的管理和避免浪费都是有益的,因为在实验过程中如果按教材给的量进行反应,会有很多同学剩余大量高锰酸钾,没有及时回收,即使回收后期处理也比较麻烦。该实验的改进也是将绿色化学的理念[3-4]贯穿于有机实验,绿色化学指在制造和应用化学产品时应有效利用原料,消除废物和避免使用有毒的和危险的试剂和溶剂。减少高锰酸钾试剂的用量,源头上减少对环境的污染。让同学们身体力行的感受绿色化学不仅仅是一个概念,可以在实践中体会绿色化学的含义。
最后一步直接用氨水调节pH值的。利用对氨基苯甲酸的等电点来分离提纯化合物,可以将有机化学理论课讲过的氨基酸等电点基本概念在实验课上得到应用,枯燥的有机理论可以指导实验的操作,理论课和实验课是相辅相成的关系。通过实验的改进,同学们可以体会到实践才是检验的标准,不同的方法可以得到相同的实验结果,优化实验条件也是有机合成是很重要的一部分。
有机化学是药学、医学、化工等专业的基础,实验课的开设对有机化学的学习非常重要,按照实验教材完成基本内容、基础操作,有利于培养学生的有机化学的基本功,但是改变固定思维,培养具有创新性的人才是时代的要求。对氨基苯甲酸实验的改进,是在学生的实践的基础上,根据实际操作合理的调整试剂的用量,结合有机化学的理论改进实验方法。该实验的改进,有利于扩展学生的思路,提高综合素质[5]。
