高度单分散的SnO2/含碳复合材料制备及电化学性质*
2020-07-22李丽丽廖鸿昊李龙龙
李丽丽,李 伟,廖鸿昊,李龙龙
(1.东北石油大学 化学化工学院,黑龙江 大庆 163318)
作为一种宽带隙的n型半导体,SnO2可广泛应用于催化、阳极锂离子电池、气体传感、[1-3]透明电极[4]等。这主要归功于宽带半导体(如在300 K,Eg=3.6 eV)具有较强的稳定性,高的灵敏度和低成本。纳米SnO2与电解质接触面积大,环境友好,理论电容量高,是一种很有吸引力的阳极材料[5-6]。在反复的充电/放电过程中,由于收缩和体积的巨大膨胀造成循环寿命降低,阻碍了SnO2材料的利用性[7]。为了解决锂电池的SnO2阳极问题,目前广泛采用的方法是利用其他导电物质,例如碳[8-10]、石墨素[11]和导电聚合物[12-13]等来提高其导电性。其中碳质纳米材料具有较高的导电性,并表现出优良的电化学性能。
研究发现,含碳复合材料表现出良好的力学性能和高导电性[14-16]。Yuan课题组利用胶状碳球为模板,聚吡咯作为碳源合成了SnO2/聚吡咯空心球体[17]。以油酸为原料,Miao课题组获得了SnO2/碳复合材料,该复合材料经过100个循环,电容量保持率约为60.5%[18]。Zhang[19]课题组在碳纳米纤维上通过电沉积的方法合成了可用作钠离子电池阳极材料的SnO2/碳复合材料。Qi[20]课题组得到了三维(3D)石墨/SnO2纳米棒阵列/聚苯胺(PANI)混合结构,该结构表现出了很高的电容量,良好的电化学稳定性。Lou课题组[21]通过以葡萄糖为碳源的水热法制备了碳涂层的SnO2。
目前为止,以乙醇为碳源来合成SnO2/含碳复合材料仍然是一个挑战。作者通过乙醇的醇解作为碳源,制备了SnO2/含碳复合材料,并讨论了结构性能与电化学性能的相关性,研究了样品组成、形貌对Li+电池的电化学性能的影响。该方法可应用于多系列半导体/含碳复合材料的合成应用,过程非常简单、绿色环保、一步完成。
1 实验部分
1.1 试剂与仪器
SnCl4·5H2O、无水乙醇、碘(I2)、甲基橙(MO)、NaCl:分析纯,中国医药集团。
X射线粉末衍射仪(XRD):D/max-2200PC,日本理学公司;扫描电子显微镜(SEM):JSM-6360LA,日本电子公司;透射电子显微镜(TEM):JEOL-1200EX,日本日立公司;傅里叶变换红外光谱仪(FTIR):Tensor 27,德国布鲁克光谱仪器厂;电化学工作站:CHI660E,上海辰华仪器有限公司。
1.2 实验方法
1.2.1 SnO2/含碳复合材料
将0.01 mol SnCl4·5H2O、0.000 1 mol NaCl和0.24 g I2溶解在30 mL乙醇中。然后将溶液转移到50 mL的水热釜中,在160 ℃加热24 h后冷却,用乙醇和去离子水离心纯化5次,样品在60 ℃烘干12 h。
1.2.2 SnO2/含碳复合材料电化学测试
室温下,以锂金属和参考电极自制双电极电池进行电化学测量[22]。工作电极由m(活性材料)∶m(导电剂)∶m(黏合剂)=80∶10∶10组成。电解质是c(LiPF6)=1 mol/L在m(乙烯碳酸酯)∶m(碳酸二乙酯)=50∶50中混合。在一个充满气体的气体箱中进行电池组装,其中的水分和氧气质量分数低于10-6。在200 mA/g的恒定电流密度下,根据活性物质与电化学工作站测量了电池的放电周期,电压为0~3 V。
2 结果与讨论
2.1 SnO2/含碳复合材料的XRD谱图
SnO2/含碳复合材料的XRD谱图见图1。

2θ/(°)
由图1可知,样品是四边形,每个峰的位置都与图谱JCPDS 01-088-0287相似,峰形说明了SnO2具有很好的结晶度。没有出现结晶状态的碳,说明碳以无定型状态存在或者是以含碳化合物形式存在的。
2.2 SiO2/含碳复合材料的形貌及组成分析
SiO2/含碳复合材料的形貌及组成图片见图2。
图2a~2c为利用无模板法制备的多孔SnO2/含碳复合材料,直径为100~200 nm。该纳米粒子形貌特殊,表面是由直径为20~50 nm的纳米颗粒松散地堆积而成(图2a)。图2b、2c为SnO2/含碳复合材料不同放大率的TEM图片。从图2c明暗对比可以看出,每个SnO2纳米粒子表面都有一层光亮二阶层面,该二阶层面就是含碳复合材料形成的。图2d中晶格条纹清晰可见,c值为0.33 nm,对应于(110)晶面,具有很高的结晶度。同时也证明含碳复合材料不仅在表面存在,而且渗透到内部。通过EDS分析了样品的结构(图2e),从图中可以看出样品由O、C和Sn 3种元素组成(图2e)。其中w(碳)=4.6%,这证明了样品中存在含碳材料。

a SnO2/含碳复合材料的SEM图片
2.3 SiO2/含碳复合材料的FTIR谱图
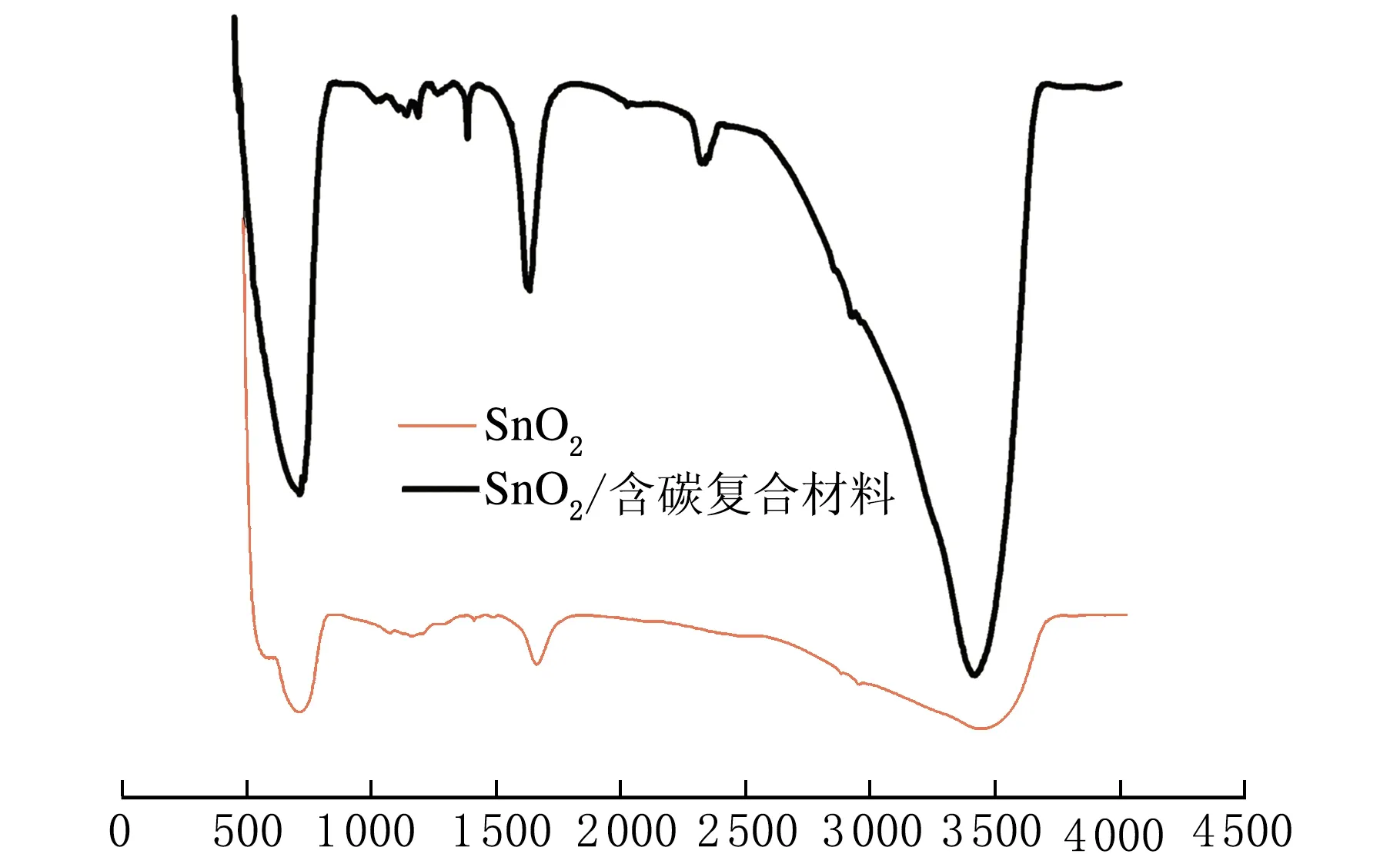
SnO2和SnO2/含碳复合材料的FTIR光谱见图3。
σ/cm-1
图3中500~700 cm-1处为典型的Sn—O伸缩振动峰。在1 640 cm-1处的峰为H—O—H弯曲振动峰,在3 400~3 500 cm-1处的峰对应于—OH伸缩振动峰,产生此结果的原因是表面吸附水和—OH所致。在约1 400 cm-1,峰值是COO-—的振动峰,是乙醇碳化过程中产生的含氧基团[23]。通过FTIR图谱可以看出样品中不仅含有SnO2,还含有碳元素,说明所制备的是SnO2/含碳复合纳米材料。
2.4 c(NaCl)对SiO2/含碳复合材料形貌的影响
不同c(NaCl)条件下合成的SnO2/含碳复合材料的TEM图见图4。

a c(NaCl)=0.016 7 mol/L
由图4可知,当加入c(NaCl)=0.016 7 mol/L,形成米粒状,直径为1~2 nm的纳米材料(图4a)。当加入c(NaCl)=0.013 3 mol/L时,变为由纳米颗粒聚集的絮状结构(图4b)。当c(NaCl)=0.011 7 mol/L时,一些粒子聚集到直径为100~150 nm的球体中(图4c)。c(NaCl)=0.01 mol/L,样品是球体(图2)。
该结果证明c(NaCl)影响了SnO2/含碳复合材料的形貌。c(NaCl)一方面改变了溶液的离子强度,另一方面改变了无机阴离子的介电常数[24]。阴离子的水化作用使形貌由米粒状向球状转变。通过控制c(NaCl),可以得到更多形貌的SnO2/含碳复合材料。图4a~4c为SnO2/含碳复合材料的HRTEM图像。说明SnO2/含碳复合材料具有很好的结晶度。
2.5 c(NaOH)对SiO2/含碳复合材料形貌的影响
不同c(NaOH)制备的SnO2/含碳复合材料的不同放大率的SEM图见图5。

a c(NaOH)=0.003 33 mol/L
由图5可知,c(NaOH)=0.003 33 mol/L,得到直径在30~50 nm的不规则沙状粒子(图5a、5b)。c(NaOH)=0.016 7 mol/L,得到直径为6~12 μm的微球(图5c、5d)。产生该结果的原因是NaOH提供的OH-,并加速了Sn4+转换为SnO2。通过控制c(NaOH),可以得到多形貌的SnO2/含碳复合材料。
SnO2/含碳复合材料的电化学测试以及样品作为电极的在锂离子电池中储电性能研究见图6。
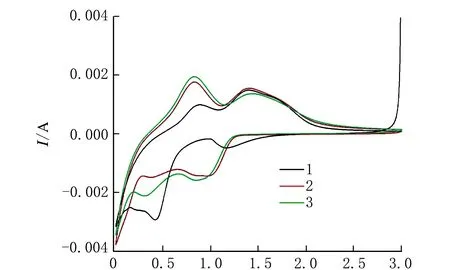
U/Va 循环伏安曲线
在前3个充电/放电周期中,该循环伏安(CV)曲线是以0.5 mV/s的速度对SnO2/含碳复合材料进行扫描,测试电压为0.01~3 V。图6a是SnO2/含碳复合材料的前3个周期CV曲线。在第1个周期中,在阳极和电解质之间,阳极表面形成了固态电解质间相膜[25]。固相间膜SnO2分解形成Sn(SnO2+4Li++4eSn+2Li2O)。图6b显示了当前密度为200 mA/g时,SnO2/含碳复合材料和纯SnO2的循环性能。在50个周期内,SnO2电容量下降到278.2 mAh/g。但对于SnO2/含碳复合材料,其电容量下降到350.2 mAh/g。表明加入含碳复合材料后提高了电极的容量和稳定性。电化学实验表明,SnO2/含碳复合材料具有较好的稳定性。
3 结 论
通过绿色环保的一步水热方法,得到了以乙醇为碳源的SnO2/含碳复合纳米材料。利用离子的阻碍效应,c(NaCl)对SnO2/含碳复合材料的形貌影响尤为重要。通过控制c(NaCl),可以得到更多形貌的SnO2/含碳复合纳米材料。该方法将被推广到半导体与含碳复合材料合成的许多应用中。形貌结构与电化学性能的相关性表明,含碳复合材料的加入提高了电极的容量和稳定性。
