阿魏蘑漆酶同工酶的异源表达及酶学性质研究
2020-07-22苑畅赵丽婷顾正华李由然石贵阳丁重阳
苑畅,赵丽婷,顾正华,李由然,石贵阳,丁重阳*
1(糖化学与生物技术教育部重点实验室(江南大学),江苏 无锡,214122)2(粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214122)
漆酶(laccase, EC 1.10.3.2)是一种新型的绿色环保酶,能够将250余种化合物氧化成水等副产物[1-3],具有作用底物广泛且不污染环境的特点[4],研究者对其在食品领域如食用菌栽培、果汁加工、葡萄酒酿造、食品检测及食品废水处理等方面的研究日渐深入[5],同时在印染和环保等其他工业领域中,漆酶也具有巨大的应用价值[6-7]。
共培养是提高漆酶发酵水平的有效方法之一[8]。本实验室前期研究发现,不产漆酶菌株胶红酵母(Rhodotorularmucilaginosa)与产漆酶菌株阿魏蘑(Pleurotuseryngiivar.ferulae)进行共培养时,可以有效提高漆酶发酵水平[9]。转录组学分析结果显示,共培养后漆酶同工酶的转录水平发生明显变化,其中基因lacc2转录水平明显上调,而lacc6转录水平大幅下调,但具体的作用机制仍不清晰[10]。由于从阿魏蘑发酵液中分离纯化漆酶的同工酶存在一定困难,本研究对阿魏蘑lacc2和lacc6进行了分子克隆、异源表达和分离纯化,得到2个重组漆酶LACC2和LACC6,并分析比较了2种酶在酶学性质方面的差异,以期为共培养过程中胶红酵母促进阿魏蘑产漆酶的作用机理分析提供同工酶酶学性质方面的基础数据,以利于促进对机理的全面解析。
1 材料与方法
1.1 实验材料
1.1.1 菌株、质粒和培养基
阿魏蘑JM301、毕赤酵母GS115、大肠杆菌JM109以及表达质粒pPIC9K,均由本实验室保藏。
YPD培养基(yeast extract peptone dextrose medium)(g/L):胰蛋白胨20.0,酵母提取物10.0,无水葡萄糖20.0。
BMGY培养基(buffered glycerol-complex medium)(g/L):胰蛋白胨20.0,酵母提取物10.0,YNB 13.4,K2HPO43.0,KH2PO411.8,甘油10 mL/L,生物素0.4 mg/L。
BMMY培养基(buffered methanol-complex medium)(g/L):胰蛋白胨20.0,酵母提取物10.0,YNB 13.4,K2HPO43.0,KH2PO411.8,生物素0.4 mg/L。
MD培养基(minimal extrase medium)(g/L):YNB 13.4,无水葡萄糖20.0,生物素0.4 mg/L。
1.1.2 主要试剂和仪器
实验中所用遗传霉素(geneticin, G418)和限制性核酸内切酶SnaB Ⅰ、EcoR Ⅰ、NotI购自Thermo Fisher Scientific公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate), ABTS]、丁香醛连氮(syringaldazine, SGZ)、2,6-二甲氧苯酚(2,6-dimethoxyphenol, 2,6-DMP)、邻苯二酚、愈创木酚, Sigma公司;十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、曲拉通、吐温40、吐温80、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、二硫苏糖醇(dithiothreitol, DTT)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)、L-半胱氨酸,北京索莱宝科技有限公司;酶标仪,TECAN公司;电转仪,Eppendorf公司。
1.2 实验方法
1.2.1 阿魏蘑漆酶基因lacc2和lacc6的扩增
利用信号肽在线预测网站SignalP 4.0预测漆酶基因lacc2和lacc6中的信号肽位置。设计引物去除漆酶基因序列中的信号肽,并在序列的5’端添加SnaBⅠ(或EcoRⅠ)酶切位点、His蛋白标签及thrombin位点,3’端仅添加NotI酶切位点。提取阿魏蘑中RNA并将其反转录为cDNA作为模板,扩增得到漆酶基因lacc2和lacc6。
1.2.2 重组菌的构建及筛选
利用SnaBⅠ(或EcoRⅠ)及NotⅠ对基因片段lacc2、lacc6和质粒pPIC9K双酶切,连接后构建重组质粒pPIC9K-lacc2和pPIC9K-lacc6。将StuI线性化的空质粒pPIC9K及2个重组质粒纯化回收后转化到酵母感受态细胞内,培养2.5 h后将菌液均匀涂布至MD平板,在30 ℃恒温培养箱中静置培养36 h。从MD平板中随机挑选出单菌落至带有G418抗性的YPD平板上,利用添加了不同质量浓度(0.25、 1、 2、 4 mg/mL)G418的平板筛选出高拷贝数的阳性转化子。
1.2.3 基因lacc2和lacc6在毕赤酵母中的诱导表达
将重组菌株GS115/pPIC9K-lacc2、GS115/pPIC9K-lacc6和转入了空质粒的对照组菌株GS115/pPIC9K接种至YPD液体培养基中进行摇瓶发酵,在30 ℃、250 r/min的条件下培养20~24 h。以体积分数1.5%的接种量转接到已提前加入生物素的BMGY培养基中,相同条件下培养18~20 h,离心发酵液后收集菌体并将其转接到BMMY培养基中继续培养,每隔24 h补加无水甲醇使终体积分数始终保持在1.0%,离心菌液后弃掉菌体,获得的上清液即为重组漆酶的粗酶液。
1.2.4 酶活力的测定
采用ABTS法测定酶活力,具体测定方法及酶活力计算公式参照文献[11]。
酶活力定义:1 min内转化1 μmol ABTS所需的漆酶酶量为1个酶活力单位(U)。
1.2.5 蛋白纯化以及分析
利用镍柱对重组漆酶LACC2和LACC6的粗酶液进行纯化,收集纯化后的酶液,再利用凝血酶去除纯化蛋白的His标签,使用十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)对其进行分析检测。
1.2.6 酶学性质研究
以下测定中所用酶液均为电泳纯的酶液,提前配制好浓度为50 mmol/L的乙酸-乙酸钠溶液作为缓冲液。除动力学常数测定之外,测定中所用底物均为ABTS。每个测定条件设置3个平行。
(1)LACC2和LACC6的最适反应pH和pH稳定性:4 ℃条件下将LACC2和LACC6分别在pH 2~10的缓冲液中测定酶活力,以酶活力的最高值为100%。继续将2个重组漆酶在不同pH的缓冲液中保存,每隔一段时间测定剩余酶活力,探究LACC2和LACC6的pH稳定性。
(2)LACC2和LACC6的最适反应温度和温度稳定性:将LACC2和LACC6分别在20~90 ℃的条件下保温5 min后测定酶活力,以酶活力的最高值为100%。继续将2个重组漆酶在不同温度下保存,每隔一段时间测定剩余酶活力,探究LACC2和LACC6的温度稳定性。
(3)金属离子对LACC2和LACC6的影响:向反应体系中添加不同的金属离子(K+、Ca2+、Mg2+、Cu2+、Co2+、Ni2+、Zn2+、Mn2+、Fe3+、Fe2+、Al3+和Ba2+)至终浓度为0.1、1.0和5.0 mmol/L,测定漆酶剩余的酶活力,以不添加金属离子的漆酶酶活力为100%。
(4)有机试剂对LACC2和LACC6的影响:向反应体系中加入不同有机试剂(甲醇、乙醇、丙酮、异丙醇、正丁醇和乙腈)至终体积分数为5%和10%,测定漆酶剩余的酶活力,以不添加有机试剂的漆酶酶活力为100%。
(5)表面活性剂对LACC2和LACC6的影响:向反应体系中加入不同表面活性剂(SDS、曲拉通、吐温40和吐温80)至终体积分数为0.1%和0.5%,测定漆酶剩余的酶活力,以不加表面活性剂的漆酶酶活力为100%。
(6)抑制剂对LACC2和LACC6的影响:向反应体系中添加不同的抑制剂(EDTA、DTT、PMSF和L-半胱氨酸)至终浓度为0.1、0.5和1.0 mmol/L,测定漆酶剩余的酶活力,以不加抑制剂的漆酶酶活力为100%。
(7)动力学常数测定:选择不同浓度的底物(ABTS、2,6-DMP、SGZ、邻苯二酚和愈创木酚),在30 ℃时与纯化酶液进行反应。使用Lineweaver-Burk双倒数法[12]对LACC2和LACC6的Km值以及Kcat/Km值进行计算。
2 结果与分析
2.1 漆酶基因lacc2和lacc6的克隆及重组菌的获得
如图1-a所示,2个基因片段lacc2和lacc6的条带位置与预测核酸大小1 566和1 602 bp相符。重组质粒pPIC9K-lacc2和pPIC9K-lacc6构建完成后,利用SnaBⅠ(或EcoRⅠ)和NotⅠ对其进行双酶切验证,如图1-b所示,均获得2条约9.3和1.6 kb的条带。将StuI线性化后的空质粒和2个重组质粒转入提前制备好的毕赤酵母感受态中,再利用G418浓度逐渐提高的YPD平板挑选出阳性转化子,最终得到对照菌株GS115/pPIC9K,重组菌株GS115/pPIC9K-lacc2和GS115/pPIC9K-lacc6。

a- lacc2和lacc6基因扩增结果;b-重组质粒酶切鉴定M-DNA Maker; a1-基因lacc2; a2-基因lacc6; b1-pPIC9K质粒;b2-重组质粒pPIC9K-lacc2; b3-重组质粒pPIC9K-lacc6
2.2 重组漆酶的诱导表达、酶活力检测及纯化
对照菌株GS115/pPIC9K、重组菌株GS115/pPIC9K-lacc2和GS115/pPIC9K-lacc6经甲醇诱导发酵,离心得到发酵上清液。以ABTS为底物时,测得重组漆酶LACC2和LACC6的粗酶液酶活力为0.35和7.37 U/mL,而对照组粗酶液中未检测到酶活力,说明2条漆酶基因在毕赤酵母中成功表达。使用镍柱对重组蛋白LACC2和LACC6的粗酶液进行纯化,采用凝血酶去除His标签蛋白,获得纯化酶液。重组漆酶LACC2和LACC6的SDS-PAGE分析结果如图2所示。

M-标准蛋白Maker;1-重组菌株GS115/pPIC9K-lacc6纯化酶液;2-重组菌株GS115/pPIC9K-lacc2纯化酶液
2.3 酶学性质分析
2.3.1 最适反应pH和pH稳定性
如图3所示,LACC2和LACC6的最适反应pH值均为3.0。当pH 2.0时LACC6几乎完全失活,pH>3.0时LACC6的相对酶活力随pH的升高而快速下降,而LACC2酶活力下降程度相对更为缓慢。不同pH条件下,LACC2表现出比LACC6更高的pH稳定性,尤其在最适pH时,LACC2的半衰期为24 h,而LACC6的半衰期仅为12 h,说明LACC2比LACC6具有更强的对酸碱环境的耐受力。

a- LACC2的最适pH;b- LACC6的最适pH;c- LACC2的pH稳定性;d- LACC6的pH稳定性
2.3.2 最适反应温度和温度稳定性
如图4所示,LACC2和LACC6的最适反应温度均为50 ℃,与大部分白腐真菌漆酶性质相近[13]。虽然LACC2和LACC6的最适温度较高,但是2个重组漆酶在高温下稳定性较差并且温度越高失活越快,由图4可知,30 ℃下LACC2和LACC6表现出最佳的热稳定性,半衰期分别为15和30 h。此外,较之LACC2,LACC6的温度稳定性相对更高,但这也仅仅局限于40 ℃以下的温度环境中。

a- LACC2的最适温度;b- LACC6的最适温度;c- LACC2的温度稳定性;d- LACC6的温度稳定性
2.3.3 金属离子对酶活力的影响
金属离子对不同漆酶的作用效果各不相同。有研究表明,添加低浓度的Cu2+能够在一定程度上提高Pleurotusostreatus漆酶的酶活力[14],但对M.Fructigena的漆酶活性却没有促进作用[15]。还有研究指出,Zn2+和Al3+等金属离子能够通过与Cu2+抢夺结合位点,从而改变漆酶蛋白的结构,达到抑制漆酶活性的效果[16],然而却可对P.ostreatusC1 mutagenic strain F-13[17]漆酶的酶活力起到促进作用。
12种金属离子对LACC2和LACC6酶活力的影响,如图5所示。

a-金属离子对LACC2的影响;b-金属离子对LACC6的影响
低浓度的K+、Cu2+、Co2+和Mn2+均会对LACC2和LACC6的酶活力产生不同程度的促进作用,且在一定范围内2个漆酶的酶活力均会随着金属离子浓度的逐渐增大而提高。将金属离子浓度增大至5 mmol/L时,LACC2和LACC6酶活力基本受到抑制,但整体而言,LACC2相对酶活力降低程度较小,反映出LACC2比LACC6具有更强的高浓度金属离子耐受力。Fe2+和Fe3+对LACC2和LACC6的抑制作用显著,当添加1.0 mmol/L浓度的Fe2+时LACC2和LACC6可完全失活,这与其他来源的漆酶性质相符,Fe2+可与底物ABTS自由基结合从而抑制漆酶酶活力[18],Fe3+可通过与漆酶中Cu2+抢夺结合位点,改变漆酶的蛋白结构,进而抑制漆酶的活性[19]。
由图5可知,相较于LACC6,低浓度金属离子对LACC2的激活力作用更为明显。分别添加0.1和1.0 mmol/L浓度的K+、Ca2+、Mg2+、Cu2+、Co2+、Ni2+、Mn2+、Al3+和Ba2+均可提高LACC2的酶活力,而可使LACC6酶活力提高的金属离子仅有K+、Cu2+、Co2+和Mn2+,且相对酶活力的增幅普遍不及LACC2。这些研究结果均表明LACC2的金属离子依赖性较LACC6更高。
2.3.4 有机溶剂对酶活力的影响
如图6所示,甲醇、丙酮、异丙醇、正丁醇和乙腈均对LACC2和LACC6有一定程度的抑制作用。相较于LACC6,LACC2受到有机溶剂影响较小,在体积分数5%和10%的添加量下,LACC2的相对酶活力均在80%以上,而LACC6的相对酶活力在高有机溶剂体积分数(10%)下基本低于80%,这也说明LACC2具有更强的高浓度有机溶剂耐受力。

a-有机溶剂对LACC2的影响;b-有机溶剂对LACC6的影响
2.3.5 表面活性剂对酶活力的影响
表面活性剂SDS、曲拉通、吐温40和吐温80对LACC2和LACC6酶活力的影响如图7所示,当添加体积分数0.1%的表面活性剂时,LACC2酶活力得到一定的激活,其中添加曲拉通时LACC2相对酶活力最高,与对照相比提高了9.2%;然而LACC6酶活力却受到轻微的抑制,添加SDS时酶活力降低最多,相对酶活力仅剩73.5%。当表面活性剂的添加体积分数增大至0.5%时,LACC6受到的抑制作用与LACC2相比更加明显,SDS可使其相对酶活力降低46.4%;LACC2则仅仅受到SDS的强烈抑制作用,相对酶活力降低了75.2%,其他表面活性剂对其酶活力影响微弱。总体来说,相较于LACC6,LACC2对表面活性剂的耐受力更强,不易受到大多数表面活性剂的抑制,且在适当添加浓度下酶活力可得到促进,另外,添加体积分数0.5% SDS则可有效抑制LACC2的酶活力。

a-抑制剂对LACC2的影响;b-抑制剂对LACC6的影响
2.3.6 抑制剂对酶活力的影响
如图8所示,EDTA、DTT、PMSF和L-半胱氨酸对2个重组漆酶均有抑制作用。其中,DTT和L-半胱氨酸对LACC2和LACC6的抑制效果最为明显,两者添加浓度为0.5 mmol/L时可完全抑制LACC2和LACC6的酶活力。EDTA作为常见的阳离子金属螯合剂,可吸附反应体系中的Cu2+形成Cu2+-EDTA配合物。由图8可知,LACC2对EDTA更为敏感,低浓度EDTA即可实现对LACC2的抑制使其相对酶活力为71.4%,而当实验中EDTA的添加浓度提高至1 mmol/L时,LACC6酶活力才显著降低,相对酶活力为72.8%。LACC2对EDTA表现出较低的耐受力,说明LACC2金属离子的依赖性较LACC6更高。

a-表面活性剂对LACC2的影响;b-表面活性剂对LACC6的影响
2.3.7 重组漆酶的底物动力学研究
以ABTS、2,6-DMP、SGZ、邻苯二酚和愈创木酚为底物,测得LACC2和LACC6的Km值并计算得到Kcat/Km值,结果如表1所示。
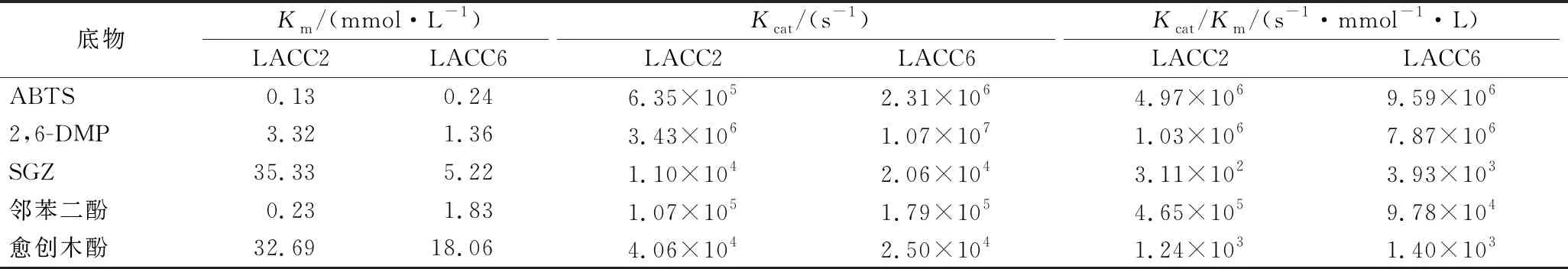
表1 酶促反应动力学参数
结果表明,以ABTS为底物时,LACC2和LACC6的Km值最小,分别为0.13和0.24 mmol/L,其中LACC2对底物ABTS的亲和力更高;LACC2和LACC6的Kcat/Km值最大,表明2个重组漆酶对ABTS的催化效率最高,LACC2和LACC6的最适底物均为ABTS。此外,LACC2和LACC6对2,6-DMP和邻苯二酚也有较好的催化效果。其他来源漆酶的酶学性质比较如表2所示,LACC2和LACC6的最适反应pH和最适反应温度均与大多数真菌漆酶相同,然而,不同来源漆酶的最适底物却是不同的。与其他来源的漆酶相比,LACC2和LACC6的Km值处于较低的水平,均对ABTS具备更佳的亲和力和良好的催化特性。

表2 不同来源漆酶的酶学性质
3 结论
前期研究发现,阿魏蘑与胶红酵母共培养可促进漆酶酶活力,并且在这一过程中lacc2转录水平显著提高而lacc6转录水平显著降低。针对这一发现,本文将阿魏蘑漆酶lacc2和lacc6异源表达后展开了对2个重组漆酶酶学性质的比较分析。与大多数真菌漆酶相同,以ABTS为底物时,LACC2和LACC6的最适反应pH值均为3.0,且LACC2在不同酸碱度下均表现出相对更高的稳定性;LACC2和LACC6的最适反应温度均为50 ℃,但在高温环境(>40 ℃)下稳定性都不佳。低浓度的K+、Cu2+、Co2+和Mn2+对LACC2和LACC6均有不同程度的促进作用,而Fe2+和Fe3+对LACC2和LACC6的抑制效果则十分显著,根据相对酶活力的变化程度和规律,可知LACC2的金属依赖性比LACC6更强。相较于LACC6,LACC2表现出对有机溶剂和表面活性剂更强的耐受力,但更易受到抑制剂的影响。动力学研究发现,LACC2和LACC6的最适底物均为ABTS,LACC2的Km值低于LACC6,分别为0.13和0.24 mmol/L。这一研究结果有助于全面了解阿魏蘑漆酶中主要同工酶酶学性质的异同,有利于对共培养过程中胶红酵母促进阿魏蘑漆酶发酵水平作用机理进行深入研究。
