基于“开-闭”环的铁离子探针的合成及性能研究
2020-07-22李长江李晴张莉艳郑玉船潘乐柯仲成李博文
李长江, 李晴, 张莉艳, 郑玉船, 潘乐, 柯仲成, 李博文
1(黄山学院 化学化工学院,安徽 黄山,245041) 2(黄山学院 无机功能材料重点实验室,安徽 黄山,245041) 3(安徽工业大学 化学与化工学院,安徽 马鞍山,243032) 4(浙江大学 药学院,浙江 杭州,310058)
铁是维持生命和生长发育所必需的微量元素之一,占人体体重的0.006%,人体内的铁主要来源于食物,如豆类、蔬菜、水果、瘦肉、蛋黄、鱼类、动物的肝脏和肾脏等[1]。铁在人体内许多生理过程中扮演着非常重要的角色,其中最重要的生物学功能是参与氧的运输和造血过程[2]。机体内铁含量偏少或过量均会产生严重的毒副作用,引起生命体系的紊乱,有研究发现,许多疾病的产生与铁含量正常与否有着密切关系,如阿尔兹海默症、帕金森病和亨廷顿病等[3]。缺乏铁会引起贫血,降低对抗感染的能力,损害精神活动和智力发展,但过量摄入铁也会引起癌症、心脏病、肝硬化、糖尿病以及肾衰竭等其他严重疾病,甚至死亡[4-6]。因此,快速准确地检测出食品及生物体内的Fe3+含量具有重要意义。然而,对于金属离子的检测,普遍使用的是传统检测方法,主要有电子耦合等离子体-原子发射光谱法、电子耦合等离子体-质谱法、原子吸收光谱法、循环伏安法以及分光光度测定方法等[7-10]。这些传统检测方法往往操作繁琐、成本高,不易于应用在大批量和实时检测中。荧光探针具有合成简单、选择性好、灵敏度高以及操作简单的优点,是一种简易且高效的金属离子检测方法[11-12]。
罗丹明类荧光染料具有优异的光学性能,其内酰胺螺环状结构具有“开-闭”环的特性,在处于螺环状态时,表现为无色和无荧光的性质,当其与特定的金属离子结合后,便会处于开环状态,从而表现出颜色变化和荧光特性,是一种非常好的金属离子荧光探针的母体结构,因而备受关注[13-14]。目前,已有不少罗丹明类探针分子被用于识别Cu2+、Al3+、Hg2+等,但用于识别Fe3+的报道较少,而且存在不足,例如灵敏度低、易受其他金属离子的干扰等[15-20]。本文以罗丹明B、乙二胺和邻香兰素为原料,通过酰基化和醛胺缩合反应,合成了一种新型的罗丹明B类金属离子探针R1。研究表明,R1对Fe3+具有很好的选择识别能力,受其他金属离子的干扰较小,灵敏度高,能高效地检测出食品及环境中Fe3+的含量。同时其发光波长能有效的降低生物体自身的荧光干扰,生物相容性好,细胞毒性低,本研究为进一步进行生物体内Fe3+的检测提供了一种新方法。
1 材料与仪器
罗丹明B、乙二胺、邻香兰素、金属盐(除AgNO3外,其他的盐均为氯化物),阿拉丁试剂(上海)有限公司;其他试剂,国药集团试剂有限公司。所有试剂均为分析纯。乙醇经过除水处理。实验用水为超纯水。
AM-400 MHz核磁共振仪,德国Brucker公司;LCT Premier XE质谱仪,美国Waters公司;UV-2450紫外可见分光光度计、RF-5301PC荧光光谱仪,日本Shimadzu公司;MK3酶标仪,美国Thermo公司;IX71倒置荧光显微镜,日本Olympus公司。
2 实验内容
2.1 探针R1的合成
探针R1的合成路线如图1所示。

图1 探针R1的合成路线
根据参考文献[21]合成N-氨乙基-罗丹明B酰亚胺,称取3.057 5 g罗丹明B于100 mL茄形烧瓶中,加入45 mL无水乙醇,加热搅拌使其完全溶解,滴加4 mL乙二胺后115 ℃回流,薄层色谱(thin layer chromatography, TLC)跟踪反应。反应结束后,将蒸馏浓缩后的反应液滴入剧烈搅拌的冰水中,有大量固体析出,抽滤并用乙醇洗涤,得淡粉色偏白的固体,干燥后得产物2.031 5 g,产率66%。柱层析进行纯化,用V(石油醚)∶V(乙酸乙酯)=1∶1的洗脱液洗脱,得N-氨乙基-罗丹明B酰亚胺白色粉末。
称取N-氨乙基-罗丹明B酰亚胺0.524 2 g于50 mL茄型瓶中,加入20 mL无水乙醇,常温搅拌使其溶解。再称取邻香兰素0.154 1 g加入上述溶液中。110 ℃加热回流,TLC跟踪反应,待反应结束后浓缩反应液,抽滤并用少量无水乙醇洗涤,得亮黄色固体,用无水乙醇进行重结晶最终得针状黄色晶体0.553 4 g,产率为83%。根据核磁共振谱图(图S1、图S2)和质谱图(图S3)可知:1H NMR(400 MHz,CDCl3,TMS)δ:13.55(1H,s),8.06(1H, s),7.93~7.91(1H,J=7.3,3.6 Hz,dd),7.45~7.42(2H,J=5.8,3.0 Hz,dd),7.1~7.08(1H,J=5.7,3.1 Hz,dd),6.87~6.85(1H,J=7.6,1.5 Hz,dt),6.77~6.71(2H,m),6.45~6.43(2H,J=8.0 Hz,d),6.40(2H,s),6.27~6.24(2H,J=8.8,2.6 Hz,dd),3.85(3H,s),3.42~3.36(4H,m),3.35~3.30(8H,J=16.7,9.6 Hz,dd),1.18~1.14(12H,J=7.0 Hz,t)。13C NMR(100 MHz, CDCl3, TMS)δ:168.21,166.05,153.51,153.37,152.16,148.85,148.47,132.48,131.10,128.82,128.06,123.83,122.96,122.87,118.54,117.58,114.04,108.14,105.44,97.82,64.97,56.64,56.12,56.09,44.36,40.90,12.62。MS,m/z:619.328 9[M]+,理论计算值619.328 4。
2.2 溶液的配制
分别称取NaCl、KCl、CaCl2、MnCl2、CuCl2、ZnCl2、CrCl3、FeCl3、NiCl2、PbCl2、BaCl2、CoCl2、HgCl2、AgNO3、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA),用2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸(2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES)缓冲溶液 (1 mol/L, pH 7.3)溶解配制成3 mmol/L的溶液,避光处放置备用。再用乙腈配制浓度为3 mmol/L的探针R1溶液。
2.3 探针离子选择性的研究[22]
用移液枪分别往15根7 mL的离心管中加入2.9 mL乙腈水溶液[V(水)∶V(乙腈)=1∶4]和30 μL R1溶液,然后再向其中1根离心管中加入70 μL去离子水作为比对样,剩下的14根离心管中分别加入70 μL配制好的3 mmol/L上述含有不同金属离子的溶液。反应片刻后,观察记录溶液颜色和荧光的变化。并用紫外可见分光光度计和荧光光谱仪分别测量可见吸收和荧光发射光谱。
2.4 探针离子干扰性的研究[23]
通过离子选择性的研究,得出R1对Fe3+具有较好的选择性。在离子选择性研究中,除含Fe3+以外其余14根离心管中,用移液枪分别加入70 μL的FeCl3溶液,反应片刻,用紫外可见分光光度计和荧光光谱仪分别测量可见吸收光谱和荧光发射光谱。
2.5 探针灵敏度的研究[24]
取16根离心管,用移液枪分别加入30 μL的R1溶液,并以10 μL为梯度,分别加入从0到150 μL的FeCl3溶液,为保证总体积为3 mL,乙腈水溶液相对应的从2.97 mL调整到2.82 mL,反应片刻,分别测量可见吸收光谱和荧光发射光谱。
2.6 探针与Fe3+反应机理的研究[25]
在2.4中加入FeCl3溶液的离心管里,滴加2倍体积EDTA溶液,并用紫外可见分光光度计测量溶液于530 nm处的吸光度。接着用移液枪分别向11根离心管中加入2.7 mL的乙腈水溶液,然后同时加入R1溶液和FeCl3溶液,保持R1和FeCl3溶液的体积之和为300 μL,以30 μL为1个梯度,FeCl3溶液加入体积从0 μL到300 μL,R1的体积则相反,从300 μL到0 μL。反应片刻,用紫外可见分光光度计分别测量530 nm处的吸光度。
2.7 探针细胞毒性的研究[26]
在37 ℃,体积分数5% CO2的气氛下,待96孔板中HeLa细胞密度达到5 000个/孔时,加入不同浓度的R1、Fe3+或R1+Fe3+进行孵育,以未经处理的细胞作为对照组。孵育48 h后,取出培养基并用磷酸盐缓冲溶液(phesphate buffer saline, PBS)洗涤3次,然后加入含有0.5 mg/mL 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide, MTT)的改良依格尔培养基(dulbecco′s modified eagle medium,DMEM)孵育4 h。待孵育完毕,96孔板中每个孔加入150 μL的二甲基亚砜(dimethyl sulfoxide,DMSO)并用酶标仪在530 nm处记录吸光度。
2.8 探针细胞成像的研究[26]
在37 ℃,体积分数5% CO2的气氛下,在6孔板上用添加质量分数10%胎牛血清(fetal bovine serum,FBS)和1%青霉素/链霉素的DMEM培养基进行HeLa细胞的培养(80 000个/孔),培养24 h,直到细胞密度达到50%~60%。然后用5 μmol/L探针孵育6 h,取出培养基,用PBS洗涤3次后,再将探针处理过的细胞与10 μmol/L Fe3+进行孵育,孵育2 h后取出培养基并用PBS洗涤孵育后的细胞3次,用倒置荧光显微镜观察细胞内荧光。
3 结果与讨论
3.1 探针的离子选择性
加入不同离子的R1溶液出现了肉眼可见的变化,如图2-a所示,加入Fe3+的R1溶液颜色出现了橘红色,其他离子均未使R1溶液的颜色发生改变。如图2-b所示,在365 nm紫外光照射下,加入Fe3+的R1溶液呈现出明亮的橘黄色荧光信号。加入其他离子的R1溶液均未发生明显的荧光信号变化。

a-在可见光下;b-在365 nm紫外光照射下
通过光谱的测量分析,加入Fe3+的R1溶液在530 nm出现最强吸收峰,在550 nm出现了最大荧光发射峰,而其他离子在530 nm(图3-a)和550 nm(图3-b)处没有出现明显的吸收峰。表明R1对Fe3+表现出明显的响应,对其他离子没有响应,说明其对Fe3+具有高效的选择性和专一性。

a-可见吸收光谱;b-荧光发射光谱
3.2 探针的离子干扰性
为进一步说明R1对Fe3+具有高效的选择性和专一性,在离子选择性实验的基础上,往含有不同离子的体系中加入等量的Fe3+,反应片刻后,各体系均呈现出明显的颜色和荧光变化。由图4可以看出,在其他离子共存的情况下,混合体系在530和555 nm处均出现相近的峰值,说明其他离子的存在不影响R1对Fe3+的响应,探针具有很好的抗干扰性。

图4 R1在Fe3+与其他金属离子共存情况下的可见吸收光谱(a)和荧光发射光谱(b)。
3.3 探针的灵敏度
如图5所示,当Fe3+浓度从0 μmol/L逐渐增加至150 μmol/L时,530 nm处的可见吸收峰也逐渐增高,通过最高点峰值图的绘制,可以看出当Fe3+浓度在60~150 μmol/L的范围内,具有良好的线性关系,对此区间进行线性拟合,得到回归方程Y=1.037×10-2X-0.587,R2值为0.998 73。
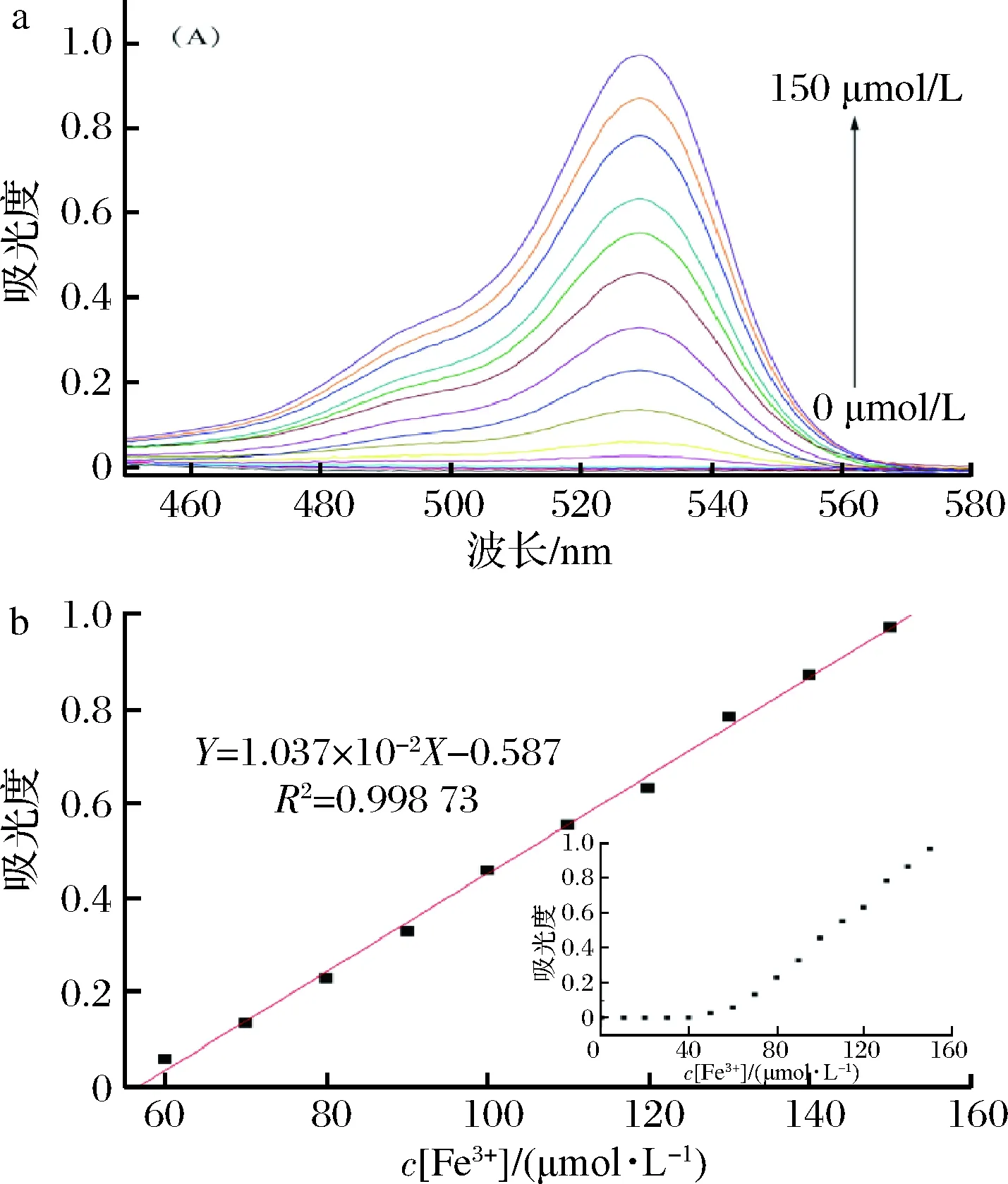
图5 R1在不同Fe3+浓度下的可见吸收光谱(a)和R1在530 nm处吸光度的线性拟合(b)
从图6可以看出,随着Fe3+浓度逐渐增大(0~150 μmol/L),555 nm处的荧光发射强度也逐渐增强,绘制不同浓度下对应的最高点峰值图,可以看出在50~140 μmol/L的Fe3+浓度范围内,图线具有良好的线性关系,对此区间进行线性拟合,得到回归方程Y=9.64X-403.063,R2值为0.998 98。

图6 R1在不同Fe3+浓度下的荧光光谱(a)和R1在555 nm处荧光发射的线性拟合(b)
结合上述实验所得的线性回归方程,根据公式(1)计算Fe3+检出限:
LOD=3σ/k
(1)
式中:σ,空白样测量的标准差;k,线性回归方程的斜率。
该体系中Fe3+的LOD分别为146 nmol/L(可见分光光度法)和129 nmol/L(荧光光谱法),远低于中国饮用水标准中Fe3+的含量值0.3 mg/L[27](535 7 nmol/L),说明R1可以很好地应用于食品安全等领域中Fe3+含量的检测。
3.4 探针与Fe3+反应机理
一般来说,探针对金属离子的选择性,取决于探针结构中具有孤对电子如N、O等的配体与金属离子的结合动力学。因此为了探讨R1与Fe3+之间的相互作用,选择了EDTA作为络合剂,如图7所示。

图7 R1在Fe3+以及含EDTA的Fe3+存在下的可见吸收光谱
当R1和Fe3+发生作用,溶液出现颜色,530 nm处出现紫外吸收峰,由于EDTA对金属离子的结合能力强于其他络合剂,所以加入EDTA溶液后,溶液颜色逐渐褪去,530 nm处的紫外吸收峰也随之消失,并且这一过程是可逆的。可以推断R1与Fe3+之间的作用与罗丹明母体结构中酰亚胺环的“开-闭”有密切联系。R1具有螺环和开环形式,当处于螺环形式时为无色,但当Fe3+加入后,由于配位作用,螺环结构打开,伴随着明显的颜色和荧光变化,从而达到检测Fe3+的目的。
为进一步确定R1与Fe3+之间的结合系数,采用等物质的量连续变化法(Job’s plot)来测试,由图8可知,当Fe3+的摩尔分数接近0.5时(即加入的Fe3+和R1等量),溶液在530 nm处出现最大的可见吸收峰,表明R1和Fe3+是以1∶1的络合比进行作用的,推断R1与Fe3+作用的反应机理如图9所示。

图8 R1与Fe3+作用的结合比例

图9 R1与Fe3+的反应机理
3.5 探针的细胞毒性
为评价R1、Fe3+以及R1+ Fe3+的生物相容性,采用MTT法来考察其对HeLa细胞存活率的影响。如图10所示,R1、Fe3+以及R1+ Fe3+加入HeLa细胞进行培养,当浓度低于10 μmol/L时,细胞的存活率达到90%以上;待浓度提高至100 μmol/L,细胞仍然保持了较高的存活率,其IC50>100 μmol/L。表明R1具有较低的细胞毒性,体现出良好的生物相容性,为其在细胞内进行有效检测提供了有力的实验依据。
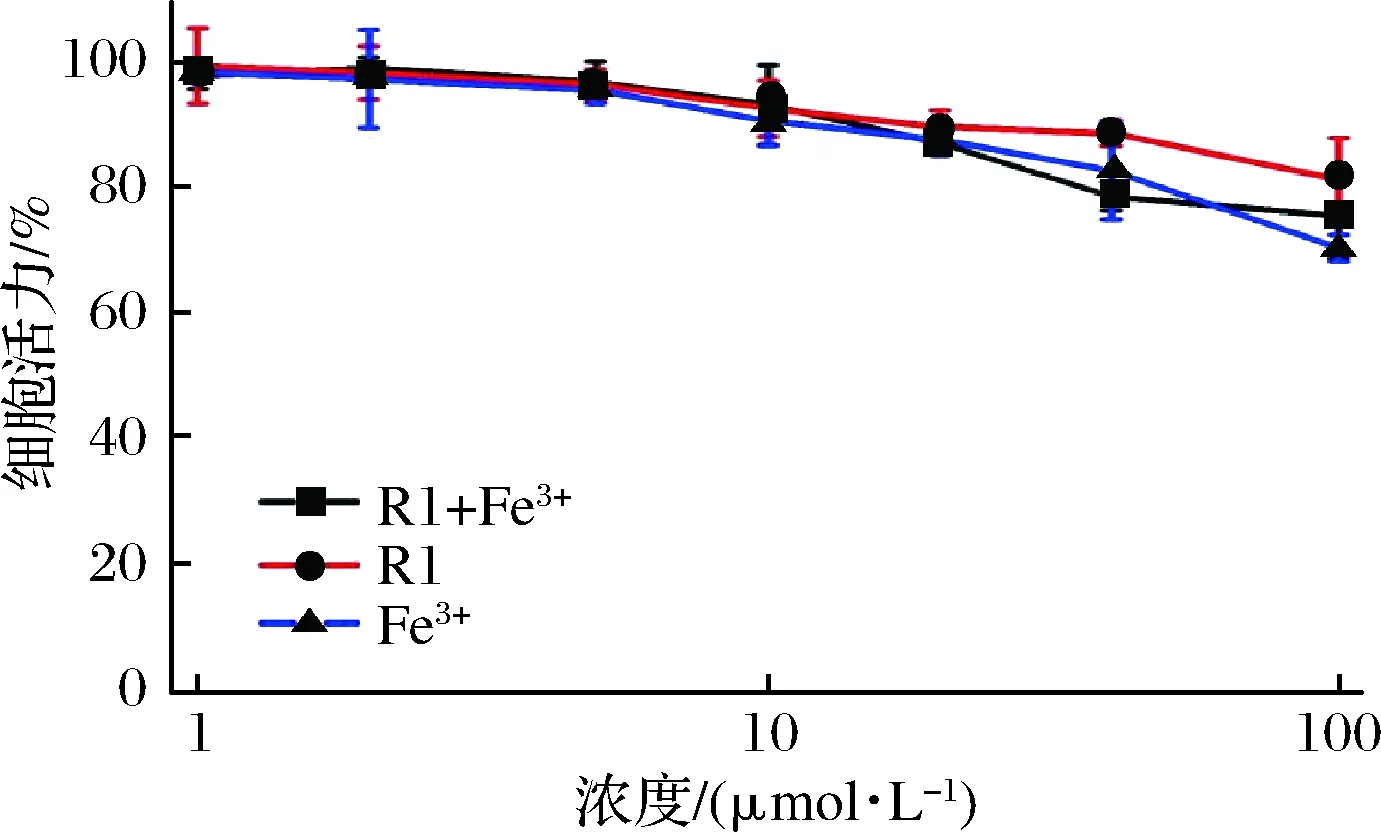
图10 R1、Fe3+和R1+Fe3+对细胞活力的影响
3.6 探针的细胞成像
为了证明荧光探针R1能够在细胞中检测 Fe3+, 采用荧光成像技术对所制备的荧光探针R1在细胞内的检测能力进行了考察。如图11所示, 以HeLa细胞作为研究对象, 当5 μmol/L R1加入到细胞中培养6 h,再加入10 μmol/L Fe3+处理2 h后,可以明显地观察到R1与Fe3+作用所产生的红色荧光,这直接说明了R1可以迅速被HeLa细胞摄取,同时在HeLa细胞内被Fe3+激活,并释放出具有荧光信号的配合物R1-Fe3+。

a-R1相位对比图像;b-R1荧光显微图像;c-a与b重叠图像;d-R1+Fe3+相位对比图像;e-R1+Fe3+荧光显微图像;f-d与e重叠图像
4 结论
本文用罗丹明B、乙二胺和邻香兰素合成了化合物R1,并对其进行了结构和离子选择性、反应络合比、灵敏度等探针性能的表征。实验结果表明,R1对Fe3+具有很好的响应,当加入Fe3+时,溶液出现明显的颜色变化,同时产生荧光,LOD分别为146 nmol/L(分光光度法)和129 nmol/L(荧光光谱法),证明R1是一种可视化的Fe3+荧光探针。R1与Fe3+通过络合,使得结构中的酰亚胺发生了“开-闭”环,Job’s plot曲线显示络合比为1∶1。R1具有良好的生物相容性,可以在活细胞中成像。因此探针R1在检测食品、环境、生物等领域中Fe3+含量有潜在的应用前景。
