核壳结构纳米纤维在药物缓释领域应用研究进展
2020-07-21凌宜帆赵江惠
刘 志,高 天,凌宜帆,赵江惠*
(1.安徽工程大学 纺织服装学院;2.中电科芜湖钻石飞机制造有限公司,安徽 芜湖 241000)
纳米纤维具有独特的表面效应和尺度效应,可以作为其他材料的基本组成结构.在生物医药领域,如生物传感器[1-2]、组织工程支架[3-4]、创伤辅料[5]、药物缓释[6-7]等方面,再生纳米纤维结构上与人体内细胞外基质相似.因而,再生纳米纤维能够模拟相关生物功能,具备修复有关组织/器官的潜在可能.同时,由于制备纳米纤维原材料多数具有较好的生物相容性和生物可降解特点,可以作为药物载体进入人体内.而且纳米纤维比表面积大、孔隙率高等特性,在药物缓释方面具有较好的潜在应用前景.
传统的载药纳米纤维一般是用同一种溶剂溶解药物或活性因子与载体材料.而药物或载药因子在载体材料溶剂中容易失活.此外,找到合适的溶剂来同时将药物和载体材料溶解是困难的,如果不能同时溶解,则载体材料与药物结合力会较差.因此,传统载药纳米纤维药物缓释效果受到限制.具有核壳结构的纳米纤维可以有效改善传统载药纳米纤维这些缺点.这是因为(1)内层核结构可以包覆和避免将药物系统暴露在有机溶剂中;(2)外壳材料进行改性时不会影响到内核的药物和活性因子;(3)由于特殊的核壳结构,外层壳材料的缓慢降解可以有效调控内部所包覆药物的缓慢释放[8-9].因此,将所载活性物质如特殊药物、蛋白质、DNA生长因子等加入到内层核材料中获得的独特核壳结构纳米纤维可以实现对所载活性物质的有效控释.
近年来,无论是纳米纤维还是核壳结构纳米纤维的相关研究都增长迅速(图1).关于核壳结构纳米纤维的制备及应用研究引起了广泛关注.其中,核壳结构纳米纤维研究的出版数量占纳米纤维出版数量的5%.
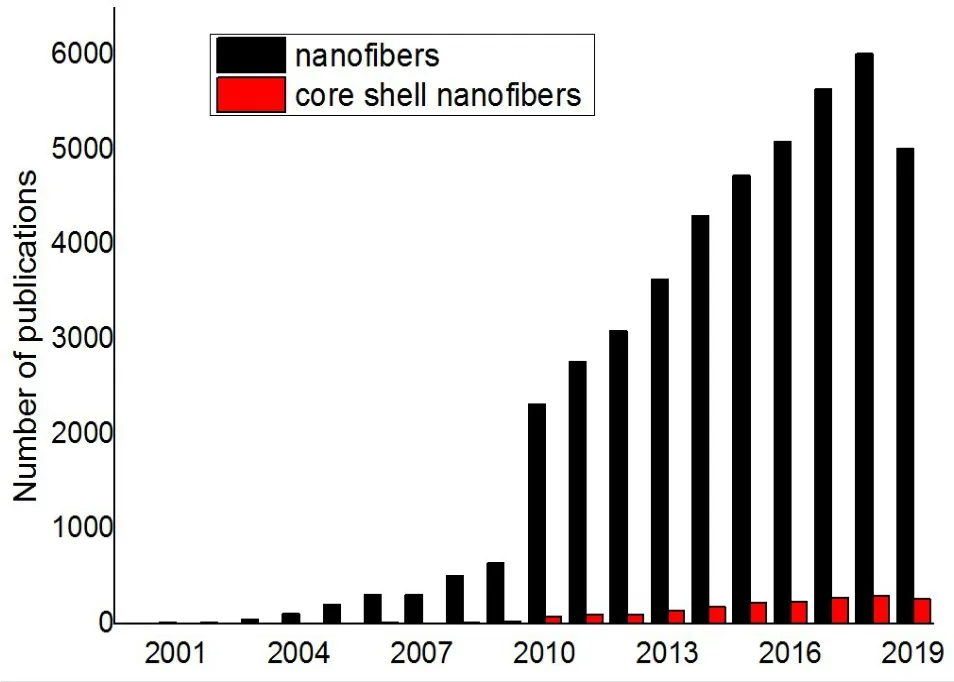
图1 2000-2019年间纳米纤维和核壳结构纳米纤维的文献出版量
马贵平等[10]综述了电纺丝纳米纤维及其应用.其中,部分内容介绍了核壳纳米纤维制备相关方法及在药物缓释中应用.但对于核壳纳米纤维载体种类及药物种类等报道较少.Hua等[11]利用同轴纺丝法制备pH响应聚氨酯/邻苯二甲酸醋酸纤维素酯核壳纳米纤维.该核壳纳米纤维具备较高断裂强度(13.27±2.32 MPa),并具备较好缓释效果.Wei等[12]制备出热响应核壳纳米纤维.结果显示,当温度为20°C时,姜黄素释放量为33.21%,当温度为60°C时,姜黄素释放量为80.15%.因此,核壳纳米纤维能够实现药物缓释效果,且通过特殊制备方法,可以得到以上pH响应、热响应等特殊功能的核壳纳米纤维药物缓释体系.
然而,核壳结构纳米纤维药物缓释相关综述研究报道较少.文章中,详细地介绍了(1)作为最重要的核壳结构纳米纤维制备方法之一,同轴静电纺制备过程原理、影响因素及其在药物缓释中的独特优势;(2)核壳结构纳米纤维所用载体材料研究进展;(3)核壳结构纳米纤维目前所载药物类别研究进展.
1 同轴静电纺丝制备核壳结构纳米纤维
1.1 核壳结构纳米纤维常用制备方法
目前,主要制备核壳结构纳米纤维的工艺方法有:模板法、化学涂层法、自组装法、表面化学结合、激光消融法、传统静电纺丝(配合相分离、热处理、光固化结合等后处理方法)、乳液静电法[13]和同轴静电纺丝法.其中,同轴静电纺丝法被认为是目前制备核壳结构纳米纤维最直接有效的工艺方法.通过此工艺方法一步即可直接连续加工出具有核壳结构复合纳米纤维.在功能纤维连续性和均匀性等方面都优于其他方法,是目前制备核壳纳米纤维最为常用的方法之一,被认为是当前静电纺研究领域最为重要的三大进展之一[14].
1.2 同轴静电纺丝原理
同轴静电纺丝原理与传统单针头静电纺丝法是相似的,只是在喷嘴方面进行改进,将单一的毛细管喷头换成了同轴的复合毛细喷头(图2[15]).将一根较细的毛细管插入到较粗的毛细管中,保持两管同心,根据需要,在两个毛细管连接的注射器中分别注入两种不同溶液,在微量注射泵的推动下,在复合型喷丝头尖端处形成内外复合液滴.通过调节相关纺丝参数,在强静电场作用下,纺丝流体中电荷重新分布.当喷丝头尖端处电荷积聚到一定临界值时,喷丝头尖端处流体在静电力的作用下演变成复合型泰勒锥.带电流体在电场力作用下拉伸演化为核壳结构的喷射细流.带电射流在拉伸过程中溶剂快速挥发,射流被拉伸细化,最终具备核壳结构纳米纤维固化并落在收集装置上.
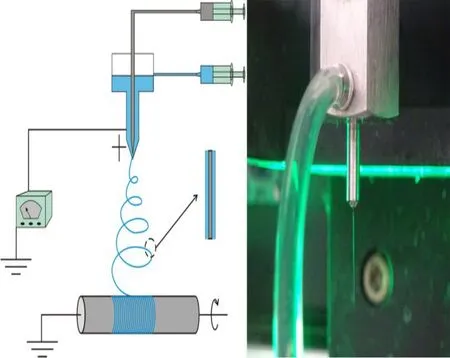
图2 同轴静电纺丝装置示意图[12]
1.3 同轴静电纺丝影响因素
多方面因素会影响同轴静电纺纺丝过程和最终纳米纤维形貌:(1)纺丝流体性质(壳层流体可纺性、浓度、黏度、黏弹松弛时间、导电性、混溶性、溶剂沸点、流体表面张力等);(2)相关工艺参数(电压值大小、纺丝流体流速、接收距离、针头的内外径大小、内外纺丝针头相对位置等);(3)相关环境因素(温度、湿度等).概括起来,制备良好的核壳结构纳米纤维需要具备以下条件[16-18]:(1)壳层溶液必须具有可纺性;(2)壳层溶液相对内核溶液具有较高的黏度;(3)内核溶液需要有一定的黏度,但比壳层溶液黏度低;(4)内核溶液具有低的表面张力;(5)壳层溶液具有良好的导电性.
1.4 同轴静电纺核壳结构纳米纤维在药物缓释应用优势
同轴静电纺制备的核壳结构纳米纤维在药物缓释应用优势在于[19-22]:(1)改善了某些可纺性差材料的纳米成型问题;(2)在核层负载不稳定药物或生物活性因子,可以实现药物控制释放效果,减少突释现象,从而可以使药物持续释放更长时间;(3)活性因子的释放动力学可以通过改变核壳溶液构成和推进速度来控制;(4)可以将不同种类的药物成分加在核壳结构纳米纤维中,并实现控释效果;可以将不稳定生物大分子包封在纤维内部,并保持药物生物活性;(5)壳层材料对核层药物起到屏障作用,使核层药物缓慢释放;(6)具有对机体更好的治疗效果和较低的毒性;(7)一步法制得核壳结构纳米纤维方法简便,易成型,纺丝过程中溶液快速挥发,残留溶剂较少避免了后处理过程可能造成的潜在危害;(8)纤维内外双层或多层结构,内外层具有不同的功能,通过改变内外成分,控制纤维直径,可以制得多种纳米纤维用于药物缓释领域.
2 核壳结构纳米纤维用于药物缓释常用聚合物载体材料
聚合物载体材料的降解速率在药物释放中起着重要作用.聚合物的降解取决于多种特性[23-24],如聚合物分子量、润湿性、结晶度、表面粗糙度和熔融温度等.在药物缓释体系中,选用具有合适降解速率的生物相容性聚合物材料至关重要.近年来,核壳结构纳米纤维用于药物缓释研究中,聚乳酸(PLA)、聚乳酸-羟基乙酸共聚物(PLGA)、聚己内酯(PCL)作为主体聚合物,其他天然或合成聚合物(如玉米醇溶蛋白(Zein)、聚乙烯醇(PVA)、聚氧化乙烯(PEO)、壳聚糖(CS)、醋酸纤维素(Cellulose acetate)、聚乙烯吡咯烷酮(PVP)等)作为副体来调控核壳纳米纤维的润湿性能及其天然降解性能.
2.1 聚乳酸(PLA)
聚乳酸(PLA)(聚丙交酯),以农作物玉米、木薯等为原材料,通过化学合成、熔融纺丝等工艺得到的聚合物.同时,PLA具备制备过程环保,生物可降解性优良,循环使用性好,材料来源广特点,是绿色环保型高分子材料.Da Silva等[25]通过静电纺丝方法制备了载BMP-2骨形成蛋白的PVA/PLA核壳结构纳米纤维,研究了BMP-2蛋白缓释行为,使这些纤维无需进一步的骨外科手术即可用于牙槽骨组织的恢复.2017年,Aytac等[26]在研究中将姜黄素作为疏水性药物载入以环糊精作为主体的核层,PLA作为壳层聚合物通过静电纺方法制得了具有核壳结构的纳米纤维,实验表明核壳结构的纳米纤维对姜黄素的释放起到了抑制作用,达到控释效果,且提高了姜黄素的溶解度.Cai等[27]在研究中使用Pickering乳液静电纺方法制备了核壳结构纳米纤维,乳液静电纺体系中以镀有磁性氧化纳米颗粒的油酸(载盐酸万古霉素)与PLA溶液构成油包水体系,制得的乳液静电纺纳米纤维实现了对盐酸万古霉素长达600小时的控释.然而,PLA纳米纤维膜力学性能差、柔韧性差,限制了其进一步的研究与实际应用.因此,PLA相关材料柔韧性的改进研究一直是研究热点也是亟待解决的问题.
2.2 聚乳酸-羟基乙酸共聚物(PLGA)
PLGA也是一种生物性、可降解性的高分子聚合物.在生物医学工程领域具备广泛应用前景[28-30].赵[12]等在研究中以PLGA为壳层材料,以牛血清蛋白(BSA)/聚氧化乙烯(PEO)为核层材料,通过调节内外壳层材料溶剂氯仿和N-N二甲基甲酰胺的比例,制得了具有不同表面形貌的核壳结构纳米纤维,当两种溶剂比例为9:1时,纤维表面呈现多孔结构,BSA药物释放曲线显示可以稳定释放一周,释放性能明显提高.He等[31]在其抗感染的组织工程研究实验中,PVA载柚苷作为核层材料来促进组织再生,PLGA载甲硝唑作为壳层材料来抑制细菌增长,TEM测试显示制备出了具有核壳结构的纤维,体外释放实验中,柚苷因被包覆在核层材料中,可以缓慢释放较长时间.Yao等[32]在研究中用同轴静电纺丝法制备了丝素(SF)/PLGA纳米纤维膜,包载人重组骨形成蛋白(rhBMP2)和地塞米松(DXM)两种药物,体外释放实验显示地塞米松突释而人重组骨形成蛋白实现了控释效果.
2.3 聚己内酯(PCL)
聚己内酯(PCL)也具备良好生物性(良好的生物可降解性/生物相容性),同时来源丰富且具备独特的药物透过性.而且,PCL分子量分布比较广(3000-85000 g/mol),在多种溶剂中可以溶解(如乙酸、氯仿、甲醇、苯、二氯甲烷等),且具有非酶降解性能,因而广泛用作生物降解性控释载体的研究.Cheng等[33]在骨组织工程再生研究中,通过静电纺丝和层层组装技术制备了SF/PCL/PVA核壳结构纳米纤维,制得的纳米纤维中,骨形成蛋白(BMP2)被包载在核层,而结缔组织生长因子附着在纤维表面,药物释放实验中结缔组织生长因子呈现突释而骨形成蛋白(BMP2)释放速率得到控制,核壳结构纳米纤维对骨形成蛋白的控释作用有利于促进骨组织的康复.Zhu等[34]在胎记瘤治疗研究中制备了以负载壳聚糖的PCL为壳层,以负载氟尿嘧啶的PVP为核层材料的核壳结构纳米纤维类协同治疗胎记瘤皮肤癌.实验证明制备的核壳结构纳米纤维药物包封率高且具有良好的机械性能.壳层氟尿嘧啶的突释可以有效抑制胎记瘤细胞的生长,而核层壳聚糖的缓释释放又保证了正常皮肤细胞的生长.Adeli-Sardou等[35]在伤口敷料的研究中,以PCL为壳层材料,明胶Gel为核层材料通过静电纺制备了载指甲花醌的PCL/Gel核壳结构纳米纤维,指甲花醌由于核壳结构纳米纤维的包覆可以稳定释放20天.在人牙龈成纤维细胞培养中发现,制备的载指甲花醌的PCL/Gel核壳结构纳米纤维可以显著提高细胞吸附和增殖.
3 核壳结构纳米纤维药物缓释应用中常见药物类别
在核壳结构纳米纤维药物缓释研究和应用中,装载/释放药物类型较多,包括疏水性药物如紫杉醇、利福平、心得安、酮洛芬、甲硝唑、潘生丁等;亲水性药物如阿莫西林、盐酸阿霉素(DOX)、妥布霉素、地塞米松、氨苄西林等;生物大分子如多糖、蛋白质、DNA、生长因子等.
3.1 疏水性药物
疏水性药物是指不溶于水而溶于脂肪及甘油、油脂、四氯化碳、氯仿、二氯甲烷等有机溶剂的药物.大多疏水性药物可以选择和疏水性高分子聚合物如PCL、PLA、PLGA等一起溶解在有机溶剂中来制备核壳结构纳米纤维,一些疏水性药物则需要事先溶解在特定溶剂中,再与高分子聚合物混合进行纳米纤维的制备,例如人参皂苷需先在少量六氟异丙醇中溶解,再与高分子溶液进行混合[36].
Jouybari等[37]在研究中利用三重同轴静电纺丝技术制备纳米纤维来研究阿霉素DOX、紫杉醇PTX、五氟脲嘧啶三种药物的药物控释效果.内层为载五氟脲嘧啶的CS/PVA溶液,中间层为PVA/CS溶液,外层为载DOX和PTX两种药物的PVA/CS溶液.实验表明药物包封率超过90%,五氟脲嘧啶释放为零级释放,达到控释效果.Repanas等[38]在研究中利用同轴静电纺丝技术制备了载双嘧达莫的PCL核壳结构纳米纤维,并研究了双嘧达莫的药物缓释行为.Yu等[39]在研究中通过改进的同轴静电纺丝技术制备了载酮洛芬的玉米醇溶蛋白核壳结构纳米纤维,药物释放曲线在16小时内几乎呈直线,表明酮洛芬的释放达到了控释效果.
然而,大多数有机溶剂如二氯甲烷、三氯甲烷、六氟异丙醇、四氢呋喃、丙酮、N-N二甲基甲酰胺等具备毒性大特点.这些有机溶剂一方面在纺丝过程中对环境及人体造成潜在危害,另一方面核壳纳米纤维中残留的有机溶剂在后期加工与药物释放过程中仍然有潜在不良影响.
3.2 亲水性药物
亲水性药物是指在水中可以溶解的药物.对于亲水性药物如盐酸阿霉素等,如果直接与亲水性高聚物直接水溶制备载药基体,由于高分子与药物都亲水,存在药物突释问题,并不适合药物缓释应用.因此,使用核壳结构纳米纤维来包覆亲水性药物,当壳层材料疏水时,由于壳层材料的包覆作用,可以对内层亲水性药物起到屏障作用,从而达到控释效果.
周丽等[36]在其论文中用微溶胶静电纺丝技术,制备出平滑均一的核壳结构纤维构成的复合纤维膜,核层由装载了药物磷酸氯喹CQ的透明质酸水溶胶构成,壳层为聚合物左旋聚乳酸PLLA,纤维内部药物包封率达到80%,且能够达到长效释放的效果.Sultanova等[22]以载氨比西林的PCL溶液为核层,以纯PCL溶液为壳层,通过改进的同轴静电纺法调节制备了核壳结构纳米纤维.研究结果显示具有核壳结构的纳米纤维药物释放动力学接近于零级动力学,而混纺纤维则表现出严重的突释.其研究中改进的同轴静电纺丝方法为低相容性药物的药物控释提供了可能.Yan等[40]在研究中以载阿霉素DOX的PVA溶液为核层,以壳聚糖溶液为壳层,通过同轴静电纺丝发制备了核壳结构纳米纤维,药物释放研究中DOX的释放可以通过改变核壳溶液流速达到控释效果,释放出的DOX可以有效抑制人卵巢癌细胞的生长,可以应用于人卵巢癌的化学治疗.Ojah等[41]在其研究中,以PVA为壳层材料,以载阿莫西林的蚕丝溶液为核层材料制备了核壳结构纳米纤维,所得材料可用于抗菌创伤辅料的药物释放研究.
然而,亲水性药物一般溶于水中作为核层参与纺丝.而壳层多为疏水性高聚物溶解在有机溶剂中作为载体.纺丝过程中,部分壳层纺丝液在接触核层水溶液时,容易发生相变析出,这在一定程度上影响纺丝过程顺利进行.
3.3 生物大分子
生物大分子指自然届生物体细胞内存在的如蛋白质、生长因子、多糖、核酸等多种大分子,分子量分布范围十分广泛(从几万到几百万).而绝大多数酶就属于蛋白质.生物大分子在环境或反应体系中容易失去活性[42],因而利用核壳结构的纤维将生物大分子包载在纤维内部,可以有效避免生物大分子失活.此外,核壳结构纳米纤维还可以用来包载一些纳米粒子如银离子颗粒等[43]通过控制银离子释放速率实现功能化.
Xiao等[44]制备了葡萄糖氧化酶固定的新型葡萄糖敏感性支架,PEO载人骨形成蛋白-2(rhBMP-2)作为核层,交联的聚乙烯醇与壳聚糖同时混合形成外壳层制备了核壳结构纳米纤维,人骨形成蛋白的稳定释放用来修复糖尿病大鼠的下颌骨缺损.Rubert等[45]利用同轴静电纺丝方法制备了载成纤维细胞生长因子(FGF-2)的PCL/PEO核壳结构纳米纤维,成纤维细胞生长因子的控释有利于成纤细胞的粘附、活性和增殖,有利于延长结缔组织的功效和寿命.Su等[46]用混纺和同轴静电纺丝法分别制备了载双重药物罗丹明B和牛血清蛋白BSA的复合纳米纤维和核壳结构纳米纤维,研究发现两种药物的释放速率可以通过同轴静电纺丝工艺参数进行调节,在组织工程、癌症的协同治疗方面具有潜在应用.
4 结论与展望
(1)核壳结构纳米纤维能够有效改善药物突释问题,达到缓释目的.而同轴静电纺制备核壳纳米纤维具有连续性与均匀性好等独特优势,具备实际应用前景.
(2)然而,核壳结构纳米纤维应用于药物缓释体系存在以下问题:一是目前核壳结构纳米纤维的制备目前也仅停留在实验室研发阶段,不能满足大规模工业化生产.产品结构单一,实际应用较困难.二是制备核壳结构纳米纤维的纺丝溶液溶剂主要是一些有机溶剂,如三氯甲烷、六氟异丙醇等,这些溶剂价格高,毒性大.三是核壳结构用于药物释放实验大多为体外释放研究,体外释放只是模拟体内,其精确度不高,离临床应用还有一定的距离.
(3)因此,核壳结构纳米纤维应用于药物缓释体系发展方向如下:首先,为更好制备核壳纳米纤维,加强相关设备创新与开发是可行的方向之一.其次,目前研究者开始探索使用纯水或稀酸溶液作为溶剂.相关的研究与发展为核壳结构药物缓释体系绿色构建奠定基础.再次,为更好展开实际应用,核壳结构纳米纤维膜在用于生物医药材料前,还需进行严格的动物实验和体内释放研究,为相关临床试验和实际应用积累实践与理论经验.
